健康妇女生殖道内格氏乳杆菌的分离鉴定与安全性评价
苏炳森,操龙斌,郑介婷,张 琳,张子康,邱 峰
1广东省中山火炬开发区医院检验科,广东 中山 528437;2南方医科大学第七附属医院医学检验科,广东 佛山 528244;3南方医科大学中医药学院,广东 广州510515
女性生殖道微环境是由多种细菌组成的复杂动态体系,它对维护生殖系统的健康至关重要,生殖道菌群失调是导致女性发生各种妇科疾病的重要原因[1,2]。近年来,由于抗生素的过度使用导致产生了诸多的耐药菌,而由耐药菌引起的女性生殖道感染往往容易出现病情反复不易根治的特点。与其他体内菌群不同,女性生殖道菌群一般是以乳杆菌为主,该菌是一种能够分解多种糖类并产生大量乳酸的革兰氏阳性菌[3,4]。乳酸杆菌可通过诸如产酸、H2O2、细菌素以及竞争排斥作用等多种机制抑制其它致病菌种的生长[5],这对维持生殖道酸性微环境非常重要[6]。研究表明,乳酸杆菌中的一部分菌种对人体保健及疾病治疗方面有较为突出的效果[7,8]。
格氏乳杆菌于2000年首次分离得到并通过对比发现其与嗜酸乳杆菌16S rRNA基因序列不同而鉴定为新种[9]。研究发现女性生殖道中主要存在的乳酸杆菌为卷曲乳杆菌和格氏乳杆菌[10]。后续研究显示格氏乳杆菌作为生殖道中最重要的乳杆菌之一[5],因其可产生多种抗菌活性物质,直接抑制生殖道内病原体的定植,因此对维护生殖道微环境健康具有重要的作用[11]。此外,格氏乳杆菌还广泛存在于人体的胃肠道中,是一种发酵乳酸菌,可作为益生菌添加在食品中[12]。在筛选新的益生菌菌株时,应符合安全标准。乳酸杆菌是一种常见的益生菌,是一种公认的具有益生效应微生物,已广泛用于医药、食品和饲料工业;但在极少数情况下,它们可能会导致菌血症和心内膜炎等临床症状[13]。这些报告引起了人们对这些益生菌的安全性的担忧,尤其是那些被列入人类食品、药品目录的菌株。此外,益生菌的益生功效和安全性往往是来自特定菌株[14]。例如,格氏乳杆菌通常被认为是非致病性的,但有案例表明一些格氏乳杆菌可引起了严重的感染,包括肺炎、尿路感染和脓胸[15-17]。因此,应对新分离得到的乳酸杆菌进行菌种鉴定以及安全性评价以排除有害影响。
本研究从健康妇女生殖道分泌物中分离菌株LGⅤ03,经形态及生理生化鉴定、16S rDNA与pheS鉴定、以及系统发育树分析,菌株LGⅤ03被鉴定为格氏乳杆菌。鉴于格氏乳杆菌对维护女性生殖道健康有极其重要的作用,我们对新分离得到的格氏乳杆菌LGⅤ03进行安全性评价,包括微生物菌种溶血实验、药物敏感性实验和小鼠毒性实验。具体报告如下。
1 材料和方法
1.1 材料与仪器
1.1.1 样品来源 格氏乳杆菌LGⅤ03分离自8份健康育龄女性的生殖道分泌物中的50株乳酸菌,从其中筛选出1株益生菌,由南方医科大学第七附属医院医学检验科分离并保存,已在中国微生物菌种保藏管理委员会普通微生物中心完成菌种保藏,保藏编号为CGMCC No.22010。阴性对照菌:CICC 10417英诺克李斯特氏菌;阳性对照菌:CICC 10473金黄色葡萄球菌均购自中国微生物菌种保藏管理委员会普通微生物中心。本研究已通过医院伦理委员会审查。
1.1.2 实验动物 SPF级BALB/c小鼠20只,雌雄各半,体质量18~22 g,由江苏集萃药康生物科技股份有限公司提供,合格证号:SCXK(苏)2018-0008。
1.1.3 实验试剂 MRS固体培养基(青岛海博生物技术公司),血琼脂平板(青岛海博生物技术公司),DL2000 DNA Marker(TaKaRa),细菌基因组DNA提取试剂盒(广州美杰生物科技有限公司)。
1.1.4 主要仪器 生物安全柜(HR50-IIA2型,青岛海尔生物医疗股份有限公司),厌氧工作站(E500G型,美国Gene Science),全自动高压灭菌锅(LS-150L-D型,江阴滨江医疗设备有限公司),台式高速冷冻离心机(H1850R型,湖南湘仪实验室仪器开发有限公司),日立全自动生化分析仪(7600型,日本日立公司),全温振荡器(THZ-C-1型,苏州培英实验设备有限公司)。
1.2 方法
1.2.1 样品采集 用无菌拭子伸入阴道5~10 cm处,棉拭子头在阴道内壁旋转一圈,然后将棉拭子头放入0.85%生理盐水采样管内,用管口切断拭子,使拭子头部掉落保护液内,立即拧紧管盖,置于4 ℃保存。
1.2.2 菌株分离 将分泌物用0.85%生理盐稀释至10-5和10-6,分别接种于MRS固体培养基,置于厌氧工作站内37 ℃培养48 h,挑取平板上的单菌落划线分离得到纯菌落。将平板上的纯菌落接种于MRS液体培养基中,37 ℃厌氧培养12 h,加入20%甘油,置于-80 ℃冰箱保存。
1.2.3 形态及生理生化鉴定 将分离出的菌株划线接种在MRS固体培养基中,置于厌氧工作站内37 ℃培养48 h,观察菌落宏观形态。另外,对分离出的菌株进行革兰氏染色后置于显微镜下观察,红色为革兰氏阴性菌,紫色为革兰氏阳性菌。同时用ⅤITEK ANC鉴定卡进行生理生化性质鉴定。
1.2.4 分子生物学鉴定 提取所获得菌株的基因组DNA,通过PCR方法扩增16S rDNA和pheS全长片段,通过测序鉴定菌株的种属。实验采用20 μL PCR反应体系:模板2 μL,TaKaRa Premix TaqTM10 μL,正、反引物各1 μL,ddH2O 6 μL。阴性对照模版以ddH2O代替。PCR反应条件:95 ℃5 min;95 ℃30 s,55 ℃30 s,72 ℃45 s,30个循环;72 ℃10 min。PCR产物经电泳后,送往广州天一辉远基因科技有限公司测序,然后在NCBI数据库库(Update 2020.10.23)进行BLAST序列比对。此外根据pheS序列,MEGA5.0软件采用邻位连接法确定分离菌株与相关菌种的系统发育树,进行1000次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株。上述引物均由上海生工生物工程有限公司合成,引物序列见表1。
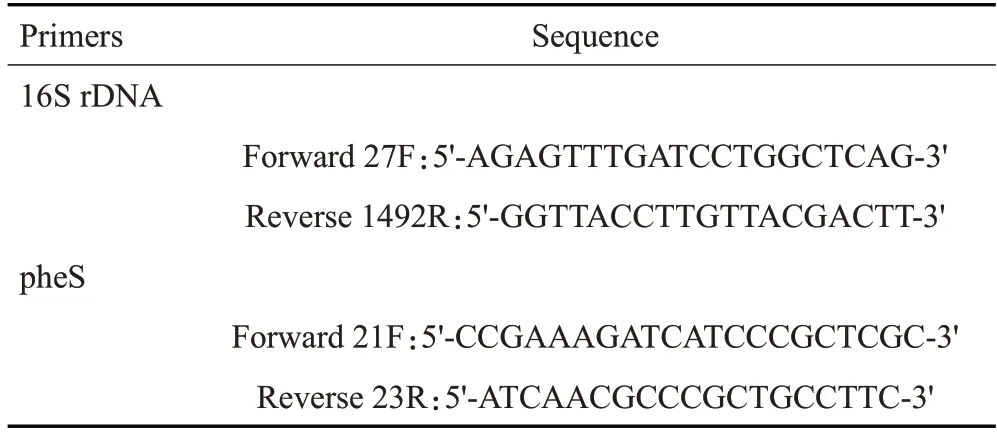
表1 qRT-PCR引物序列Tab.1 qRT-PCR primer
1.2.5 溶血性试验 将分离菌株接种在血琼脂平板上,同时以CICC 10417英诺克李斯特氏菌作为阴性对照菌,CICC 10473金黄色葡萄球菌作为阳性对照菌,37 ℃厌氧条件培养48 h,观察血琼脂平板上是否出现溶血环。
1.2.6 药敏试验 采用E-test法测定分离菌株对常用抗菌类药物的敏感性。将分离菌株涂布接种于MRS培养基表面,用镊子将青霉素、氨苄西林、美罗培南、万古霉素、红霉素、利奈唑胺、克林霉素试验试条放置于培养基表面,置于厌氧工作站内37 ℃培养并测得MIC。
1.2.7 乳酸产量测定 将分离菌株接种于MRS液体培养基,置于厌氧工作站内37 ℃培养14 h,调整菌株浓度为1×106CFU/mL,再接种于新鲜MRS液体培养基中,按体积分数5%接种于厌氧培养瓶中,置于37 ℃、150 r/min的全温振荡器内培养后,运用日立全自动生化分析仪检测菌株发酵上清液中的乳酸浓度。
1.2.8 小鼠毒性实验 将18~22 g BALB/c小鼠20只,随机均分为正常组、菌液组,10只/组,每组雌雄各半。正常组每只小鼠经口灌胃0.5 mL生理盐水(0.85%),菌液组每只小鼠经口灌胃0.5 mL新鲜菌液(1.0×1010CFU/mL),1次/d,连续灌胃3 d,每天称体质量。连续观察1周,处死后取肝脏、心脏、肾脏、肺、胃、脾称重,并根据下列公式计算脏器指数。脏器指数=器官质量/小鼠体质量。
1.3 统计处理
采用SPSS 19.0软件统计处理数据,实验数据均用均数±标准差表示,组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 形态及生理生化鉴定
菌株LGⅤ03接种于MRS固体培养基上,37 ℃厌氧生长良好,形成呈圆形、白色、表面湿润、不透明、边缘整齐的白色菌落(图1A)。革兰氏染色结果显示:菌株呈杆状,单个或成对排列,大小为0.4~0.5 μm×0.9~6.3 μm,革兰氏染色为阳性(图1B)。
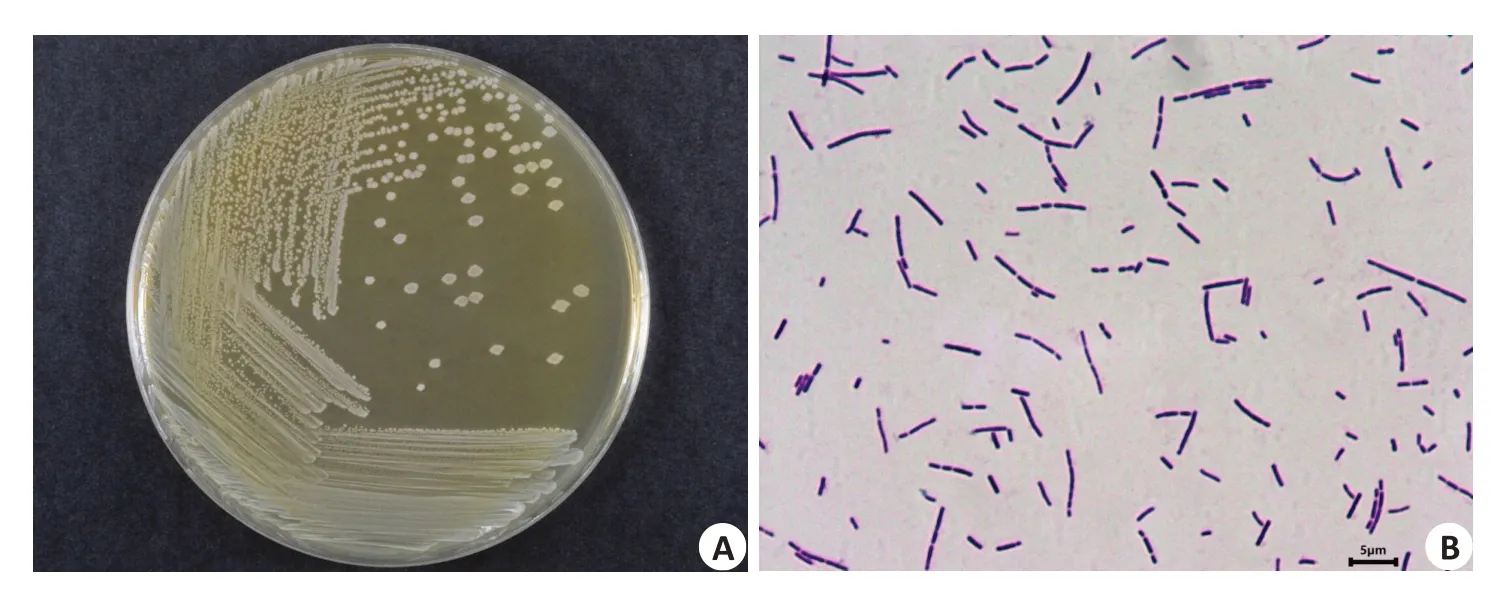
图1 菌株LGⅤ03菌落形态特征Fig.1 Morphological characteristics of strain LGV03.
分离菌株可发酵蔗糖、麦芽三糖、D-葡萄糖、熊果甙、D-纤维二糖、D-甘露糖、D-麦芽糖和5-溴-4-氯-3-吲哚-β-D-葡萄糖苷(表2)。丙氨酸-苯丙氨酸-脯氨酸芳氨酶、亮氨酸芳氨酶、L-吡咯烷酮芳氨酶和苯丙氨酸芳氨酶实验为阳性,且能水解七叶苷(表3)。根据上述形态特点、生理生化特性结果可初步鉴定分离菌株为乳杆菌属。

表2 菌株LGⅤ03糖发酵试验结果Tab.2 Carbohydrate fermentation test results of strain LGV03
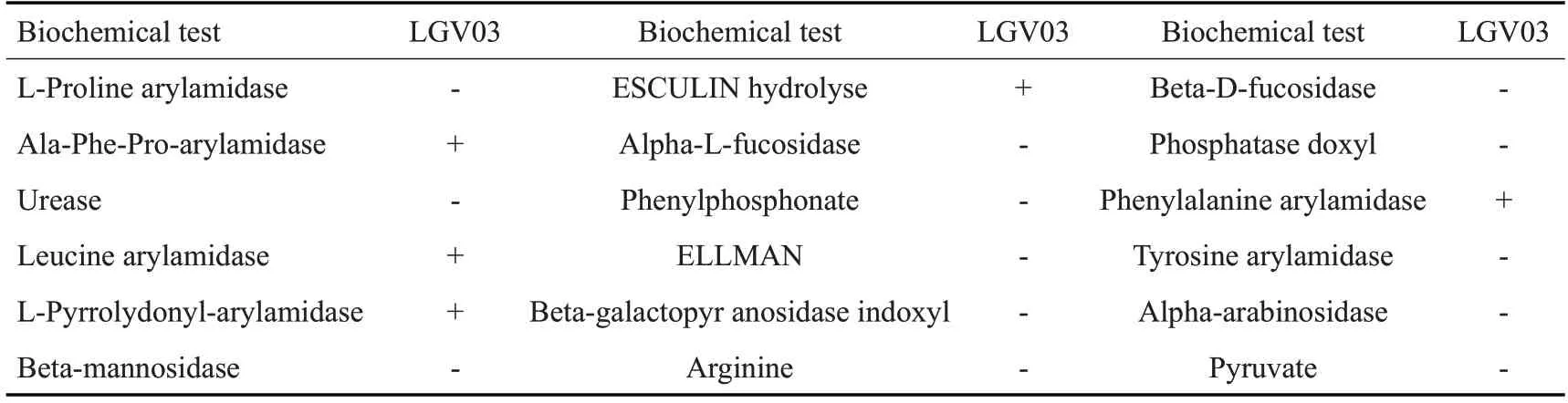
表3 分离菌株LGⅤ03生化反应结果Tab.3 Biochemical reaction results of isolated strain LGV03
2.2 分子生物学鉴定
将菌株LGⅤ03 16S rDNA 及pheS 测序结果在GenBank数据库进行比对。结果显示菌株LGⅤ03与Lactobacillus gasseriATCC 33323(CP000413)、Lactobacillus gasseriLMG 9203(AM087695)同源性均达到100%(图2)。
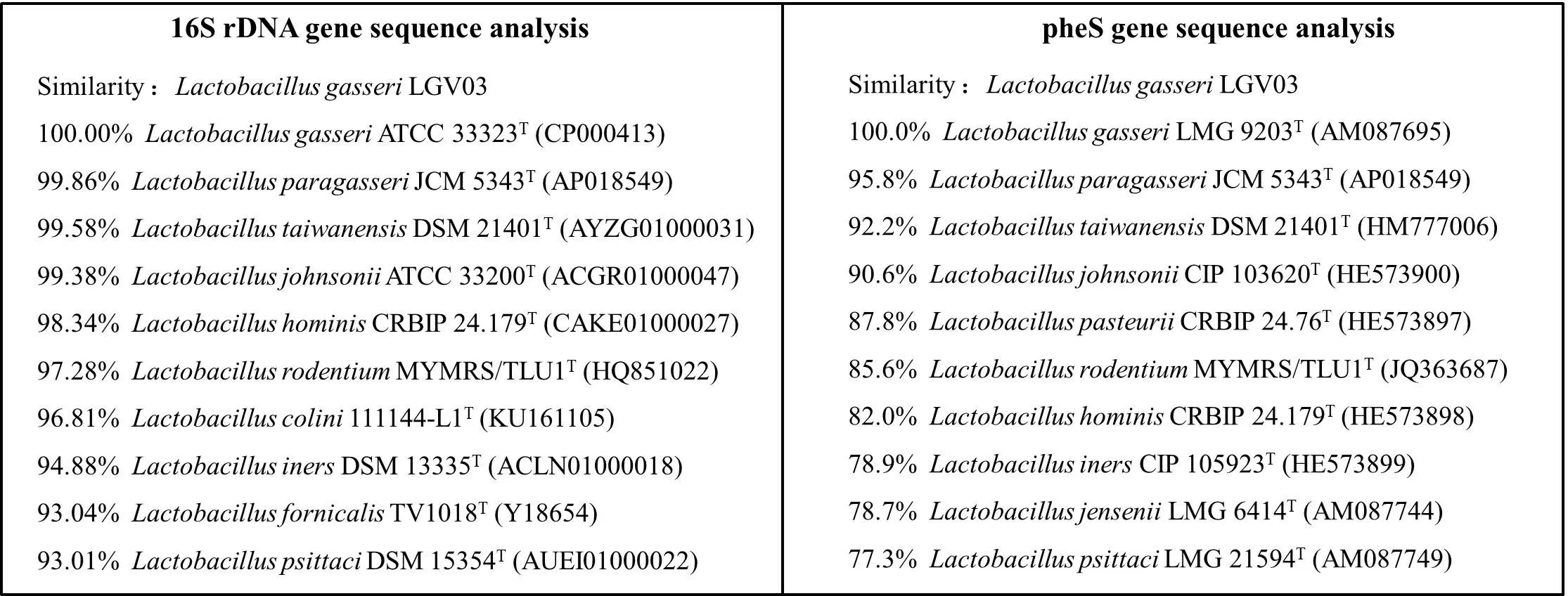
图2 菌株LGⅤ03 16S rDNA及pheS基因序列比对分析Fig.2 16S rDNA and pheS sequence analysis of strain LGV03.The superscript"T"represents the model strain.
根据Blastn结果,选择与菌株LGⅤ03同源性较高的11株乳杆菌16S rDNA和pheS序列用软件MEGA构建系统发育树(图3)。结果显示,菌株LGⅤ03与格氏乳杆菌处于同一个小分支,亲缘关系最近,由此可以进一步将菌株LGⅤ03归属于格氏乳杆菌。
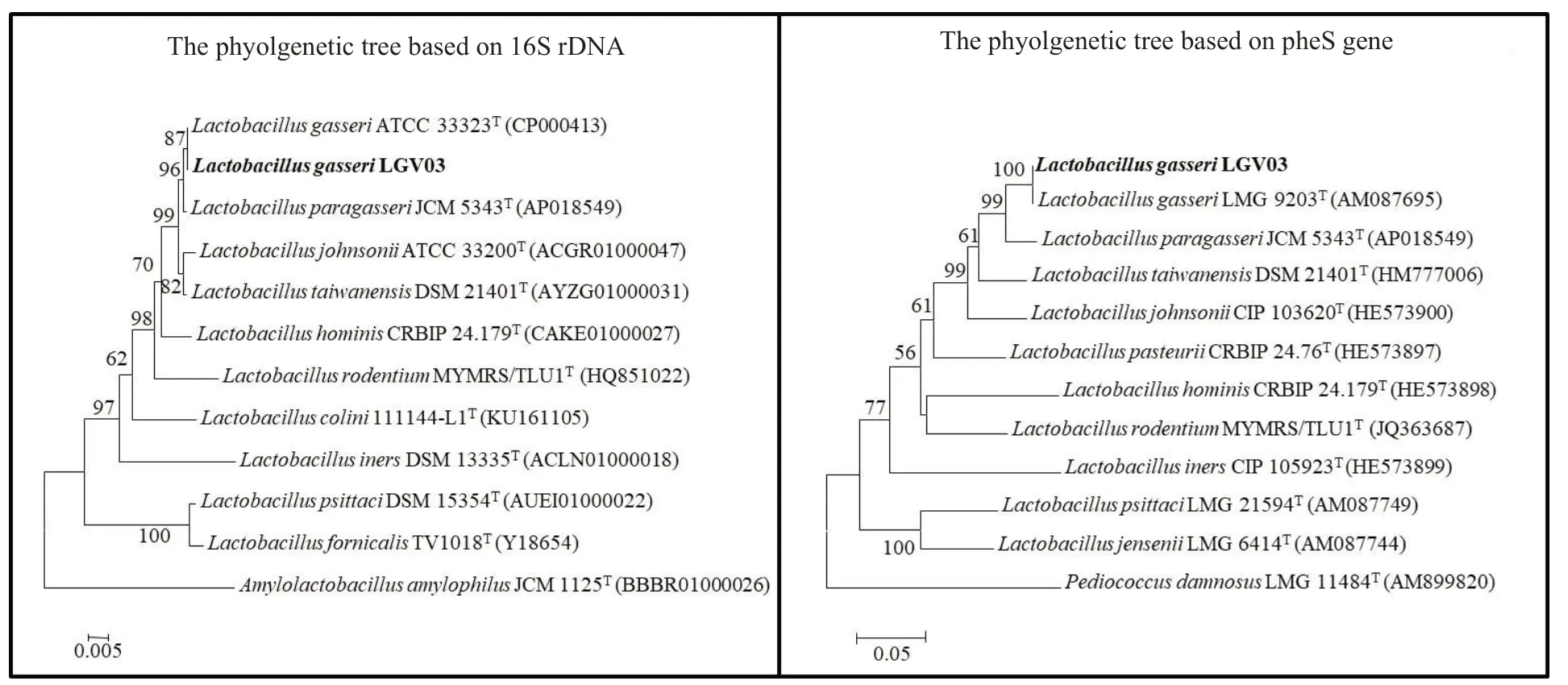
图3 菌株LGⅤ03 16S rDNA、pheS基因序列系统发育树Fig.3 Phylogenetic analysis of strain LGV03 based on 16S rDNA and pheS.The superscript"T"represents the model strain.
2.3 溶血实验
阴性对照菌CICC 10417英诺克李斯特氏菌在血液琼脂平板上不出现溶血环,而阳性对照菌CICC 10 473金黄色葡萄球菌在血液琼脂平板上出现溶血环。格氏乳杆菌LGⅤ03与阴性对照菌CICC 10 417类似,在血液琼脂平板上未出现溶血环(图4)。
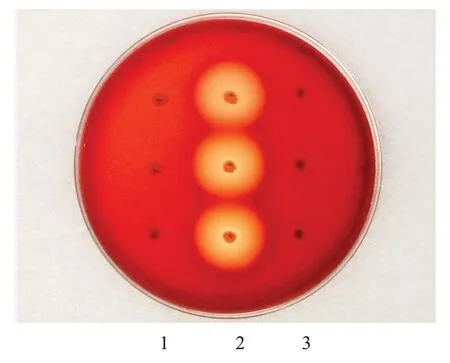
图4 格氏乳杆LGⅤ03菌溶血反应检测结果Fig.4 Test results of hemolytic reaction of Lactobacillus gasseri LGV03.1:Negative control bacteria: Listeria innocua CICC 10417.2:Positive control bacteria: Staphylococcus aureus CICC 10473.3:Lactobacillus gasseri LGV03.
2.4 药物敏感性检测
格氏乳杆菌LGⅤ03对青霉素、氨苄西林、美罗培南、万古霉素、红霉素和利奈唑胺敏感,对克林霉素耐药。具体最低抑菌浓度(MIC)及药敏性(图5,表4)。
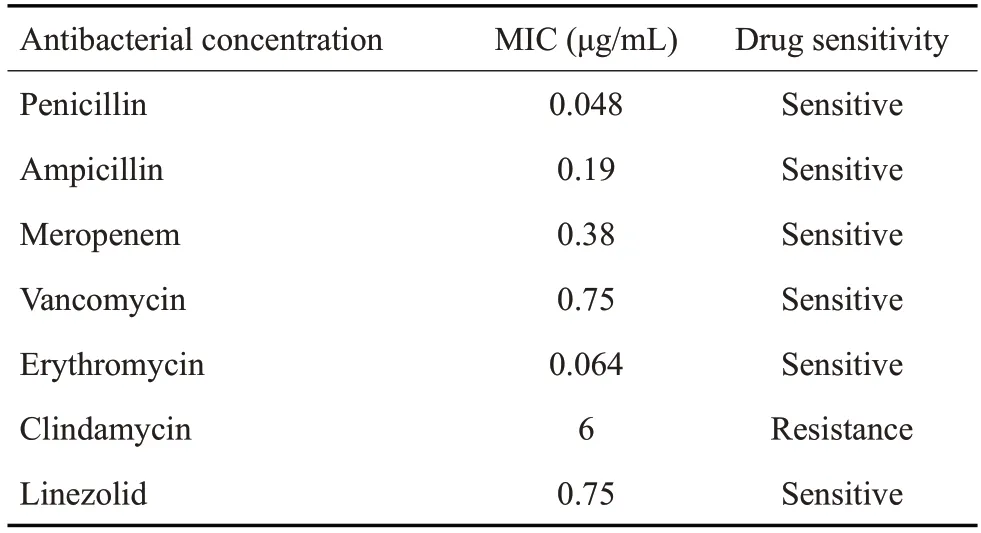
表4 格氏乳杆菌LGⅤ03 MIC值及药敏性Tab.4 MIC value and drug sensitivity of Lactobacillus gasseri LGV03
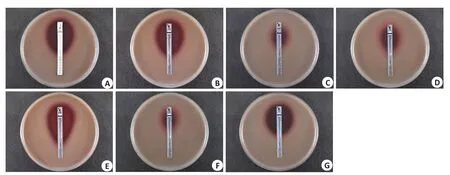
图5 格氏乳杆菌LGⅤ03敏感检测Fig.5 Drug sensitivity tests of Lactobacillus gasseri LGV03.A:Penicillin (PEN) MIC:0.048 μg/mL.B:Ampicillin (AM) MIC:0.19 μg/mL.C:Meropenem(MP)MIC:0.38 μg/mL.D:Vancomycin(VA)MIC:0.75 μg/mL.E:Erythromycin(EM)MIC:0.064 μg/mL;Clindamycin(CM)MIC:6 μg/mL.F:Linezolid(LZ)MIC:0.75 μg/mL.
2.5 乳酸产量测定
将格氏乳杆菌LGⅤ03接种于MRS液体培养基,厌氧37 ℃振荡培养后,测菌株发酵上清液中的乳酸浓度,结果显示,菌株接种到培养基后即开始发酵产生乳酸,约18 h后达到饱和浓度,最终乳酸产量达到1.72 mg/mL(图6)。

图6 格氏乳杆菌LGⅤ03发酵乳酸产量Fig.6 Lactic acid production by Lactobacillus gasseri LGV03 in fermentation test.
2.6 小鼠毒性实验
在整个实验期间,生理盐水组和格氏乳杆菌LGⅤ03组小鼠未出现明显的活动或行为变化,也没有发生疾病或死亡。同时,生理盐水组与格氏乳杆菌LGⅤ03 组小鼠的体质量差异无统计学意义(P>0.05,表6)。另外,格氏乳杆菌LGⅤ03组小鼠的器官重量和脏器指数与生理盐水组相比差异均没有统计学意义(P>0.05,表6)。
3 讨论
临床试验表明,格氏乳杆菌具有维持肠道稳态、减轻幽门螺杆菌感染、抑制病毒感染等作用[18-20]。格氏乳杆菌发挥上述益生效应主要通过产生乳酸、细菌素、H2O2,以及抑制病原体侵袭上皮细胞等[21]。虽然格氏乳杆菌很少作为临床上引起严重感染的原因,但已有文献报道一些格氏乳杆菌可引起肺炎、尿路感染和脓胸[13-15]。因此,本研究对分离自女性生殖道的菌株进行形态及生理生化鉴定、分子生物学鉴定、以及安全性评价,以便后续将其开发为益生菌候选物以改善宿主生殖道的微生物平衡。
经生理生化鉴定、16S rDNA与pheS鉴定、以及由系统发育树显示,菌株LGⅤ03被鉴定为格氏乳杆菌,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为CGMCC No.22010。生殖道内稳态受到生殖道中乳杆菌产生的乳酸的保护。乳杆菌通过产生乳酸,使阴道pH值保持在4.5以下,可防止病原体的繁殖[17]。有研究证明从女性生殖道分离的嗜酸乳杆菌CRL1259通产生乳酸抑制大肠杆菌的生长[22]。本研究中,格氏乳杆菌LGⅤ03在MRS培养基中能够生产乳酸,表明其具降低生殖道pH和抑制病原体繁殖的潜能。
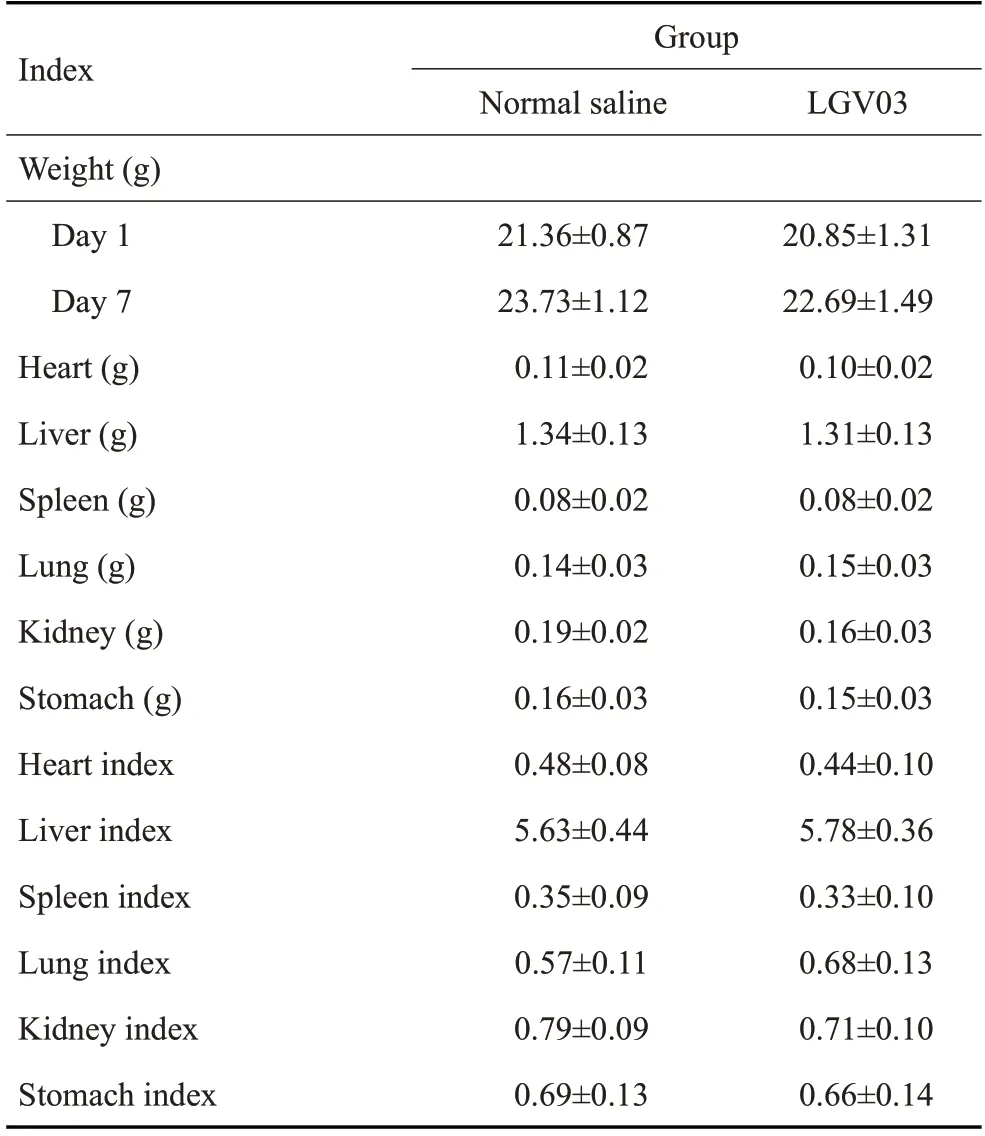
表5 格氏乳杆菌LGⅤ03小鼠经口急性毒性Tab.5 Results oral acute toxicity test of Lactobacillus gasseri LGV03 in mice(n=10,Mean±SD)
关于抗生素耐药性,有研究显示来源于人类粪便中的乳酸杆菌对红霉素和/或四环素具有耐药性[23,24]。因担心食品中使用的微生物可能成为传播抗生素抗性基因的载体。乳酸杆菌的安全性评估应包括检测其抗生素耐药性特征[25]。在我们的研究中,格氏乳杆菌LGⅤ03对青霉素、氨苄西林、美罗培南、万古霉素、红霉素和利奈唑胺敏感,而对克林霉素具有抗性。与我们的结果相似,有研究发现4株格氏乳杆菌对克林霉素均产生耐药性[24]。然而,有文献报道格氏乳杆菌CECT5714对氨苄西林、克林霉素、红霉素、青霉素、万古霉素等均敏感[24]。因此,相同菌种不同菌株在抗菌药物敏感性方面会有差异。除了研究格氏乳杆菌LGⅤ03溶血性和药敏性外,小鼠口服急性毒性试验显示,口服格氏乳杆菌LGⅤ03(1.0×1010CFU/mL)的小鼠未出现明显的活动或行为变化,也未出现死亡,表明格氏乳杆菌LGⅤ03对小鼠的健康状况、生长和发育未产生严重的毒性效应。部分研究也表明格氏乳杆菌CECT5714对小鼠食物摄入、体质量和一般健康状况没有有害影响[25]。
综上所述,本研究鉴定了来自健康女性生殖道的菌株LGⅤ03为格氏乳杆菌,以及评估其益生特性和安全性,发现格氏乳杆菌LGⅤ03具有潜在的益生效应和安全性,可用于开发一种有益于生殖道健康的益生菌制剂。