靶向SF3B1突变型葡萄膜黑色素瘤的药物筛选
罗 昕,任重鲁,刘小莲,张贵明,黄思思,余 乐,李亦蕾
1南方医科大学南方医院药学部,广东 广州 510515;2广东药科大学医药信息工程学院,广东 广州 510006;3南方医科大学药学院,广东 广州510515
葡萄膜黑色素瘤(UM)起源于眼部葡萄膜的黑色素细胞。目前,放射疗法和手术切除是治疗原发性葡萄膜黑色素瘤的有效手段。但是,超过一半的患者会发展成为转移性葡萄膜黑色素瘤,对于转移性的葡萄膜黑色素瘤患者,化疗和免疫疗法效果并不理想,患者的中位生存期只有6~12月[1,2]。
SF3B1基因编码小核糖核蛋白snRNP的一个重要亚基,参与mRNA剪接的早期阶段。SF3B1突变蛋白识别异常的分支位点,导致异常的可变剪接模式[3,4]。SF3B1基因在葡萄膜黑色素瘤中的突变率高达20%[5],并且与中等程度的恶性转移相关[6,7]。SF3B1突变相关的异常剪接模式提示剪切体有可能成为肿瘤治疗的靶标[8],与正常细胞相比,携带SF3B1突变的肿瘤细胞有可能对剪接体抑制剂更为敏感[9-12]。已有研究发现靶向SF3B1的剪切体抑制剂E7107和H3B-8800对携带剪切因子突变的髓系血液病有更强的的抑制作用[11,13]。但是,E7107的一期临床试验因存在视觉毒性而中止[13-15]。目前还没有安全有效的药物靶向SF3B1基因发生突变的肿瘤,包括葡萄膜黑色素瘤。
本研究通过CRISPR-Cas9构建SF3B1突变等位基因敲除的葡萄膜黑色素瘤细胞Mel202 SF3B1 mut-KO#1克隆,与亲代Mel202细胞(携带SF3B1杂合突变)组成同基因型细胞模型,并对细胞模型进行表型检测;进而利用该细胞模型,自药物库筛选对携带SF3B1突变Mel202细胞有选择性抑制作用的药物。本研究旨在为携带SF3B1突变的葡萄膜黑色素瘤患者探索个体化治疗药物。
1 材料和方法
1.1 材料
1.1.1 细胞株UM细胞株Mel202(SF3B1R625G),OMM2.3(SF3B1WT)由加州大学圣地亚哥分校药理系管坤良教授实验室馈赠。
1.1.2 主要试剂 胎牛血清(Gibco)、1640 培养基(Gibco)、T4 DNA Ligase(NEB)、DL5000 DNA ladder(天根生物)、BsmBI限制性内切酶(NEB)、DH5α化学感受态细胞、2×Rapid Taq Master Mix(Ⅴazyme)、质粒小提试剂盒(天根生物)、DNA提取试剂盒(Invitrogen)、逆转录试剂盒(Promega)、SYBR荧光定量PCR试剂盒(Takala)、DNA 纯化回收试剂盒(promega)、Anti-SF3B1 antibody(CST);上市药物库(L1000)和已知活性库(L4000)(Targetmol);pLXⅤ-IRES-SF3B1R625G-NFlag-puro以及pLXⅤ-IRES-SF3B1WT-N-Flag-puro质粒(优宝生物)。
1.1.3 主要仪器 酶标仪(Bio-Rad)、电泳仪(Bio-Rad)、2720 Thermal Cycler普通PCR仪(Applied Bioisystemms)、核酸电泳电泳系统(天能科技)、荧光定量PCR 仪(LC480)、酶联免疫斑点分析仪(TCL)。
1.2 方法
1.2.1 UM患者数据获取与分析 通过cBioportal平台初步分析SF3B1基因在TCGA葡萄膜黑色素瘤患者队列中的突变频率和突变类型,根据葡萄膜黑色素瘤患者SF3B1基因的突变情况将患者分成两组,SF3B1野生型(61 例)和SF3B1 突变型(18 例);并下载TCGA UM RNA-seq数据,通过psichomics软件进行PCA主成分分析,比较SF3B1的突变状态对转录组可变剪接的影响。
1.2.2 构建SF3B1突变等位基因敲除的CRISPR-Cas9载体 构建CRISPR-Cas9载体靶向SF3B1基因:通过网站(http://chopchop.cbu.uib.no),设计CRISPR Guide RNA(gRNA)序 列(5-AAGATCGCCAAGACTCAC GA-3)。通过常规限制性内切酶方法,将gRNA克隆至CRISPR-Cas9载体px459(Addgene),Sanger测序确认插入序列。扩增构建成功的质粒,置于-20 ℃备用。
1.2.3 筛选SF3B1突变等位基因选择性敲除的Mel202 SF3B1 Mut-KO 细胞株 将2 µg px459-SF3B1gRNA重组质粒通过polyJet转染试剂转入Mel202细胞,转染后细胞培养于含1 µg/mL 嘌呤霉素的完全培养基。Western blot验证SF3B1蛋白的下调后,通过流式细胞仪将细胞分选至96孔板培养(每孔1个细胞),长成单克隆后将细胞扩大培养。我们设计的gRNA靶向SF3B1基因的第1个外显子,而Mel202细胞携带SF3B1杂合突变,其突变发生于第14 个外显子。我们通过两轮Sanger测序,筛选SF3B1突变等位基因选择性敲除的细胞克隆。第1轮测序:提取细胞基因组DNA,PCR扩增包含gRNA 靶向序列的DNA 片段,Sanger 测序检测CRISPR-Cas9系统在SF3B1基因的一个外显子内进行的编辑,筛选有移码编辑的克隆进行第2轮测序;第2轮测序:提取细胞RNA,RT-PCR扩增跨越第1个外显子到第14 个外显子的cDNA 片段,Sanger 测序后确认SF3B1突变等位基因链的基因编辑情况,选择合适的单克隆进行后续试验。
1.2.4 Mel202 SF3B1突变基因敲除对细胞生长的影响生长曲线:将Mel202和Mel202 SF3B1 mut-KO接种至96孔板中,每孔2000个细胞。在贴壁后不同的时间点(第0,2,4,6 天),每孔加入20 µL MTT(5 mg/mL),37 ℃静置4 h后,吸走上清液,加入150µL DMSO,在平板振荡器震荡10 min,溶解紫色结晶后测定样品在570 nm下的吸光度值A570nm。将不同时间点的吸光度值除以初始的吸光度值(第0天),计算细胞的增殖倍数,绘制细胞生长曲线。
克隆形成实验:将Mel202和Mel202 SF3B1 mut-KO两组细胞以2000/孔,接种于6孔板中,每组设置3个复孔,置于37 ℃、5%二氧化碳的培养箱中培养,4 d换1次液,培养10 d~2周,当六孔板中出现肉眼可见克隆的时候,停止培养。用结晶紫染色后,使用酶联免疫斑点分析仪扫描六孔板。
1.2.5 SF3B1 突变基因选择性敲除对DYNLL1 和ZDHHC16基因可变剪接的影响 按照RNA提取试剂盒的说明书,提取Mel202,SF3B1 mut-KO,OMM2.3细胞的总RNA并将其逆转录成cDNA;在OMM2.3细胞上过表达SF3B1R625G突变型和SF3B1WT野生型蛋白,Western blot 验证过表达成功后,提取3 组细胞的总RNA 并将其逆转录成cDNA,对基因ZDHHC16 及DYNLL1 的可变剪接事件进行RT-PCR 验证。根据ZDHHC16和DYNLL1的可变剪接区域设计相对应的引物,对ZDHHC16的Exon9,Intron9,Exon10(E9-I9-E10)区域以及DYNLL1的Exon1,Intron1,Exon2(E1-I1-E2)区域分别进行RT-PCR,琼脂糖凝胶电泳判断RT-PCR产物的分子量大小,割胶纯化产物进行Sanger测序。使用ApE 软件,比对产物序列,确定ZDHHC16 与DYNLL1在3'剪切位点发生可变剪接的具体位置。RTPCR引物见表1。
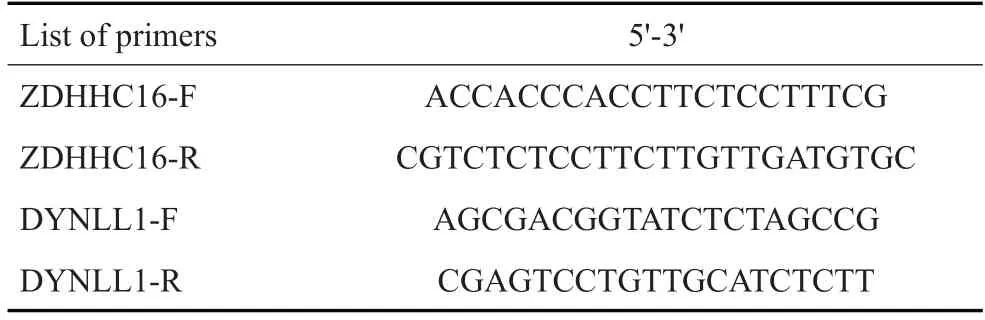
表1 引物列表Tab.1 List of primers
1.2.6 小分子化合物筛选 对Targetmol公司的已知活性化合物库(L1000)和上市药物库(L4000)进行分类筛选,从中挑选出155个具有抗肿瘤作用的小分子化合物组成我们此次筛选的化合物库。这些小分子化合物以10 mmol/L浓度存储在DMSO。将处于对数生长期,且生长状态良好的Mel202细胞和Mel202 SF3B1 mut-KO两组细胞接种于96孔板,每组3个复孔,2000/孔。接种细胞24 h开始药物处理,设置实验组(1∶1000稀释化合物)和对照组(0.1%DMSO)。药物处理3 d后,MTT检测并计算两组细胞的存活率(存活率=化合物作用下的吸光度值/对照组的吸光度值),用Fold change表示化合物对Mel202细胞的选择性,计算公式为:Fold change=存活率(Mel202 SF3B1 mut-KO)/存活率(Mel202),Fold Change越大,药物对Mel202细胞的选择性抑制作用越强。将初次筛选得到的FC≥2的13个小分子化合物设置10µmol/L,3µmol/L,1µmol/L,0.3µmol/L的浓度梯度作为实验组,对照组仅含有0.1%DMSO的培养基,配制后分别加入孔板中。药物处理3 d后,MTT检测并计算各组细胞的存活率,通过细胞存活曲线,检验药物的选择性是否有浓度依赖性。
1.2.7 统计分析 采用excel 软件进行统计分析,以均数±标准差进行统计描述。通过psichomics软件进行PCA主成分分析,所有实验独立重复3次,P<0.05为差异有统计学意义。
2 结果
2.1 TCGA葡萄膜黑色素瘤患者的数据分析结果
根据cBioportal平台上TCGA葡萄膜黑色素瘤患者的数据集初步分析,SF3B1基因的突变率高达24%(图1A),其热点突变影响第625位氨基酸(图1B),但SF3B1基因突变不引起mRNA水平的改变(图1C)。通过主成分分析法对葡萄膜黑色素瘤患者进行分析,结果表明SF3B1突变影响葡萄膜黑色素瘤患者的可变剪接模式(图1D)。主成分分析贡献前十的可变剪接事件如表2所示,包括可变的3'SS(ZDHHC16,HSF4,DYNLL1,MⅤP,HSPBP1),可变的初始外显子(WARS,CCND3),外显子跳跃(CLSTN1,RAB11FIP3)和可变的5'SS(COMMD5)。其中,可变的3'SS剪切模式发生的频率最高。
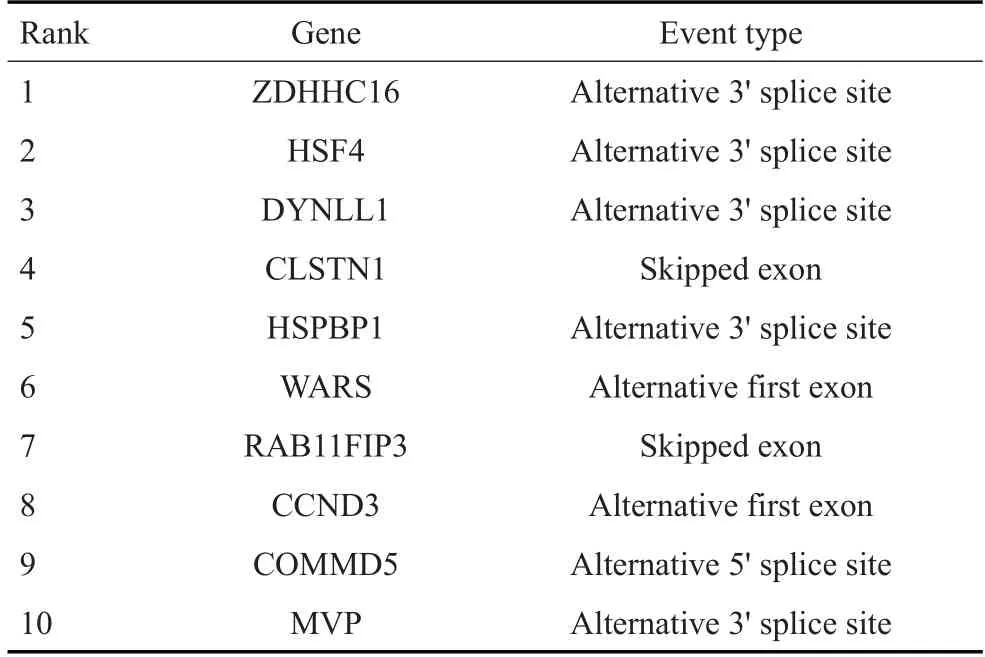
表2 主成分贡献前10的可变剪接事件Tab.2 The top 10 alternative splicing events contributing to principal component analysis

图1 SF3B1突变对TCGA UM患者可变剪接的影响Fig.1 Effects of SF3B1 mutation on alternative splicing in patients with uveal melanoma from TCGA.A:Mutation frequency of SF3B1 in TCGA uveal melanoma patients.B:Mutation sites of SF3B1 in TCGA uveal melanoma patients.C:Effects of SF3B1 mutation on SF3B1 mRNA levels in TCGA uveal melanoma patients.D:Principal component analysis of global alternative splicing in TCGA uveal melanoma cohort (SF3B1 mutation samples vs wild-type SF3B1 samples).
2.2 SF3B1突变基因选择性敲除的Mel202 mut-KO克隆的基因鉴定结果
通过链特异性Sanger测序明确SF3B1突变等位基因的被CRISPR-Cas9系统编辑的具体情况(图2A)。表3汇总了4个克隆中SF3B1基因编辑的情况。我们选择mut-KO#1克隆进行后续实验,该克隆SF3B1突变型等位基因发生了1 bp缺失的移码编辑,导致阅读框发生改变,提前出现终止密码子;而其野生型等位基因发生了3 bp缺失的非移码编辑,第8位的氨基酸由His(H8)变成Gln(Q8),并丢失了第9位氨基酸Glu(E9)。

表3 Mel202 SF3B1 mut-KO细胞克隆SF3B1基因链特异性编辑Tab.3 Allele-specific editing of SF3B1 gene in Mel202 SF3B1 mut-KO cell clones using CRISPR-Cas9 system
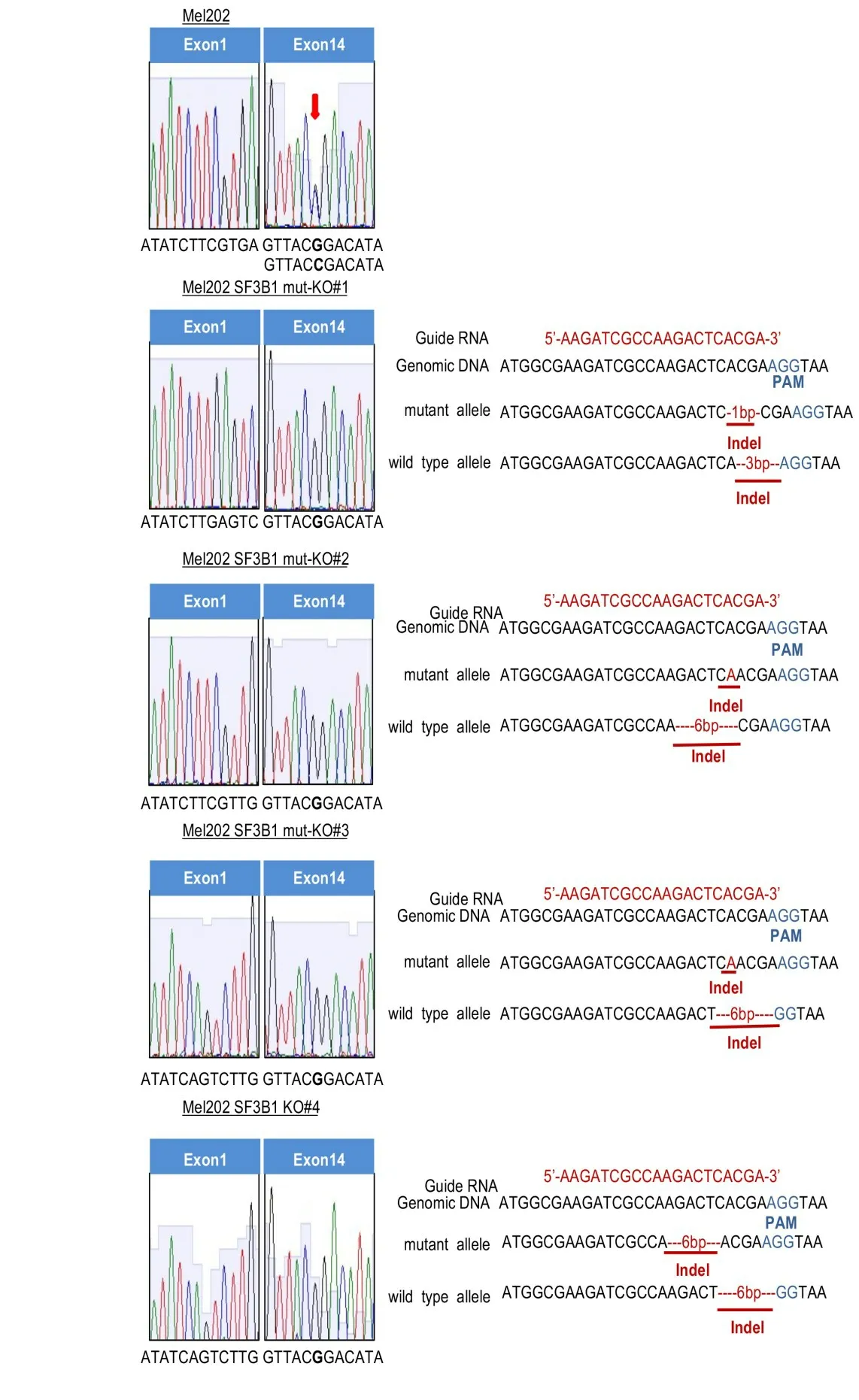
图2 SF3B1突变等位基因选择性敲除Mel202 mut-KO单克隆细胞的筛选Fig.2 Screening of Mel202 mut-KO clones with selective knockout of SF3B1 mutant allele and Sanger sequencing of the RT-PCR products of SF3B1 transcripts crossing exon 1 to exon 14.
2.3 选择性敲除SF3B1突变基因对细胞生长的影响
Mel202 细胞携带SF3B1 杂合突变,特异性敲除SF3B1突变型等位基因的细胞克隆(SF3B1 mut-KO#1)生长速度更快(图3A),形成的克隆数量也更多(图3B)。
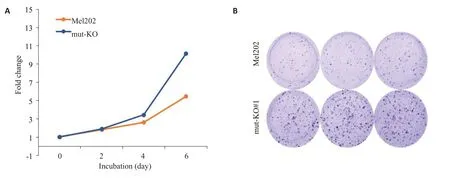
图3 Mel202 mut-KO#1克隆生长速度较亲代Mel202细胞更快Fig.3 Growth of Mel202 mut-KO#1 clone was faster than that of parental Mel202 cells.A:Cell growth curve determined by MTT assay.B:Colony-forming assay with crystal violet staining.
2.4 选择性敲除SF3B1突变等位基因对可变剪接的影响
Mel202 细胞的ZDHHC16(E9-I9-E10)转录本和DYNLL1(E1-I1-E2)转录本均存在两种可变剪接产物,而在SF3B1 突变等位基因选择性敲除的单克隆(Mel202 SF3B1 mut-KO#1)以上转录本只有一种剪接产物,这一模式与对照葡萄膜黑色素瘤细胞OMM2.3(SF3B1野生型)相同(图4A)。Sanger测序结果显示,与野生型SF3B1相比,SF3B1(R625G)使用了异常的3’剪接位点,导致在携带SF3B1杂合突变的Mel202细胞ZDHHC16和DYNLL1均存在2种转录本产物,而选择性敲除SF3B1(R625G)等位基因后,ZDHHC16 和DYNLL1均只剩下正常的一种转录本(图4B、C)。敲入点突变的细胞ZDHHC16和DYNLL1均产生了异常的转录本,但是敲入野生型基因的细胞只存在一种正常的转录本(图4D、F)。

图4 SF3B1突变等位基因选择性敲除影响ZDHHC16和DYNLL1转录本的可变剪接模式Fig.4 Selective deletion of SF3B1 mutant allele affects alternative splicing of ZDHHC16 and DYNLL1 transcripts.A:Agarose gel electrophoresis showing alternative splicing products of ZDHHC16 and DYNLL1 transcripts in Mel202,Mel202 mut-KO#1,and OMM2.3 cells.B:Sanger sequencing of the RT-PCR products of ZDHHC16 and DYNLL1 transcripts.C:SF3B1 (R625G) used cryptic 3' splicing site instead of canonical 3' splicing site.D:Western blotting of SF3B1protein expression.E:Agarose gel electrophoresis showing alternative splicing products of ZDHHC16 and DYNLL1 transcripts in OMM2.3 cells(Vec,SF3B1 WT,SF3B1 Mut).
2.5 小分子化合物筛选结果
为了寻找对携带SF3B1突变葡萄膜黑色素瘤具有选择性抑制活性的药物,我们将Mel202 SF3B1 mut-KO#1和亲代Mel202细胞组成SF3B1野生型和杂合突变的同基因型细胞模型,从已知活性化合物库(L1000)和上市药物库(L4000)中挑选了155个有抗肿瘤活性的化合物,筛选浓度为10 µmol/L,处理Mel202 和Mel202 mut-KO#1两组细胞3 d后,MTT法比较细胞活力。结果显示有13个化合物对Mel202细胞显示了比对Mel202 mut-KO#1 克隆更强的抑制作用(Fold change≥2)(图5A),其中7个是已上市药物(图5B),6个是已知活性化合物(图5C)。值得注意的是,对以上具有选择性的13个化合物作进一步量效关系研究发现,已上市药物tetrandrine和lapatinib对Mel202细胞的抑制作用具有剂量依赖性,并且从低浓度开始就表现出了对Mel202细胞的选择性抑制活性(图5B、C)。
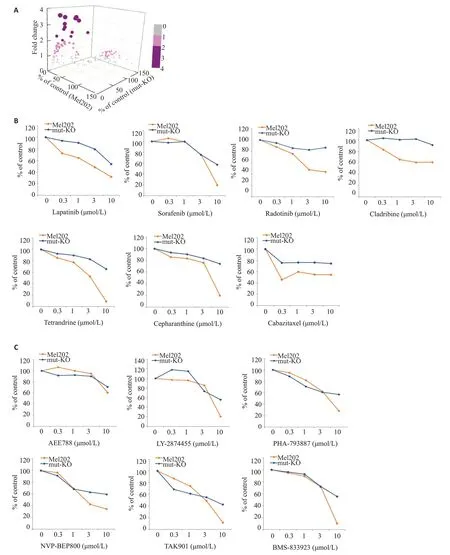
图5 选择性抑制Mel202细胞的小分子化合物筛选结果Fig.5 Screening of compounds that selectively inhibit Mel202 cells compared to Mel202 mut-KO#1 clone.A:The X-axis is the survival rates of Mel202 cells,Y-axis the survival rates of Mel202 SF3B1 mut-KO#1 clone,and Z-axis the fold change (FC) in response to individual compound treatment.Each dot represents a compound,and the dot size was proportional to the value of FC.FC<1,gray dots;1<FC<2,pink dots;FC≥2,purple dots.The cells were treated with individual compound at the concentration of 10µmol/L for 3 days.B,C:Dose-response curves of 7 marketed drugs(B)and 6 active compounds(C).
3 讨论
我们通过分析TCGA数据库中葡萄膜黑色素瘤患者转录组的可变剪接模式,发现SF3B1突变型患者与SF3B1野生型患者的可变剪接明显不同,众多的转录本发生了异常的可变剪接。进一步发现主成分分析贡献前十的可变剪接事件对应的基因与肿瘤的发展以及患者临床结局关系密切,比如,ZDHHC16参与DNA损伤修复,并与肝癌的预后相关[16];MⅤP通过抑制STAT3信号通路抑制肺癌[17,18]。已有研究报道,突变型SF3B1识别这些基因异常的分支位点,导致偏好性地使用异常的3端可变剪接位点,从而使受调控基因产生了异常的转录本[19]。这些异常可变剪接产物约有50%会通过无义突变介导的mRNA降解途径而被降解[19,20],导致编码蛋白水平的下降,从而调控肿瘤的发展或成为肿瘤易感性。这些发现为后续的细胞模型构建,个体化治疗药物筛选和靶向药物的机制探索奠定基础。
我们选择携带SF3B1热点突变的Mel202细胞株,利用CRISPR-Cas9技术构建了SF3B1突变等位基因敲除的Mel202 SF3B1 mut-KO单克隆细胞株。已有的研究表明Mel202细胞的生存依赖野生型SF3B1,而敲除野生型SF3B1等位基因将导致细胞的死亡[21]。同样我们发现选择性敲除突变SF3B1 等位基因的Mel202 SF3B1 mut-KO 克隆的生长速度更快,表明突变型SF3B1对细胞的增殖具有抑制作用。更为重要的是,我们发现Mel202 SF3B1 mut-KO 克隆和亲代细胞Mel202对ZDHHC16和DYNLL1的剪接模式分别模拟了TCGA葡萄膜黑色素瘤SF3B1野生型和突变型患者对这两个基因的剪接模式。基于以上对表型研究,我们认为Mel202 SF3B1 mut-KO克隆和亲代Mel202细胞可以作为药物筛选的同基因型细胞模型。
利用该组细胞模型,我们进一步筛选得到对13个具有抑制SF3B1突变型葡萄膜黑色素瘤活性的潜在化合物。我们首次发现这些药物在对突变型的UM具有选择性抑制作用。这些药物在肿瘤中的作用机制已有研究,其中,酪氨酸激酶抑制剂拉帕替尼(Lapatinib)用于治疗HER2阳性的转移性乳腺癌患者,对p-ERK,p-Akt,cyclinD1等基因具有调控作用[22];千金藤素(Cepharanthine)是从千金藤中提取的一种天然生物碱,通过抑制AKT/mTOR信号通路发挥抗肿瘤作用[23-25];粉防己碱(Tetrandrine)也已被报道与多条抗肿瘤信号通路相关,包括Caspase信号通路[26],MAPK信号通路[27],AKT 信号通路[28],ROS[29]等,这为我们进一步探索特异性性杀伤作用和个体化治疗机制奠定了基础。与存在毒性反应和耐药性的SF3B1抑制剂相比[30,31],这些药物在临床上已经安全应用,新的适应症发现后能更快进入临床实验,大大缩短了新药研发的周期。基于目前的研究,我们后期还需通过在动物模型上对阳性药物进行验证,并可以通过转录组学分析对药物选择性的分子机制进行深入探讨。
综上,本研究利用CRISPR-Cas9 系统成功构建SF3B1突变等位基因敲除的单克隆细胞,并对其生长曲线,克隆形成能力及可变剪接调控等表型进行了研究。该研究为筛选对SF3B1突变的葡萄膜黑色素瘤具有选择性抑制作用的药物提供了可利用的细胞模型,并筛选得到有选择性的抗肿瘤药物。以上数据有可能为携带SF3B1突变葡萄膜黑色素瘤患者提供个体化治疗药物。