重症脑梗死合并肺感染患者早期气管切开术的临床疗效
林康越 廖晓荣 叶石生 肖玉梅
广东省茂名市人民医院神经重症监护室,广东茂名 525000
急性重症脑梗死是常见急性神经系统疾病,发病率逐年增高,致残率及死亡率高[1]。重症脑梗死因存在颅内重要动脉闭塞,脑梗死面积较大、并发症多;其中肺部感染是其常见的、最严重的并发症之一[2]。此类患者在早期治疗时需要在重症监护室(intensive care unit,ICU) 监护、 建立人工气道及机械辅助通气等处理,且住院时间、卧床时间及康复时间均较长,预后差[3]。鉴于此,临床上在急性重症脑梗死早期合并肺感染患者的救治措施中,气道管理尤其重要,可是对气管切开最佳时机的选择仍存较大的争议[4]。 本研究旨在回顾分析78 例急性重症脑梗死早期合并肺部感染患者在不同时间点行气管切开术的临床疗效。
1 资料与方法
1.1 一般资料
回顾性分析 2017 年 1 月至 2020 年 7 月茂名市人民医院ICU 收治的78 例急性重症脑梗死早期合并肺部感染患者的临床资料, 根据入院后行气管切开术时间不同的患者分为早期气切组(36例)和晚期气切组(42 例)。 早期气切组中,男 20 例,女 16 例;年龄(74.1±7.2)岁;有吸烟史 12 例;前循环脑梗死23例,后循环脑梗死13 例;入院急诊开颅手术5 例,颅脑介入手术5 例。晚期气切组中,男24 例,女18例;年龄(73.3±14.6)岁;有吸烟史 18 例;前循环脑梗死24 例,后循环脑梗死18 例;入院急诊开颅手术5 例,颅脑介入手术8 例。 两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性(表 1)。 纳入标准:①年龄>18 岁者;②重症脑梗死诊断符合《中国急性缺血性脑卒中诊治指南2018》[5]中相关标准者:经头经颅X 线计算机体层摄影(CT)检查确诊,并根据《中国重症脑血管病管理共识2015》[6]自定义为大脑半球梗死或小脑梗死格拉斯哥昏迷指数 (Glasgow coma scale,GCS)评分≤9 分以及脑干梗死;③起病 48 h 内入院者; ④根据 《社区获得性肺炎诊断和治疗指南(2016 版)》[7]肺炎定义为:有发热,或呕吐,或咳嗽、咳痰,肺听诊有湿性啰音,实验室检查见炎症指标异常,入院急诊胸部CT 诊断为肺炎者;⑤入院48 h 内行气管插管及有创呼吸机辅助通气者。 排除标准:①既往有心、肾、肝、血液等系统严重疾病者;②有肺部基础疾病者; ③入院后并发颅内感染或需二次颅脑手术者;④严重休克者;⑤气管切开术前已呈脑死亡等频临死亡状态者。 本研究经医院医学伦理委员会审核批准。

表1 两组患者一般临床资料比较
1.2 方法
两组患者皆使用经皮扩张气管切开术,早期气切组于起病≤6 d 行气管切开, 晚期气切组于起病≥7 d行气管切开术。所有纳入的患者均有定期监测血气分析、血常规、降钙素、血生化以及痰液细菌培养及药敏、颅脑及胸部CT 检查等,根据病情合理使用抗生素治疗,并给予有创呼吸机辅助通气、祛痰、缺血性脑卒中二级预防、营养支持、保护胃黏膜等综合治疗;在护理上均给予常规抬高床头、 机械排痰及翻身拍背、早期鼻饲泵注入肠内营养支持等处理。
1.3 观察指标及评价标准
分别记录并分析两组患者的机械通气时长、住ICU 时长、总住院时长、联合抗生素使用率、抗生素使用时长、气管切开术总并发症发生率、严重并发症发生率、ICU 病死率及住院总病死率。
联合抗生素使用是指同时使用两联及以上抗生素治疗。 气管切开术总并发症包括气切伤口术中或术后出血量≥10 ml、气切伤口感染、皮下气肿、脱管、气管食管瘘等。 严重并发症包括中或重度的急性呼吸窘迫综合征(acute respiratry distress syndrme,ARDS)、感染性休克、消化道出血、急性肾损伤、心功能不全等。 中或重度ARDS 是指新发呼吸道症状及原有的症状加重基础上,胸部CT 排除肺不张加 重 等 ,PEEP ≥5 mmHg 且 PaO2/FiO2≤200 mmHg(1 mmHg=0.133 kPa),临床上排除心源性肺水肿[8]。消化道出血包括上或下消化道出血,指胃液见咖啡样物且潜血试验阳性,或呕吐鲜血,或排血便,或排黑褐色大便伴随血色素明显下降。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析, 计量资料用均数±标准差()表示,组间比较用 t 检验;计数资料以率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者机械通气时长、住ICU 时长、总住院时长、联合抗生素使用率及抗生素使用时长的比较
早期气切组机械通气时长、住ICU 时长、总住院时长、抗生素使用时长及联合抗生素使用率均低于晚期气切组,差异有统计学意义(P<0.05)(表 2)。
表2 两组患者机械通气时长、住ICU 时长、总住院时长、联合抗生素使用率及抗生素使用时长的比较(d,)
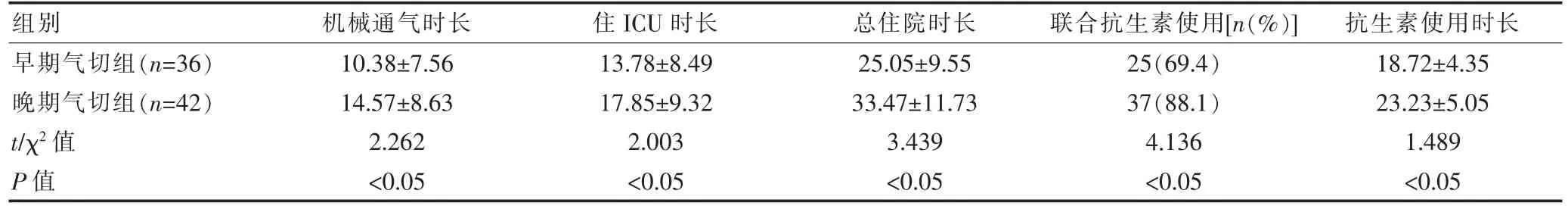
表2 两组患者机械通气时长、住ICU 时长、总住院时长、联合抗生素使用率及抗生素使用时长的比较(d,)
组别 机械通气时长 住ICU 时长 总住院时长 联合抗生素使用[n(%)]抗生素使用时长早期气切组(n=36)晚期气切组(n=42)t/χ2 值P 值10.38±7.56 14.57±8.63 2.262<0.05 13.78±8.49 17.85±9.32 2.003<0.05 25.05±9.55 33.47±11.73 3.439<0.05 25(69.4)37(88.1)4.136<0.05 18.72±4.35 23.23±5.05 1.489<0.05
2.2 两组患者并发症、ICU 病死率、 住院总病死率的比较
两组患者气管切开术总并发症发生率、ICU 病死率及住院总病死率比较,差异均无统计学意义(P>0.05);早期气切组严重并发症总发生率低于晚期气切组,差异有统计学意义(P<0.05)(表 3)。
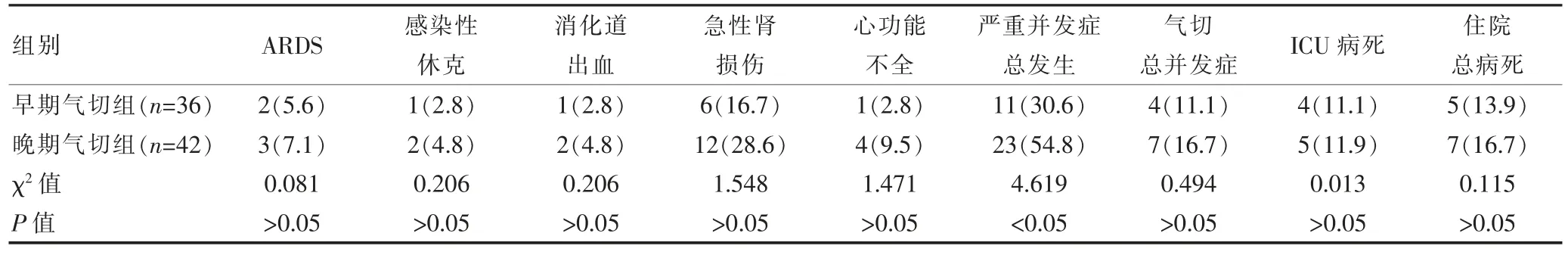
表3 两组患者并发症、ICU 病死率、住院总病死率的比较[n(%)]
3 讨论
急性重症脑梗死患者早期合并肺感染的原因主要是误吸[9]。 其发生误吸的病理及重要因素有[10]:①重症脑梗死患者存在脑干-网状结构上行投射功能、吞咽的皮质延髓束功能或脊脑桥、间脑呼吸中枢功能等不同程度的受损,出现意识障碍、吞咽功能障碍、咳嗽反射功能减弱、呼吸驱动力降低;②起病后呼吸道及口腔的分泌物增多并积聚;③部分患者因存在颅内高压出现反射性呕吐;④部分患者被家属经口灌药或食物等不恰当的处理等。 误吸一旦发生,呕吐物容易导致气道梗阻,并携带上呼吸道及胃肠道的细菌、胃酸等化学物质进入肺部, 导致肺部出现化学性损伤、细菌感染[11];肺部感染加重重症脑梗死患者的病情,增加其的死亡率[12]。 可见,开放人工气道及呼吸机辅助通气成为急性重症梗死合并肺感染患者早期救治的重要手段。 但是,长时间留置经口或经鼻气管插管对患者咽喉及气道产生较大刺激、 致喉咙容易水肿;气管插管较长的管腔增加了吸痰的难度,易使套管内壁痰痂形成并增加堵管引发窒息的风险;护理上反复吸痰操作易引起气道表面粘膜损伤致出血、增加细菌繁殖速度等[13]。董亮艳等[14]提出,患者若具有短期内不可恢复的意识障碍、需长期留置人工气道或需要长期机械辅助通气时,应适当考虑给予早期行气管切开术治疗。以往研究的结果显示[15],早期(起病3~5 d)行气管切开可减少重症脑血管病患者因长期气管插管所致气道的刺激及损伤、 提高气道的耐受性及舒适度、降低痰液堵管及脱管的风险、利于气道护理以减少细菌在肺部的定植等;同时,早期行气管切开能减少依靠机械通气的患者气道的无效腔、 降低气道的阻力、改善肺泡的氧合, 从而利于降低呼吸机通气的支持条件、提高早期撤离呼吸机的成功率,促进后期的康复治疗。 本研究结果显示,对急性重症脑梗死早期合并肺感染患者,早期气切组的机械通气时长、住ICU 时长、总住院时长、抗生素使用时长、联合抗生素使用率及严重并发症总发生率均低于晚期气切组,差异有统计学意义(P<0.05),与杨中华等[16]研究结果相近。急性重症梗死患者意识严重障碍、 气道自我保护能力较差、咳嗽反射的功能亦较弱,且在早期合并肺感染后病情较难被控制,短时间内气管插管难被拔除、呼吸机更难被撤离;若长时间依靠机械通气,此类患者容易出现呼吸肌肉失用性萎缩、增加对呼吸机的依赖以及提高呼吸机相关肺炎的发生率, 病情易反复并加重,康复治疗受到严重威胁,预后差[17]。 所以与晚期气切比较,早期行气管切开能尽早充分引流痰液、降低气道护理的难度、及时控制肺部的炎症、减少并发症的发生,随之降低撤离呼吸机难度、缩短住ICU 时长及总住院时长。两组患者的气管切开术总并发症发生率、ICU 病死率及住院总病死率比较, 差异无统计学意义(P>0.05),与刘慧权等[18]研究结果相近。早期气管切开在死亡率上无显著性差异, 可能与如下因素有关:①原发疾病病情危重,本研究纳入的对象为年龄大、 昏迷程度深、APACHEⅡ评分高的急性重型脑梗死者; ②早期气管切开能够及时解除气道相关问题,却不能阻止原发疾病的发展;③晚期气切组已度过重症脑梗死后7 d 内恶性脑水肿所致死亡的风险[19],但难度过严重并发症所致死亡的风险。两组严重并发症总发生率比较,差异无统计学意义(P>0.05),考虑可能与研究的样本量较少相关。 而本研究为回顾性分析,在病例的选择上可能存在偏移,临床结果存在一定偏差,对其预后情况未纳入研究,有待更大的样本进一步研究。
综上所述,对于急性重症脑梗死早期合并肺感染的患者,早期行气管切开尽管不能降低ICU 病死率及总住院病死率, 但是有利于及时控制肺部的感染、减少抗生素的使用、缩短机械通气时长、降低严重并发症的发生率, 从而缩短ICU 住院时长及总住院时长,特别在经济水平欠发达地区,能使患者及早出院并促进其在社区的康复锻炼,从而降低家庭、社会的经济负担,促进和谐,在临床上值得推广。

