LncRNA NEAT1通过靶向Hsa-miR-206调控乳腺癌细胞增殖、侵袭和迁移的实验研究*
魏 涛,冯连杰,付小娜,赵世杰,刘伟鹏,梁 豪
(安阳市肿瘤医院放疗三科,河南 安阳 455000)
乳腺癌是全球女性发病率和死亡率较高的恶性肿瘤之一,随着肿瘤手术、放化疗、分子治疗等进展,乳腺癌总体预后仍不太理想[1]。目前乳腺癌的复杂分子机制尚未完全清楚,而癌细胞增殖、侵袭、转移是影响其预后的重要因素[2-3]。因此,探索乳腺癌增殖、侵袭和转移的分子机制对乳腺癌治疗十分重要。长链非编码RNA(long non-coding RNA,lncRNA)NEAT1是一种新型癌症相关lncRNA,研究表明[4-6],NEAT1在乳腺癌、卵巢癌、结直肠癌等多种恶性肿瘤中高表达,参与肿瘤增殖、侵袭、转移、凋亡等进展过程。miR-206是一种肿瘤抑制microRNA(miRNA),研究表明[7-9],miR-206具有抑制乳腺癌细胞增殖、侵袭和转移的作用。然而,目前NEAT1和miR-206在乳腺癌中的关系尚未见报道。我们通过生物信息学软件分析预测NEAT1可能靶向miR-206,推测NEAT1对乳腺癌细胞的调控作用可能与靶向调节miR-206表达有关。因此,本研究以乳腺癌MCF-7细胞为研究对象,探讨NEAT1靶向miR-206影响乳腺癌细胞增殖、侵袭和转移。
1 材料与方法
1.1 材料与试剂
乳腺癌细胞系MCF-7和人乳腺上皮细胞系HBL-100由中科院上海细胞库提供。
胎牛血清、DMEM培养基和胰酶购自Gibco公司;Trizol试剂和Lipofectamine TM 2000转染试剂购自Invitrogen公司;康宁Transwell小室购自北京萌壮科技有限公司(滤膜直径6.5mm,滤膜孔径8.0μm);Matrigel基质胶购自BD公司;MTT溶液、结晶紫溶液和RIPA裂解液购自北京索莱宝生物科技有限公司;鼠抗人MMP-2抗体、鼠抗人MMP-9抗体、β-actin抗体、辣根过氧化酶标记的羊抗鼠IgG二抗购自上海艾博抗贸易有限公司;双荧光素酶报告基因检测试剂盒购自北京百奥莱博科技有限公司;实验用所有载体均在上海基尔顿生物科技有限公司构建。
1.2 方法
1.2.1 细胞培养
将MCF-7细胞和HBL-100细胞接种于含10%胎牛血清的DMEM培养基中,置于37℃,5%CO2的培养箱中培养,待细胞融合至90%左右,用0.25%胰酶消化,进行传代。
1.2.2 细胞转染及分组
收集对数生长期的MCF-7细胞,重悬细胞并调整细胞密度为1×106个/mL,接种于96孔板,置于37℃,5%CO2的培养箱中培养,待细胞融合至40%~50%,随机将细胞分组,使用Lipofectamine TM 2000转染试剂将si-con、si-NEAT1、pcDNA、pcDNA-NEAT1、miR-con、miR-206-inhibit转染至细胞,并分别记为si-con组、si-NEAT1组、pcDNA组、pcDNA-NEAT1组、si-NEAT1+miR-con(共转染si-NEAT1和miR-con)、si-NEAT1+miR-206(共转染si-NEAT1和miR-206-inhibit),每组设置3个重复孔,转染24h后观察转染效率。
1.2.3 RT-qPCR检测细胞中NEAT1和miR-206表达
收集细胞,按照Trizol试剂说明书提取总RNA,紫外分光光度计检测RNA的A260/A280值并进行定量,逆转录合成cDNA后进行qPCR检测NEAT1和miR-206表达水平。NEAT1上游引物序列:5’-TGGCTAGCTCAGGGCTTCAG-3’,下游引物序列:5’-TCTCCTTGCCAAGCTTCCTTC-3’。miR-206上游引物序列:5’-CAGATCCGATTGGAATGTAAGG-3’,下游引物序列:5’-TATGCTTGTTCTCGTCTC TGTGTC-3’。GAPDH和U6为内参基因,GAPDH上游引物序列:5’-AAGGCTGTGGG CAAGGTCATC-3’,下游引物序列:5’-GCGTCAAAGGTGGAGGAGTGG-3’。U6上游引物序列:5’-CTCGCTTCGGCAGCACA-3’,下游引物序列:5’-AACGCTTCACGAAT TTGCGT-3’。qPCR程序:95℃,30s;94℃,5s,60℃/58℃,20s,72℃,20s,共40个循环。
根据2017年1~6月的问卷调查结果显示,献血者在献血前、献血中、献血后对于采血护理的满意程度分别为99.00%、99.28%以及97.84%。而根据2016年7~12月的问卷调查结果,献血者在献血前、献血中、献血后对于采血护理的满意程度分别为98.79%、99.24%以及98.46%。我站在实施采血护理风险评估和控制后,献血者对于采血护理的整体满意有了显著的提升,见于表1
1.2.4 MTT法检测乳腺癌细胞增殖
转染24h后,更换细胞培养液,调整细胞密度为1×105个/mL,接种于96孔板,分别于培养24、48、72h时,加入MTT溶液(5mg/mL)20μL/孔,37℃下孵育4h后,弃培养液,加入二甲亚砜150μL/孔,低速震荡反应10min。酶标仪检测每孔490nm波长处吸光度(A)值,观察细胞增殖情况。
1.2.5 Transwell实验检测乳腺癌细胞迁移
细胞转染24h后,更换细胞培养液,继续培养48h,胰酶消化收集细胞,重悬并调整细胞密度为2×108个/mL。取100μL细胞悬液加入Transwell小室的上室,另在Transwell小室的下室加入600μL含10%血清的DMEM培养基,37℃,5%CO2培养箱中孵育24h。吸除上室上层液体,加入适量甲醇室温固定30min,吸除甲醇,加入0.1%结晶紫染色液染色20min,PBS溶液冲洗3次,用无菌棉棒轻轻擦除上室表面细胞,倒置显微镜下观察并随机选取5个视野,统计细胞迁移数目。
1.2.6 Transwell实验检测乳腺癌细胞侵袭
将60μL Matrigel基质胶加入300μL无血清DMEM培养基中混匀,取100μL混合液平铺于Transwell小室的下室,另取100μL Matrigel基质胶平铺于上室。取50μL细胞悬液接种于Transwell小室的上室,37℃,5%CO2培养箱中孵育24h。倒掉上室培养液,加入适量5%戊二醛,4℃下固定15min,PBS溶液冲洗3次。用无菌棉签轻轻擦除上室表面细胞,然后加入0.1%结晶紫溶液室温染色10min,PBS溶液冲洗3次,显微镜下观察并随机选择5个视野拍照,计算侵袭细胞数目。
1.2.7 Western blot检测乳腺癌细胞中MMP-2和MMP-9表达
1.2.8 双荧光素酶报告基因实验
生物信息学软件TargetScan(http://www.targetscan.org/vert_72/.)预测NEAT1靶向miR-206。本实验为验证NEAT1是否靶向miR-206,将NEAT1的3’ΜTR区和突变的3’ΜTR区构建双荧光素酶报告载体,与miR-206共转染乳腺癌细胞,转染24h后,双荧光素酶报告基因检测试剂盒检测荧光素酶活性。
1.3 统计学方法
应用统计学软件SPSS 19.0分析数据,计量资料用(均数±标准差)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 乳腺癌细胞中NEAT1和miR-206的表达
RT-qPCR结果显示,与人乳腺上皮细胞HBL-100比较,乳腺癌细胞MCF-7中NEAT1表达明显上调(P<0.05),miR-206表达明显下调(P<0.05)。见图1。
2.2 NEAT1靶向miR-206
双荧光素酶报告基因实验结果显示,过表达miR-206的乳腺癌细胞中NEAT1的活性明显受到抑制,而将NEAT1的3’ΜTR突变后,miR-206的抑制作用消失,证实NEAT1靶向miR-206(见图2A、B);RT-qPCR结果表明,与si-con组比较,si-NEAT1组细胞中miR-206表达明显上调(P<0.05);与pcDNA组比较,pcDNA-NEAT1组细胞中miR-206表达明显下调(P<0.05)。说明敲减NEAT1可促进乳腺癌细胞中miR-206表达,而过表达NEAT1则抑制乳腺癌细胞中miR-206表达(见图2C)。
2.3 敲减NEAT1和抑制miR-206表达对乳腺癌细胞增殖的影响
MTT实验结果表明,细胞培养72h时,与si-con组比较,si-NEAT1组乳腺癌细胞增殖能力受到明显抑制(P<0.05);与si-NEAT1+miR-con组比较,si-NEAT1+miR-206组乳腺癌细胞增殖能力明显增强(P<0.05)。说明敲减NEAT1可明显抑制乳腺癌细胞增殖,而敲减NEAT1的同时抑制miR-206表达,则可逆转敲减NEAT1对细胞增殖的抑制作用。见图3。
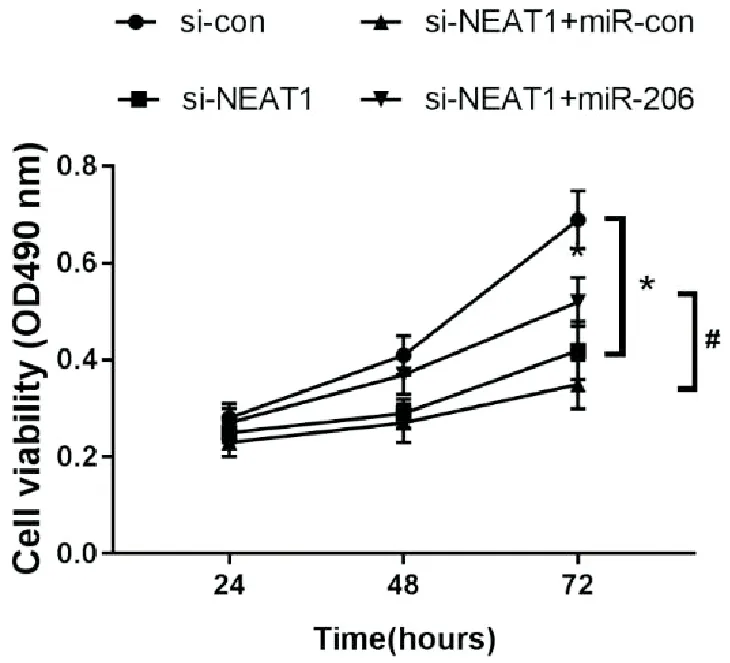
(*P<0.05;#P<0.05)
2.4 敲减NEAT1和抑制miR-206表达对乳腺癌细胞迁移和侵袭的影响
与si-con组比较,si-NEAT1组乳腺癌细胞迁移数目和侵袭数目明显减少(P<0.05);与si-NEAT1+miR-con组比较,si-NEAT1+miR-206组乳腺癌细胞迁移数目和侵袭数目明显增多(P<0.05)。说明敲减NEAT1可明显抑制乳腺癌细胞迁移和侵袭,而敲减NEAT1的同时抑制miR-206表达,则可逆转敲减NEAT1对细胞迁移和侵袭的抑制作用。见图4(封三)。
2.5 敲减NEAT1和抑制miR-206表达对乳腺癌细胞转移蛋白的影响
与si-con组比较,si-NEAT1组乳腺癌细胞中MMP-2和MMP-9蛋白表达明显减少(P<0.05);与si-NEAT1+miR-con组比较,si-NEAT1+miR-206组乳腺癌细胞中MMP-2和MMP-9蛋白表达明显增多(P<0.05)。见图5。
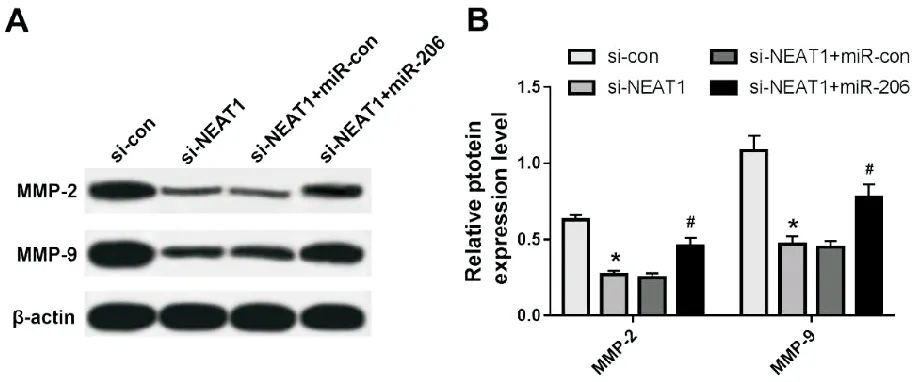
A.Western blot检测细胞中MMP-2和MMP-9蛋白表达;B.各组细胞中MMP-2和MMP-9蛋白表达水平比较(与si-con组比较,*P<0.05;与si-NEAT1+miR-con组比较,#P<0.05)
3 讨 论
长链非编码RNA(long non-coding RNA,lncRNA)是人类转录组的重要组成部分,其自身并不编码蛋白的RNA,而是以RNA的形式在转录调控、转录后调控等层面上调控基因表达[10]。近年来,lncRNAs被报道在多种癌症中异常表达,涉及癌症发生发展中的多种生物学过程,已成为肿瘤潜在的生物标志物和治疗靶点[11]。如Lu等[12]报道,lncRNA CAMTA1通过靶向miR-20b促进人乳腺癌细胞MDA-MB-231增殖和迁移。Sun等[13]报道,lncRNA MEG3在乳腺癌中下调,并通过P53蛋白活性调节乳腺癌细胞增殖、迁移和侵袭能力,提示lncRNA在乳腺癌进展中发挥重要作用。
NEAT1由多发性内分泌瘤Ⅰ型位点转录而来,位于人类第11号染色体上,是近年来发现的与肿瘤细胞增殖、凋亡、侵袭、转移及预后密切相关的一种lncRNA[14-15]。MMP家族是一类依赖于Ca2+、Zn2+等金属离子的蛋白水解酶,主要作用是降解各种细胞外基质成分,其成员MMP-2和MMP-9被认为与乳腺癌迁移和侵袭密切相关[16]。本研究结果,NEAT1在乳腺癌细胞中表达上调,敲减NEAT1可抑制细胞增殖、迁移和侵袭能力,并抑制细胞中MMP-2和MMP-9蛋白表达,说明NEAT1高表达与乳腺癌进展密切相关。Zhang等[17]报道,NEAT1通过促进乳腺癌细胞增殖和上皮间充质转化参与乳腺癌进展过程;Li等[18]报道,NEAT1通过调控miR-211和HMGA2表达促进乳腺癌细胞生长和侵袭。提示NEAT1在调控乳腺癌进展中的具有多种潜在作用途径。
miR-206是最早发现的在乳腺癌中发挥抗癌作用的miRNA[19-20]。Lehmann等[21]报道,miR-206与乳腺癌组织学分级、淋巴结转移状态、肿瘤大小密切相关,是乳腺癌诊断和预后评估的潜在分子标志物。Liang等[22]报道,miR-206在三阴性乳腺癌组织中表达下调,与血管内皮生长因子(VEGF)及侵袭相关蛋白表达水平呈负相关,提示miR-206表达水平与三阴性乳腺癌侵袭和血管生成有关。研究报道[23-25],过表达miR-206可抑制乳腺癌细胞增殖、转移,并促进细胞凋亡。本研究结果,与人乳腺上皮细胞相比,乳腺癌细胞中miR-206表达明显下调。通过生物信息学预测和双荧光素酶报告基因实验,证实在乳腺癌细胞中NEAT1靶向负调控miR-206的表达。为进一步验证敲减NEAT1对乳腺癌细胞增殖、侵袭和迁移的抑制作用与调控miR-206表达有关,本研究在乳腺癌细胞中同时敲减NEAT1和抑制miR-206,结果与单独敲减NEAT1相比,乳腺癌细胞增殖、侵袭和迁移的抑制作用消失,说明敲减NEAT1可能通过促进乳腺癌细胞中miR-206表达发挥抑制细胞增殖、迁移和侵袭的作用。
综上所述,NEAT1在乳腺癌细胞中表达上调,敲减NEAT1可抑制乳腺癌细胞增殖、迁移和侵袭,其作用机制可能与上调miR-206表达有关。本研究为乳腺癌靶向治疗提供了新思路和新靶点。

