基于c-Met抗体的近红外荧光探针用于肝癌的活体成像研究
易柳彤 杨美林 宫娜娜 余美红 曹婉维 李展宇 李丹
肝癌是我国最常见的恶性肿瘤之一,尽管肝癌的诊疗水平在不断地提高,但肝癌的新发病例和死亡病例仍居高不下[1-2]。目前肝切除术是肝癌根治的最主要手段[3],然而作为一种高侵袭性肿瘤,肝癌往往呈浸润性生长,其卫星灶及浸润边界往往难以识别,且肝脏毗邻腹腔大血管、胆道、胃等重要器官,常规手术后并发症高达15%~50%,5年复发率达70%[1,3-4]。因此,术中肝癌的检出率和边界精准识别能力的提高,将有利于延长肝癌患者的生存时间,提高患者的生存质量。
基于荧光成像的手术导航有助于肝癌的精准诊疗。近年来,美国食品药品监督管理局(Food and Drug Administration,FDA)批准的吲哚菁绿(indocyanine green,ICG)是一种非靶向近红外荧光探针,其在正常肝细胞和癌变肝细胞间的代谢差异,导致ICG在癌变肝细胞中的异常累积,从而实现肝癌病灶的荧光成像,在肝癌的精准切除中具有重要的临床意义[5-6]。但有研究表明,瘤周正常肝组织对ICG的排泄功能受累,形成的背景信号干扰了肿瘤边界的精确界定[7]。而特异性靶向的探针,主要是聚集于病灶处,能正确显示肿瘤的手术切缘,从而减少正常组织过度切除[8]。目前靶向表皮生长因子受体(epidermal growth factor receptor,EGFR)的探针能够特异靶向聚集于肿瘤组织,并且受背景荧光信号干扰少,可提高肿瘤组织的成像对比度,在头颈鳞癌、胰腺癌和食管癌等肿瘤中有一定的临床应用价值[9-10]。因此,靶向荧光探针更加有利于微小肿瘤及肿瘤边界的术中精准可视化,实现肝癌的完整切除。
肝细胞生长因子受体(cellular mesenchymalepithelial transition factor,c-Met) 是 一 种 酪 氨 酸激酶型受体,与配体肝细胞生长因子(hepatocyte growth factor,HGF)结合后被激活,参与恶性肿瘤的增殖、侵袭和转移[11]。经调研发现,c-Met在胃癌、食管癌和结直肠癌等恶性消化道肿瘤中异常高表达,其中在肝癌中高表达,约65%[12-13],并且与肝癌的增殖和肝内转移相关,已经成为肝癌诊疗的重要靶点[14-15]。基于此,靶向c-Met的近红外荧光探针在肝癌的精准诊疗中将会有重要的应用价值。
本研究采用一种靶向c-Met并已经进入临床Ⅰ期试验抗体偶联药物中的单抗SHRmAb[16]和一种具有散射小、背景荧光信号低和组织穿透能力强等优点的近红外荧光染料IRDye800CW[10],成功合成并表征了靶向c-Met探针SHRmAb-IR800[17-18],通过流式细胞术和共聚焦成像验证了该探针能与肝癌细胞特异性结合,并通过动物模型的体内成像检测了该探针能靶向聚集于c-Met阳性的肿瘤组织,基于此来探索该探针的肝癌检测能力和评估其潜在的应用价值。
资料与方法
一、获取c-Met的表达信息
从TCGA数据库中获取c-Met mRNA(MET)在人肿瘤组织中的表达信息,并比较人肝癌组织和正常肝组织中的MET表达(http://ualcan.path.uab.edu/analysis.html)。然后从HPA数据库中提取人肿瘤组织中c-Met蛋白的表达信息(http://www.proteinatlas.org)。
二、细胞系及细胞培养
人卵巢癌细胞株(A2780)和人肝癌细胞株(SK-Hep1和Hep 3B)来自美国模式培养物研究所,而人肝癌细胞SMMC7721来源于中国上海科学院细胞库。将基础培养基RPIM-1640配制成含10%胎牛血清和1%青霉素-链霉菌素的完全培养基,并用完全培养基RPIM-1640培养A2780、SKHep1、Hep 3B和SMMC7721细胞。所有细胞均置于含5% CO2的37℃培养箱中培养。
三、Western Blot分析
用RIPA裂解液(P0013C,上海碧云天公司)充分裂解细胞后离心获得总蛋白,然后用BCA法测定蛋白的浓度。取30 μg蛋白进行SDS-PAGE凝胶电泳并转至PVDF膜上,再分别用抗c-Met抗体(8198,美国CST公司)和抗内参蛋白GADPH抗体(2118,美国CST公司)于4℃冰箱中孵育过夜,然后用TBST溶液清洗膜3 次后,再加入对应的辣根过氧化酶标记山羊抗兔IgG抗体(7074,美国CST公司)室温孵育1 h,接着用TBST溶液清洗膜3次后,将膜置于ChemiDocXRS +成像仪(美国Bio-Rad 公司)中进行显像。最后重复试验3次后,用Image J 软件进行灰度分析。
四、流式细胞术分析
将肿瘤细胞培养于10 cm培养皿中,待其生长约90%时,用Accutase消化酶(A6964,美国Sigma公司)将细胞消化至离心管中,然后用PBS清洗离心3次,接着用10 μg/mL抗体(SHRmAb/IgG2或SHRmAb-IR800/IgG2-IR800)于冰面孵育细胞30 min,再用PBS清洗,然后加入Alexa Fluor 488山羊抗人IgG 抗体(缩写Alexa 488,1∶200)于室温孵育细胞30 min。最后用PBS清洗和1 000 rpm离心4 min,弃上清,重复3次后,用250 μL PBS重悬细胞并于流式细胞仪下检测。
五、共聚焦荧光成像实验
将3~5 ×104肿瘤细胞接种于共聚焦皿中,培养48 h后用于共聚焦荧光成像。弃培养基后加入PBS清洗,然后再加入10 μg/mL抗体(SHRmAb/IgG2或SHRmAb-IR800/IgG2-IR800)于冰面孵育细胞30 min。接着再加入4%多聚甲醛固定20 min和0.2% Triton通透5 min。最后加入Alexa 488二抗室温孵育30 min,弃二抗,再用PBS清洗3次,加入抗荧光淬灭剂(含DAPI) (S2110-5,北京索莱宝公司)染核5 min后,于共聚焦显微镜(德国Zeiss公司)下成像。
六、肝癌动物模型的构建
本研究的相关动物实验已经通过我院动物伦理委员会的批准(00043)。从广东省动物中心购买4~6周龄的雌性BALB/c-nu裸鼠,用于肝癌皮下瘤模型的构建。主要是用胰岛素注射器将100 μL含3 ×106个SK-hep1细胞的混悬液注入小鼠的右肩,共构建6只皮下瘤小鼠模型,建模一周后,隔天用游标卡尺监测肿瘤的大小,待肿瘤生长到200 mm3则可进行成像实验。
七、探针在动物模型中的近红外荧光成像
用异氟烷气体麻醉裸鼠之后,再给其尾静脉注 射45 μg抗 体 探 针(SHRmAb-IR800或IgG2-IR800),然 后 于 注 射 后 0.5、6、24、72和 96 h用小动物活体光学成像系统(美国PerkinElmer公司)进行探针的成像(激发光:760 nm;发射光:845 nm)。在96 h时将小鼠安乐死,并取出小鼠的主要脏器和肿瘤组织进行成像。通过成像系统的处理软件获取成像的平均荧光强度(mean fluorescence intensity,MFI)和肿瘤背景比(tumorto-background ratio,TBR),其中TBR是肿瘤处的MFI除以同侧大腿处的MFI。
八、统计学分析
采用GraphPad 7.0进行数据统计和分析。所有获得实验结果的连续变量数据用平均值±标准差来表示。采用t检验来比较两组数据的差异。P < 0.05被认为差异具有统计学意义。
结 果
一、数据库中c-Met的表达情况
在TCGA数据库中,发现MET的表达水平在大多数肿瘤中都高于正常组织,其中在肝癌组织中显著高于正常肝组织(P < 0.001) (图1A、1B)。此外,在HPA数据库中发现c-Met在大多数肿瘤组织中都高表达,其中在肝癌中的表达率为80%(图1C)。
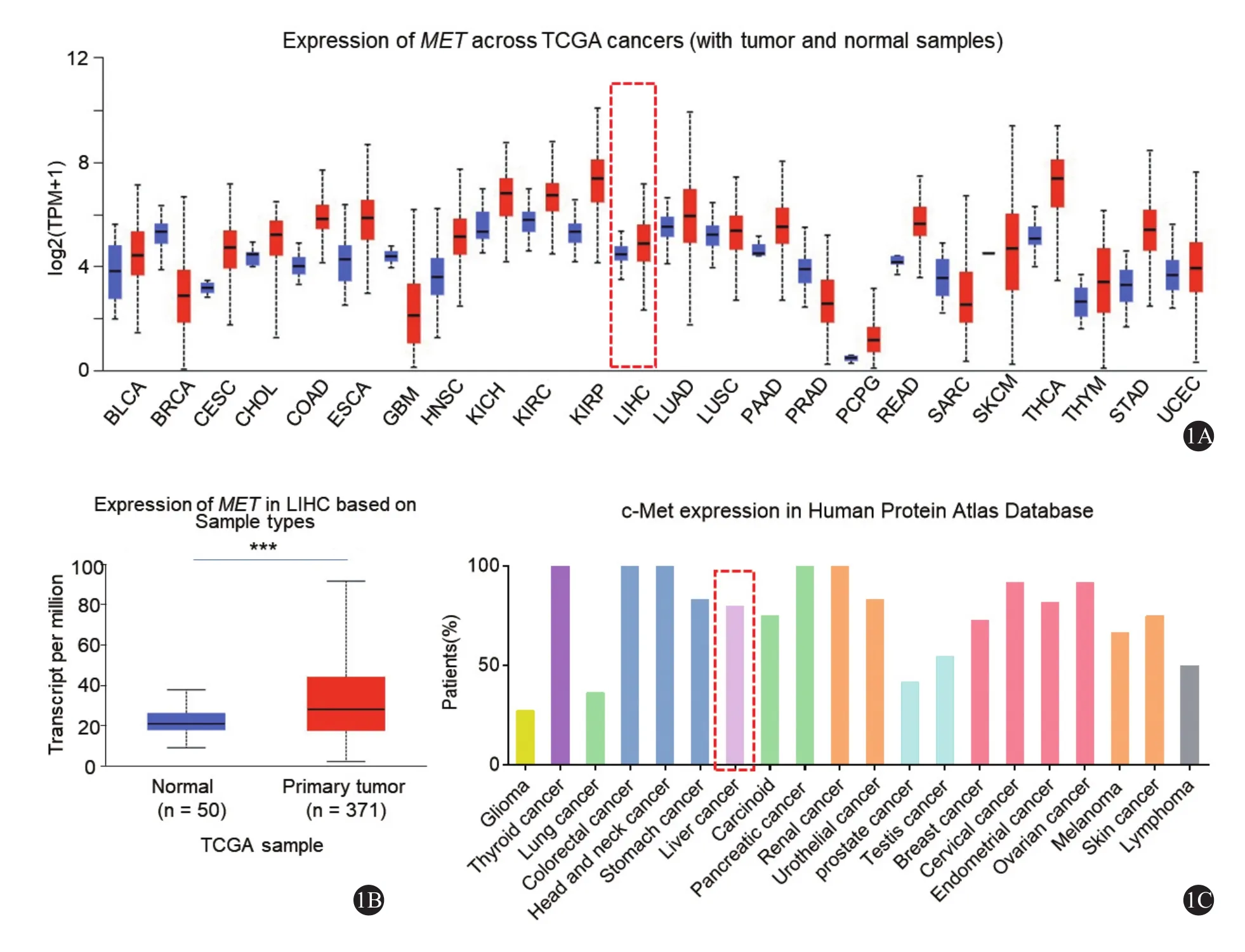
图1 数据库中c-Met的表达分析
二、肝癌细胞系中c-Met的表达分析
通过Western Blot分析人肝癌细胞系的c-Met表达情况(图2A、2B),发现肝癌细胞系SK-Hep1、Hep 3B 和SMMC7721都有不同程度的c-Met表达, 而卵巢癌A2780不表达c-Met。以上细胞系可用于后续探针的特异性结合能力研究。

图2 人肝癌细胞系中c-Met的表达分析
三、SHRmAb-IR800的体外特异结合能力检测
将抗体探针与肿瘤细胞共孵育后,进行流式细胞术分析,可见SHRmAb-IR800与各肿瘤细胞的结合程度与其c-Met的表达水平呈正相关性(图3A)。另外,将抗体探针和抗体分别与SKHep1肝癌细胞共孵育,发现SHRmAb-IR800和SK-Hep1细胞的结合,与抗体SHRmAb相比无显著性差异,但高于对照组(IgG2-IR800和IgG2)(图3B)。以上结果表明,SHRmAb-IR800探针能够特异结合c-Met阳性肝癌细胞。
选择SK-Hep1进行共聚焦成像实验(图3C),在0℃ 孵育30 min后可见SHRmAb-IR800浓聚于肝癌细胞膜上;提高孵育温度至37℃之后,发现探针被肝癌细胞摄取入胞质内,说明SHRmAb-IR800能够与c-Met阳性的肝癌细胞结合并被摄取。
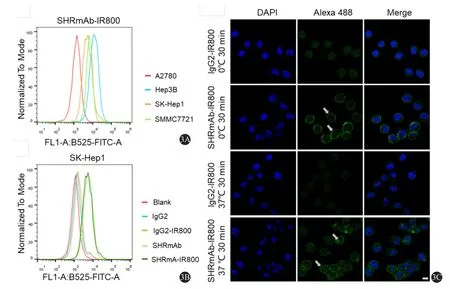
图3 SHRmAb-IR800的体外结合能力分析
四、SHRmAb-IR800在动物模型中的活体成像分析
利用SK-Hep1构建肝癌皮下模型,14 d后可用于活体成像。如图4A、4B可见,随着时间的推移,SHRmAb-IR800成像的MFI逐渐升高,并且于24 、72和96 h可见,SHRmAb-IR800组的MFI均显著高于对照组IgG2-IR800 (P < 0.05)。此外,在96 h时SHRmAb-IR800的TBR为(2.01 ± 0.18),显著高于 IgG2-IR800(1.59 ± 0.10,P < 0.05)。
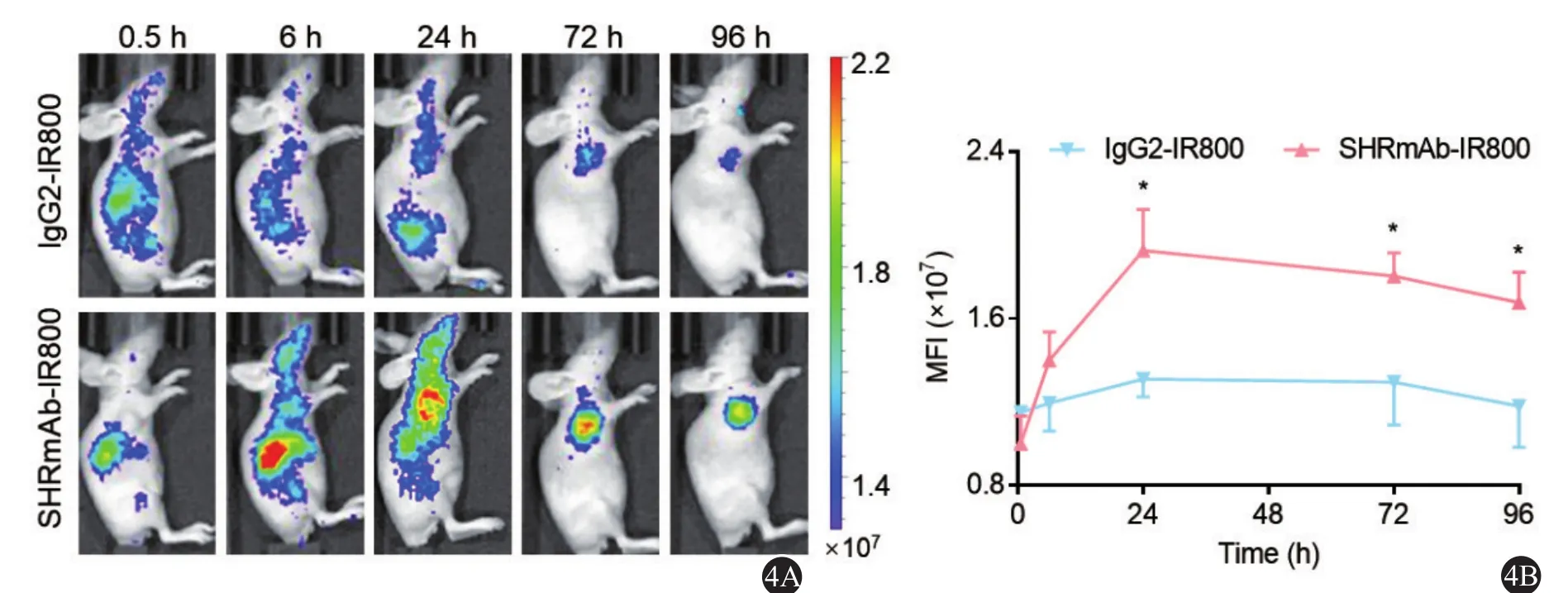
图4 SHRmAb-IR800在SK-Hep1肝癌皮下模型中的活体成像分析
于肝癌皮下瘤模型活体成像的96 h,收集其皮下瘤组织和主要脏器进行近红外荧光成像(图5A),以分析SHRmAb-IR800在小鼠体内的分布情况。通过成像的定量分析(图5B),可见SHRmAb-IR800靶向聚集于肿瘤组织,高于正常皮肤和肌肉组织(P < 0.05),并且也高于对照IgG2-IR800的肿瘤组织(P < 0.05)。另外,将肿瘤组织进行免疫组化染色,显示为c-Met阳性(图6)。
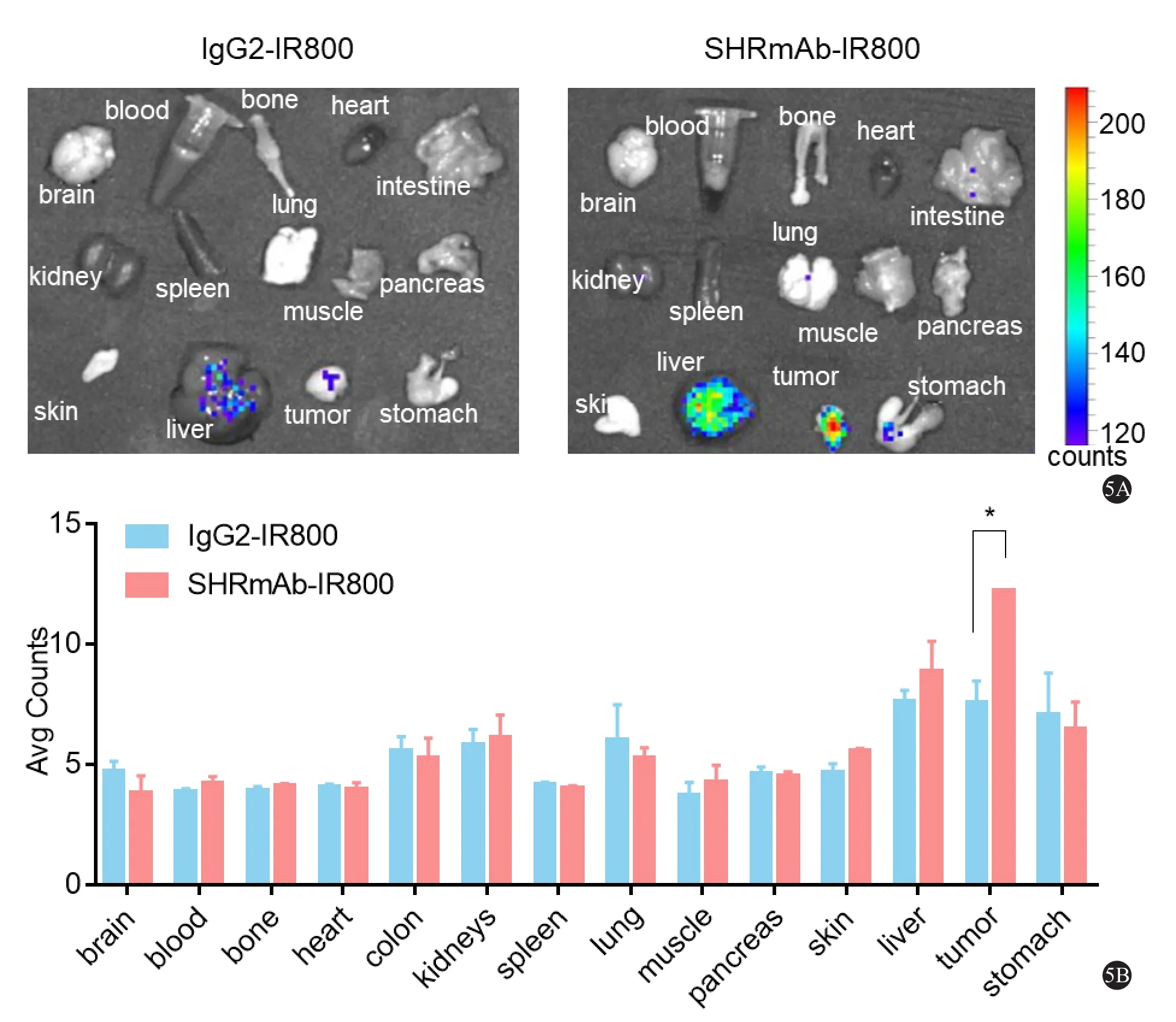
图5 SHRmAb-IR800在SK-Hep1肝癌皮下瘤模型中的离体成像分析
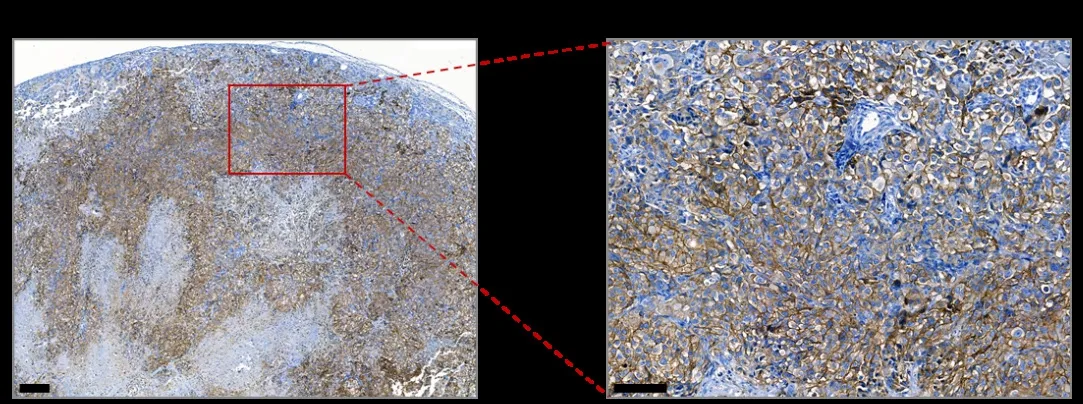
图6 SK-Hep1肝癌皮下瘤的c-Met免疫组化染色分析,比例尺:200 μm & 100 μm
以上实验结果说明,该近红外荧光探针SHRmAb-IR800能够特异性靶向聚集于c-Met阳性的肝癌组织。
讨 论
手术切除是根治肝癌的最主要方式之一,但由于肝癌浸润边界难以在术中界定,且毗邻腹腔重要器官,病灶少切一分导致高术后复发率,而多切一分导致严重术后并发症,因此提高术中肝癌边界的分辨率是提高患者术后生存质量的关键。目前靶向近红外荧光成像为术中肿瘤病灶的精准识别和完整切除带来了重要的契机[19]。如:2011年,靶向叶酸受体的小分子荧光探针(叶酸-FITC)用于人体卵巢癌手术切除的临床研究,其有利于改进术中分期和肿瘤细胞减灭术,从而改善患者的预后[20];2014年,靶向c-Met多肽与荧光染料Cy5偶联的荧光探针GE-137用于人体结肠息肉癌变镜检的临床研究,其可提高患者的结肠癌及其癌前病变的检出率,从而有利于结肠癌的早诊断和早治疗[21]。然而,上述荧光探针的发射波长较短,以致其成像易受自体荧光干扰,且信噪比低、组织穿透力差,并且小分子和多肽探针的体内半衰期短、靶向能力较弱,因此临床应用受限。为了克服以上探针的局限性,本研究利用基于人源化c-Met抗体和近红外荧光染料IRDy800CW合成的荧光探针SHRmAb-IR800,以分析其对于人源肝癌细胞株和肝癌皮下瘤模型的靶向聚集能力,为肝癌精准诊疗探索一种新的辅助手段。
本研究的体内外实验均说明,近红外荧光探针SHRmAb-IR800能特异性识别c-Met阳性的肝癌肿瘤,有助于肝癌的检测,在手术导航方面具有潜在应用价值。首先,SHRmAb-IR800的发射光谱在750~850 nm范围,与染料FITC和Cy5偶联的探针相比(520~670 nm),具有较少的自体背景荧光干扰和更高的信噪比[5,22]。另外,SHRmAb-IR800在96 h的成像TBR(2.01 ± 0.18)显著高于对照探针组,并且大量研究表明,当探针的TBR大于2时,则具有较高的肿瘤对比度,提示该探针有助于肿瘤组织和正常组织的辨别[23]。其次,SHRmAb-IR800是利用靶向c-Met的单克隆抗体构建的,与多肽探针相比,具有较高亲和力(Kd = 1.07 ±0.05)[18],能特异性聚集于c-Met阳性的肝癌细胞和组织,并且SHRmAb-IR800在c-Met阳性肝癌中的浓聚程度显著高于对照探针(P < 0.05),有利于肝癌的精准诊断。最后,SHRmAb-IR800具有良好的生物安全性。本研究所用的抗体是已经进入临床Ⅰ期试验的抗体结合药物中的抗体(SHRmAb),无抗体依赖的细胞毒性作用和补体依赖的细胞毒性作用,对机体组织不产生毒副作用[24-25];而所用荧光染料(IRDye800CW)的体内代谢情况和安全性已被大量研究验证,并且与抗体(西妥昔单抗、帕尼单抗和贝伐单抗等)偶联形成的抗体探针也被用于肿瘤的手术导航临床试验,具有较好的人体安全性[10]。综上所述,本课题构建的近红外荧光探针SHRmAb-IR800在肝癌的手术导航中具有一定的临床转化潜能。
本研究还存在一些改进的地方。首先,于96 h时,离体成像结果显示SHRmAb-IR800在肝脏中有累积,可能会干扰肝癌原发病灶的辨别,从而限制其在肝癌手术导航的应用。为了获得抗体探针的最优成像对比度,可适当延长成像时间至4~7 d[26-29],因此本研究可进一步延长SHRmAb-IR800的成像时间,以获得最佳的信噪比;另外,还可以进一步优化该分子探针,以减少正常肝脏摄取,从而提高原发肝癌的成像对比度。其次,目前近红外二区荧光成像具有更低的光子散射、更高的空间分辨率和更优的信噪比,在生物成像领域得到了广泛的应用[30-31]。有研究表明,IRDye800CW染料的发射光谱也能达到近红外Ⅱ区窗口,因此可利用近红外Ⅱ区的成像仪器进行研究,从而进一步发掘该探针对肝癌手术导航的应用价值。最后,有研究表明c-Met的表达水平与患者的治疗抵抗和预后差正相关[32-33],因此c-Met的靶向分子成像将有利于肝癌的治疗监测和预后评估。
综上,靶向c-Met的近红荧光抗体探针SHRmAb-IR800能够特异识别c-Met阳性肝癌肿瘤,并且在成像96 h具有良好的TBR,这将有利于精准的肝癌可视化手术切除,做到“不多切正常肝组织,不少切肝癌组织”,从而提高患者的生存质量。

