经皮穿通静脉闭合术治疗下肢静脉曲张合并穿通静脉功能不全36例分析
贺嘉男 张永裕 王大帅 赵逆 黄伟乐 郭辉
下肢静脉曲张是最常见的慢性静脉疾病。在我国,下肢静脉曲张患者超过1亿,其成人发病率约15%[1]。其中,部分患者常因早期症状较轻未予重视,而逐渐出现溃疡、出血、血栓性浅静脉炎等症状,严重影响患者的身体健康和生活质量[2-3]。当前,静脉曲张的诊疗多关注于隐股瓣及隐腘瓣的反流;而研究表明,下肢静脉曲张患者若合并有穿通静脉功能不全(incompetent perforator veins,IPVs),则其下肢静脉溃疡发生率高达30%[4];而高达60.3%的静脉溃疡患者合并有IPVs[5]。此外,研究表明IPVs是下肢静脉曲张常规治疗后复发的主要原因之一[6-7]。因而,IPVs的治疗已逐渐为下肢静脉曲张治疗领域所关注。本文回顾性分析了2019年6月至2021年6月在我院行经皮穿通静脉闭合治疗(percutaneous ablation of perforator veins,PAPS)的36例下肢静脉曲张合并IPVs患者的临床资料及其随访观察资料,现总结汇报如下。
资料与方法
一、一般资料
选取2019年6月至2021年6月在中山大学附属第五医院诊断下肢静脉曲张合并IPVs的患者,共计36例(总计47条患肢);所有患者均接受大隐静脉主干腔内消融联合曲张静脉泡沫硬化治疗及经皮穿通静脉闭合治疗;术后1个月、3个月进行随访及疗效评估。入组标准:(1)年龄20~80岁,心、肺、肝、肾等脏器功能良好;(2)慢性静脉疾病的分类及评估方法(clinical-etiology- anatomy-pathology classification system,CEAP)分级为 C2~C6;(3)超声诊断为IPVs,穿通静脉反流持续时间> 0.5 s,或穿通静脉直径> 3.5 mm;(4)征得患者及家属知情同意并签署相关告知书。以上4条必须同时符合方可考虑入组。排除标准:(1)深静脉血栓形成或有易栓症等血栓相关疾病史;(2)急性炎症期;(3)难以纠正的凝血功能障碍;(4)存在右向左分流心脏病变者。存在以上4条中任意1条者均须排除。
二、方法
术前收集记录患者基本资料、CEAP分级评分等信息,完善相关术前检验检查,签署手术知情同意书。术前所有患肢均经手术医师行超声评估,并绘制异常及病变段血管。
(一)术中相关设备及器械
DSA血管造影机(UNIQ Clarity FD20C,飞利浦,荷兰);彩色多普勒超声诊断仪(Arietta 60,日立,日本);射频消融导管(ClosureFast™ CF7-7-60,美敦力,美国);微波消融导管(微波系统ECO-100F-2522,南京亿高微波系统工程有限公司,中国);射频消融针(射频电极针10-131281,迈德医疗科技有限公司,中国);16G穿刺套管针(Angiocath,BD,美国);聚桂醇(10 mg∶100 mL聚桂醇注射液,陕西天宇制药有限公司,中国)等。
(二)手术方案
所有患者均于局麻下行手术治疗。对于大隐静脉主干,使用射频消融导管或微波消融导管,进行腔内消融治疗。对于功能不全的穿通静脉,术中超声再次精确定位后,采用方案A或者B进行消融或者电凝治疗。方案A:使用射频消融针穿刺IPVs后行腔内消融治疗,腔内消融治疗功率为60 W,采用1 cm/10 s间隔依次退针消融;方案B:使用穿刺套管针穿刺IPVs后行腔内电凝治疗,腔内电凝治疗功率为40 W,采用1 cm/3~5 s间隔依次退针电凝。上述射频消融针及穿刺套管针针尖头端距深静脉约1~2 cm以上,治疗期间超声实时监测治疗过程,并于治疗后评估IPVs是否存在血液反流。最后,对残余浅表曲张静脉团进行泡沫硬化治疗[8-10]。
(三)术后处理及治疗
治疗完毕后,患肢沿治疗静脉予以敷料加压包扎(压力为 20~30 mmHg,1 mmHg = 0.133 kPa),并鼓励患者尽早下床活动,同时予抗凝、预防静脉炎等治疗;次日拆除敷料后,嘱患者穿戴适合型号的静脉曲张袜(压力为23~32 mmHg)压迫治疗1个月。
三、术后随访
术后观察患者临床症状的改善情况,并于术后第1个月、第3个月进行临床随访。随访期间,观察患者是否出现疼痛、静脉炎、硬结及感觉异常等手术相关并发症;如出现下肢静脉曲张复发,则经超声等检查证实后行进一步治疗。
四、观察指标
本研究的主要观察指标为技术成功率和临床症状改善情况,次要观察指标为术后并发症率、术后复发率等。技术成功定义为手术操作顺利完成,术后即刻复查彩超评估病变段血管管腔闭合。临床症状改善情况为随访期间静脉临床严重程度评分(venous clinical severity score,VCSS)及生活质量评分(chronic venous insufficiency questionnaire,CIVIQ)的改善情况。术后并发症主要包括深静脉血栓形成、症状性肺动脉栓塞、感染等严重并发症及疼痛、静脉炎、硬结及感觉异常等轻度并发症。术后复发定义为随访期间再次出现静脉曲张的相关症状,并经超声证实的病变血管再通及其他IPVs等。
五、统计学方法
所有随访资料均采用SPSS 26.0统计软件进行分析。其中正态分布计量资料以均数±标准差表示,组间两两比较采用独立样本t检验,术前术后评分资料比对采用配对样本t检验,以P < 0.05表示差异有统计学意义。
结 果
一、基线特征
本研究纳入36例患者(共计47条患肢),其中男性18例,女性18例;年龄为34~73岁,平均(53.83 ± 10.45)岁;病程 1~40 年,平均(13.75 ±10.96)年。按CEAP临床分级:C2级3例,C3级4例,C4级14例,C5级12例,C6级3例。所有患者均经超声诊断为下肢静脉曲张合并IPVs;其中,合并单Cockett组IPVs患肢43条,合并Cockett伴Dodd组IPVs患肢2条;合并单Dodd组IPVs患肢1条;合并单Boyd组IPVs患肢1条。详见表1。

表1 患者基线资料
二、技术成功率及临床症状改善情况
36例患者均于局麻下成功实施经皮穿通静脉闭合治疗,其中消融治疗23例,电凝治疗13例。术后即刻采用超声评估治疗血管闭合情况,发现所有患者其IPVs均未见血流信号,管腔均已闭合,技术成功率为100%。
所有患者均在术后1个月及3个月进行随访,其VCSS较术前均有所下降,且差异具有统计学意义(P< 0.01);术后1个月及3个月CIVIQ均较术前有所提升,其差异具有统计学意义(P< 0.01)(见表2)。此外,对比接受腔内消融与腔内电凝治疗IPVs的患者,两组间VCSS及CIVIQ在术前、术后1个月、术后3个月均无统计学差异(见表3)。结果显示,接受经皮穿通静脉闭合治疗的患者其临床症状较前有所改善;而采用腔内消融或腔内电凝,对于患者临床症状改善而言并无显著差异(见图 1)。

图1 患者女性,46岁,因下肢静脉曲张入院
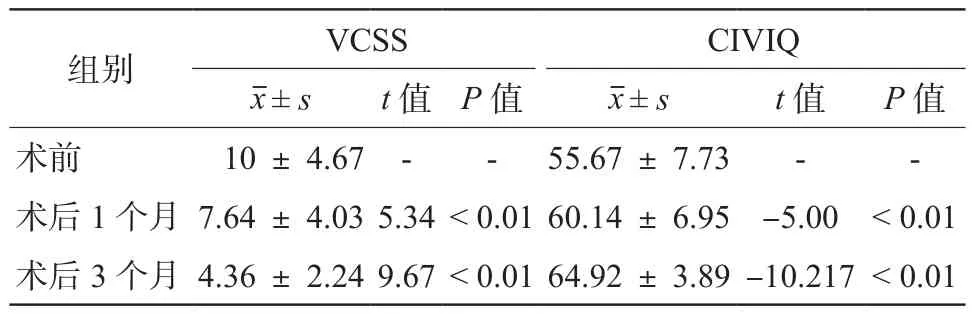
表2 患者术前、术后VCSS及CIVIQ比较

表3 腔内消融及腔内电凝治疗方式间术前术后VCSS及CIVIQ比较
三、术后并发症及复发情况
术后随访期间,有2例患者出现静脉炎;4例出现硬结;3例术后出现疼痛;2例于术后出现感觉异常,但术后1个月随访时症状消失;未见有其他神经损伤的相关并发症出现;无深静脉血栓、症状性肺栓塞、感染、死亡等严重并发症出现。随访期间,均未见明显静脉曲张复发。
讨 论
目前以激光、射频及微波为代表的腔内消融联合曲张静脉硬化治疗已逐渐成为下肢静脉曲张的主流治疗方式,然而其仍存在复发的情况[11-13]。Lawetz等[14]报道,接受射频消融、激光消融的下肢静脉曲张患者,5年复发率可达18.7%及38.6%。究其原因可能是由于术前往往更多关注隐股瓣、隐腘瓣的治疗,而相对忽略了IPVs等其他导致静脉曲张疾病的病因所致。而据García-Gimeno等[15]研究统计2 036例下肢静脉曲张患者的术前彩超检查结果,发现隐股瓣及隐腘瓣返流约占76.2%,而穿通静脉瓣膜返流约占11.7%。Chastanet等研究1 882条患肢的不同返流模式,其中33%的患者存在下肢静脉曲张但不伴有隐股瓣或隐腘瓣功能不全,这表明下肢静脉曲张并不完全归因于隐股瓣及隐腘瓣的反流,IPVs亦可能是导致下肢静脉曲张的重要原因之一[16]。
本研究纳入了术前彩超评估合并有IPVs的下肢静脉曲张患者进行疗效分析,结果显示,多数患者其CEAP分级较高,提示IPVs可能与患者的症状严重程度有关。这与Stuart等[17]的研究一致:C2/3级的下肢静脉曲张患者合并IPVs发生率为52%,C4级患者则可升至83%,而C5/6级的患者则可高达90%。因此,对于CEAP分级较高的患者,术前需进行详细的超声评估,尤其注意是否合并IPVs。此外,本研究纳入的IPVs患者多合并Cockett组穿通静脉的病变,考虑其可能因为Cockett组穿通静脉多位于小腿肌肉泵的下方,受到的压力较大,易出现瓣膜功能不全,进而导致静脉性溃疡及小腿肿胀等严重症状[18-19]。
目前认为,IPVs形成的主要原因一方面在于深静脉瓣膜功能不全而导致穿通静脉逐渐出现返流,另一方面是由于浅静脉反流加重了穿通静脉的负荷,从而加速其功能不全的发生[20]。2007年,Bergan等[21]首次提出下肢静脉曲张的上升理论,即站立位时静脉血管内的血液重力会影响下肢静脉系统,而由于静脉壁薄弱,会导致静脉扩张并形成曲张静脉池;故曲张静脉池在肢体远端最早出现,然后沿着大隐静脉主干向近心端传播。因此,如何治疗IVPs已经被人们越来越重视。
IPVs传统的治疗方式多为腔镜深筋膜下穿通静脉离断术,但存在创伤较大、切口愈合不良等问题[23]。近年来,采用腔内消融及泡沫硬化剂等方式治疗IPVs逐渐受到重视[24-25]。但是研究表明,泡沫硬化剂治疗IPVs与腔内消融相比,存在更高复发率,且更容易导致下肢深静脉血栓形成[26]。故越来越多的人开始关注腔内消融治疗IVPs,Wang等[27]采用腔内射频消融治疗IPVs的下肢静脉曲张患者,结果显示其术后1年随访的VCSS(2.70 ±1.39)较术前(5.77 ± 1.88)有所下降。而王海涛等[28]采用电凝法治疗下肢病理性穿通静脉,其结果表明术后3个月的VCSS(4.6 ± 1.4)较术前(19.6 ± 3.54)有所下降。本研究中,我们主要采用经皮穿通静脉闭合治疗合并IPVs的下肢静脉曲张患者,其术后3个月随访的VCSS(4.36 ± 2.24)及 CIVIQ(64.92 ± 3.89)均较术前(VCSS:10 ±4.67;CIVIQ:55.67 ± 7.73)有显著改善,此结果与前述研究相似;表明经皮穿通静脉闭合术对于合并IPVs的下肢静脉曲张患者具有良好的效果。此外,本研究通过比对腔内消融及腔内电凝两种方式的术后评分,暂未发现该两种治疗方式对于患者预后有显著差别,然而受限于随访时间等相关因素,其远期疗效仍有待评估。
综上所述,对于合并有IPVs的下肢静脉曲张患者,腔内消融和电凝治疗均可达到管腔闭合、术后症状改善的目的,取得良好的临床效果;但由于样本量偏小,且为回顾性研究,需要更大样本的随机对照研究来证实上述结论。

