无功能垂体腺瘤的垂体相关转录因子表达与临床特征分析
唐晓爽 张晓青 尹华春 郑 新 李 松 杨 辉
垂体腺瘤为颅内常见的肿瘤之一,年发病率在(3.9~7.4)/10 万,仅次于胶质瘤和脑膜瘤,其中无功能腺瘤约占30%[1]。2004 年,WHO 第三版垂体肿瘤分型指南主要依据激素类型进行分类[2]。这种分类方法存在诸多不足,例如激素改变不明显的病人,没有具体的分类。2017年,WHO发布了新的垂体肿瘤分型指南[3,4],其中垂体相关转录因子的表达情况被作为新的分型指标。垂体相关转录因子对垂体细胞的分化十分重要,例如垂体特异性POU 类同源结构域转录因子1(pituitary specific POU-class homoe domain transcription factor-1,Pit-1)主要表达于生长激素(growth hormone,GH)细胞腺瘤和泌乳素(prolactin,PRL)细胞腺瘤,调控GH、PRL 和促甲状腺激素(thyroid stimulating hormone,TSH)细胞分化,PRL 细胞分化还需要雌激素受体α(estrogen receptor alpha,ERα)调控,TSH 细胞分化则受到GATA2 调控,促性腺激素(gonadotropic hormone,GnH)细胞的分化则受SF-1和GATA2的调控[5]。临床上,很多无功能垂体腺瘤病人通常没有血清激素的异常、缺乏典型的症状,从而导致延误诊断和治疗,所以根据垂体相关转录因子进行分型、分析,对无功能垂体腺瘤的诊治可提供新依据、新方法[6]。本文探讨无功能垂体腺瘤的垂体相关垂体相关转录因子表达情况与临床特征的关系,为临床无功能垂体腺瘤的诊治提供参考。
1 资料与方法
1.1 标本来源 收集2013~2019年手术切除的无功能垂体腺瘤组织151例,均经术后组织病理检查确诊,且排除肿瘤囊变、出血,其中男90 例,女61 例;年龄22~85 岁,平均(47.55±11.89)岁。肿瘤大小1 cm×0.5 cm×0.3 cm~6 cm×4.9 cm×6.6 cm,平均体积(18.35±5.33)cm3(计算公式:长×宽2)/2[7])。侵袭性垂体腺瘤(Knosp分级≥3级[8])48例。
1.2 组织芯片与免疫组化染色检测 组织标本采用石蜡包埋,随后进行切片、脱蜡、水化后,采用HE 染色定位、标记待研究的区域,使用组织芯片点样仪将标记好的组织按设计排列在空白蜡块上。首先要利用打孔机在已经标记好的靶位点上进行打孔,将组织芯转入蜡块孔中。使用切片机对阵列蜡块进行连续切片获得组织芯片。随后,运用5 个垂体相关转录因子(Pit-1、SF-1、GATA2、Tpit、ERα)的一抗,对组织芯片进行孵育,然后二抗孵育,最后利用软件LAS AF Lite 和Iamge J 对图像进行统计分析[9]。5 种垂体相关转录因子染色情况见图1。

图1 无功能垂体腺瘤垂体相关转录因子表达(×400)
1.3 统计学分析 应用SPSS 13.0软件分析;计量资料以±s表示,运用t检验和方差分析;利用R 语言包Upset分析作图;P<0.05为差异有统计学意义。
2 结果
2.1 151 例无功能垂体腺瘤的垂体相关转录因子的表达情况 根据2017 年WHO 垂体肿瘤分类:5 个垂体相关转录因子均阴性36例;Pit-1阳性91例,SF-1阳性11例,GATA2阳性9例,ERα阳性4例。
2.2 不同类型无功能垂体腺瘤病人的临床特征151例无功能腺瘤中,GH细胞腺瘤53例,多激素细胞腺瘤42例,零细胞腺瘤36例,GnH细胞腺瘤11例,TSH细胞腺瘤9例。
首先,各类型无功能腺瘤的年龄和Ki-67 指数无统计学差异(P>0.05),提示分型和年龄、Ki-67 指数没有直接联系;其次,多激素细胞腺瘤、GnH 细胞腺瘤和零细胞腺瘤体积明显大于TSH 细胞腺瘤和GH细胞腺瘤(P<0.05),提示无功能腺瘤的大小与相关垂体相关转录因子表达、激素水平有一定关系;第三,多激素细胞腺瘤、GH细胞腺瘤、零细胞腺瘤侵袭性比例明显增高(P<0.05);第四,零细胞腺瘤P53阳性率明显低于其他类型(P<0.05)。见表1。

表1 不同类型无功能垂体腺瘤病人的临床特征
2.3 垂体相关转录因子表达水平与无功能腺瘤病人临床特征的关系 与20~39 岁、>60 岁病人相比,40~59岁病人5个垂体相关转录因子阳性表达率和阴性表达率均明显增加(P<0.05;图2A);除Tpit阳性表达为男性多于女性(P<0.05;图2B),其余4个垂体相关转录因子均为女性多于男性(P<0.05;图2B);肿瘤体积、Ki-67指数与垂体相关转录因子的表达水平无明显关系(P>0.05;图2C、2D)。
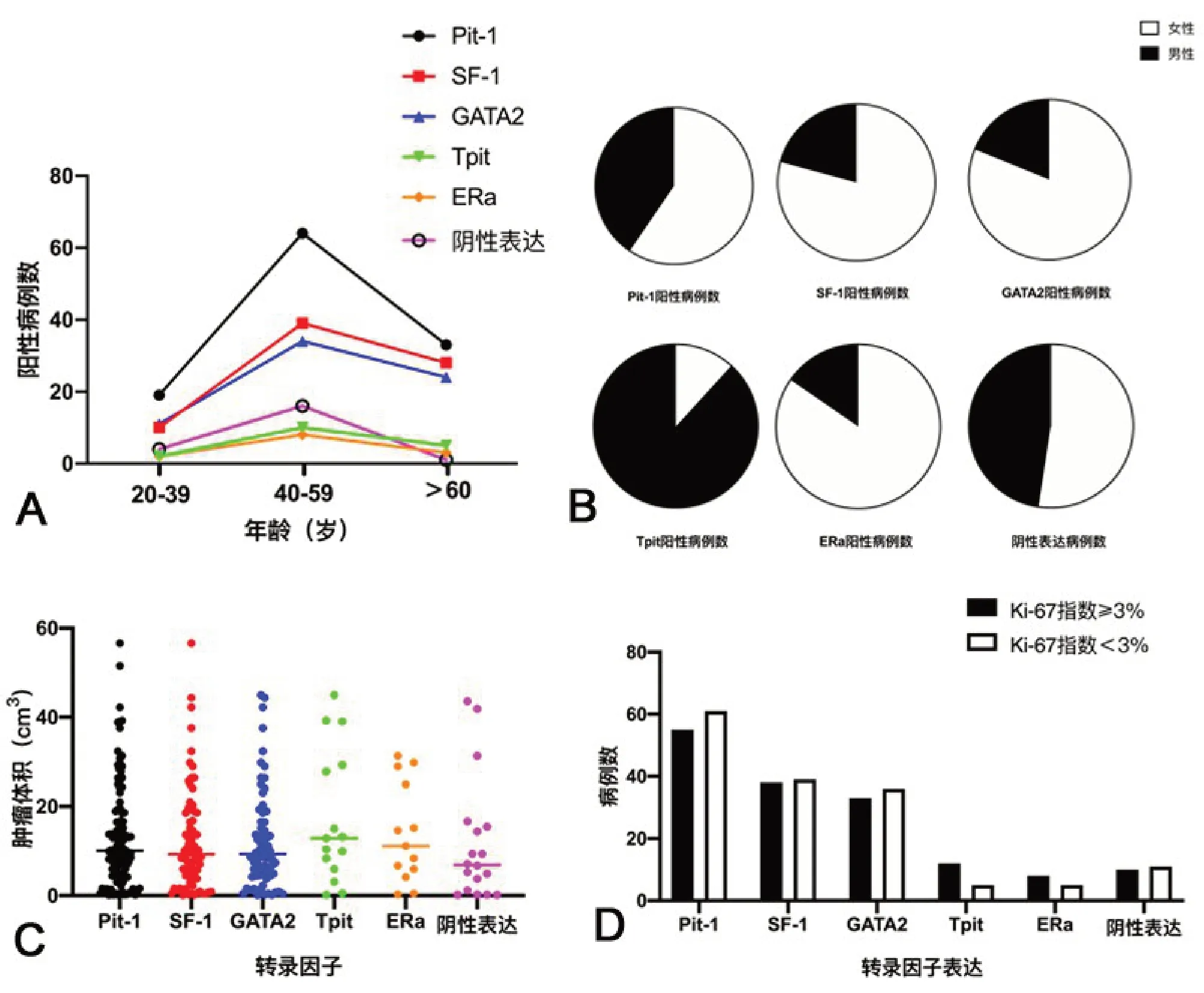
图2 无功能垂体腺瘤垂体相关转录因子阳性表达与病人临床特征的关系
2.4 垂体相关转录因子表达水平与无功能垂体腺瘤病人内分泌激素水平的关系Pit-1 阳性病人血清GH、TSH 水平明显增高(P<0.01;图3A、3D),ERa 阳性病人血清PRL水平明显增高(P<0.01;图3B),GATA2 阳性病人血清TSH 水平明显增高(P<0.01;图3D)。血清ACTH 水平与转录因子表达水平无明显关系(P>0.05;图3C)。这提示Pit-1、GATA2 表达可能与GH、TSH 分泌有关,而ERα表达则与PRL 分泌有关。

图3 无功能垂体腺瘤垂体相关转录因子阳性表达与激素水平的关系
3 讨论
根据2017 年第四版WHO 垂体肿瘤分型,零细胞腺瘤才是真正意义上的无功能腺瘤,所以仅仅通过血清内分泌激素的检测进行垂体腺瘤分类并不完全可靠,而垂体相关转录因子的检测则可以作为一种补充,对无功能垂体腺瘤做进一步分类。作为一种新的垂体肿瘤分类指标,垂体相关转录因子可以与旧的分类方法结合,使垂体肿瘤分类变得更加准确。将来,垂体相关转录因子或许能成为一种新的诊断方法或治疗靶点[10]。
本文对151例无功能垂体腺瘤的垂体相关转录因子以及临床特征进行分析,结果发现Tpit 阳性率在男性病人较高,而其他垂体相关转录因子阳性率均在女性病人较高,提示垂体相关转录因子可能与病人的性别有一定关系;其次,无功能垂体腺瘤的肿瘤大小与垂体相关转录因子、血清激素水平有一定关系;GH 细胞腺瘤P53 阳性率大于其他亚型,提示Pit-1 表达、GH 水平可能与P53 表达有一定关系,一定程度上可以预测病人预后情况。此外,垂体相关转录因子的表达和病人血清激素水平也有着一定的联系。
此外,我们发现,部分临床诊断为无功能垂体腺瘤的病人的垂体相关转录因子表达并非全为阴性,原因可能是:临床检测水平有限,激素水平低于检测水平下限;垂体瘤细胞表达相关垂体相关转录因子,但未能表现到蛋白水平。
然而,我们的研究尚存在诸多不足之处,例如样本量不够大,未开展进一步的随访研究,未进行更深入的机制研究等等。在后续的实验中,我们将通过分析垂体相关转录因子表达与血清激素水平、肿瘤复发情况、耐药性和肿瘤侵袭性等等之间的关系,深入开展机制研究,为垂体腺瘤的临床诊疗提供新的理论基础。
总之,垂体相关转录因子的检测在一定程度上可以为临床诊断的无功能垂体腺瘤分类提供新依据,对旧的分类标准进行补充。与此同时,旧的分类标准同样不能摒弃,二者相互补充能更好、更准确地对垂体肿瘤进行分类。除此之外,垂体相关转录因子的表达与某些临床病理特征有着密切的联系,提示垂体相关转录因子对指导诊疗、预测预后具有一定的价值,甚至有可能成为潜在的治疗靶标。

