苹果酸和嗜酸乳杆菌对圆叶决明青贮品质及微生物多样性的影响
张 娟 史文娇* 韩雪林 张 磊 李苏涛,2 冯启贤 李 妍,2 阳伏林* 周 晶
(1.福建农林大学动物科学学院(蜂学学院),福州 350002;2.福建农林大学国家菌草工程技术研究中心,福州 350002)
圆叶决明是一种生长于热带地区的多年生豆科决明属植物[1],起源自北美洲、中美洲和南美洲北部[2],适应性极强,具有耐高温、耐酸、耐旱、耐贫瘠等生理特征[3]。圆叶决明是我国亚热带地区为数不多的豆科牧草之一,其粗蛋白质(crude protein,CP)含量高(初花期可达15%),且无毒无异味,适口性较好,因此具备成为反刍动物优质牧草的潜质。近年来,为了加快圆叶决明在广东、福建等区域的应用推广,科研人员主要针对其品种繁育与生理生态特征开展了较多工作[4]。圆叶决明生长具有明显的季节性,夏季生长茂盛,冬季枯黄,生物量低,无法满足畜禽对全年优质蛋白质牧草的需求。因此,在实际牧草生产过程中,常用的做法是在牧草生产盛期对其进行刈割加工处理,以实现饲草料全年供求平衡。然而,我国南方地区多雨、潮湿,干草制备不易实现。所以,开展青贮技术的开发和利用研究有较好前景。研究表明,在青贮过程中,微生物变化是导致发酵饲料腐败变质的主要原因之一。因此,为更好预防青贮饲料的腐败变质,本试验通过高通量测序方法鉴定青贮后不同处理之间微生物群落变化,相较于传统的测定方法,该方法能够更系统准确鉴定物种多样性和丰富度,从微观角度分析青贮后微生物群落变化。
苹果酸作为一种良好的新型青贮饲料添加剂,具有较强的抗氧化作用,可快速降低pH,减少蛋白质水解,加速乳酸菌的生长,抑制酵母菌和霉菌的生长[5-6],提高微生物氮产量,减少甲烷产量,提高饲料的利用率[7]。由于青贮原料表面乳酸菌含量较少,自然发酵较难,因此采用添加青贮饲料添加剂的方法来改善青贮饲料品质。目前,国内外青贮饲料添加剂主要采用乳酸菌,它可通过增强乳酸菌活动提高青贮原料中优势菌群相对丰度,降低pH,加速发酵,抑制有害菌增殖,从而提高青贮品质[8-9]。目前,添加苹果酸和乳酸菌对各类青贮原料的效果不一,其对圆叶决明青贮方面的研究尚未见报道。因此,本试验旨在探究苹果酸和嗜酸乳杆菌对圆叶决明青贮品质的影响,并结合高通量测序解析青贮后微生物群落变化,为后续圆叶决明作为青贮饲料在家畜生产中的应用提供理论基础。
1 材料与方法
1.1 试验材料
圆叶决明于2020年9月采自福建省漳州市漳浦县万安牧场种植区,距离地面8~10 cm处进行刈割。圆叶决明原料营养品质见表1。苹果酸(纯度≥99.0%)购自某生物科技有限公司,嗜酸乳杆菌(活菌数≥5×1010CFU/g)由福建省农业科学院提供。

表1 圆叶决明原料营养品质(干物质基础)Table 1 Nutritional quality of raw materials of Chamaecrista rotundifolia (DM basis) %
1.2 试验设计
本课题组经前期预试验结果,得到圆叶决明青贮中苹果酸适宜添加比例为1%(鲜重)。试验设置对照组(CK组,无添加)、嗜酸乳杆菌组(试验Ⅰ组,添加1×106CFU/g嗜酸乳杆菌)、苹果酸组(试验Ⅱ组,添加1%苹果酸)、苹果酸和嗜酸乳杆菌组(试验Ⅲ组,添加1%苹果+1×106CFU/g嗜酸乳杆菌),每组3个重复,添加量均以鲜重为基础,各组均匀喷洒10 mL配制好的添加剂与无菌水混合液。
1.3 青贮制作
将刈割的圆叶决明进行晾晒至干物质(dry matter,DM)含量25%左右,使用铡刀切至1~2 cm小段,然后将不同添加处理的苹果酸和嗜酸乳杆菌均匀喷洒至晾晒后的圆叶决明,之后进行装袋,每袋400 g,混合均匀,每组3个重复,使用真空密封机进行压实抽气。室温储存,青贮60 d拆封,取样分析。
1.4 指标测定
1.4.1 营养品质和发酵特性
取200 g具有代表性的样品,于65 ℃烘箱中烘干72 h,测定DM含量,将干燥样粉碎过筛,测定基本营养指标。CP含量采用KDN-103F自动定氮仪测定,中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量采用范式纤维法测定[10],水溶性碳水化合物(water soluble carbohydrates,WSC)含量采用蒽酮-硫酸比色法测定[11]。
取10 g具有代表性的样品,加入90 mL纯水于4 ℃冰箱浸提24 h,经4层纱布过滤得到浸提液,即时测定pH,剩余样品分装保存用于氨态氮(NH3-N)和有机酸含量的测定。氨态氮含量采用苯酚-次氯酸钠比色法测定[12],有机酸中乳酸(lactic acid,LA)、乙酸(acetic acid,AA)、丙酸(propionic acid,PA)含量采用高效液相仪(CT0-10AS,日本岛津公司)测定[13-14]。
1.4.2 微生物多样性测定

1.5 数据分析
基础数据利用Excel 2013软件进行数据分析并绘制图表,利用SPSS 20.0软件对数据进行单因素方差分析,并采用Duncan氏法对数据进行多重比较,结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 苹果酸和嗜酸乳杆菌对圆叶决明青贮营养品质的影响
由表2可知,与CK组相比,各试验组DM和CP含量显著升高(P<0.05),但各试验组之间无显著差异(P>0.05)。与CK组相比,各试验组NDF含量显著降低(P<0.05);其中,试验Ⅱ组NDF含量显著低于试验Ⅰ和Ⅲ组(P<0.05),试验Ⅲ组NDF含量显著低于试验Ⅰ组(P<0.05)。与CK组相比,试验Ⅱ和Ⅲ组ADF含量显著降低(P<0.05)。与CK组相比,试验Ⅲ组WSC含量显著升高(P<0.05),而试验Ⅰ组WSC含量显著降低(P<0.05)。

表2 苹果酸和嗜酸乳杆菌对叶决明青贮营养品质的影响(干物质基础)Table 2 Effects of malic acid and Lactobacillus acidophilus on nutritional quality of Chamaecrista rotundifolia silage (DM basis) %
2.2 苹果酸和嗜酸乳杆菌对圆叶决明青贮发酵特性的影响
由表3可知,与CK组相比,各试验组pH显著降低(P<0.05);其中,试验Ⅱ和Ⅲ组pH显著低于试验Ⅰ组(P<0.05)。与CK组相比,试验Ⅱ和Ⅲ组氨态氮含量显著降低(P<0.05);其中,试验Ⅲ组氨态氮含量显著低于试验Ⅱ组(P<0.05)。与CK组相比,各试验组LA含量显著增加(P<0.05),但试验组之间无显著差异(P>0.05)。与CK组相比,试验Ⅱ和Ⅲ组AA含量显著降低(P<0.05)。与CK组相比,各试验组PA含量显著降低(P<0.05);其中,试验Ⅱ组PA含量显著低于试验Ⅰ和Ⅲ组(P<0.05)。
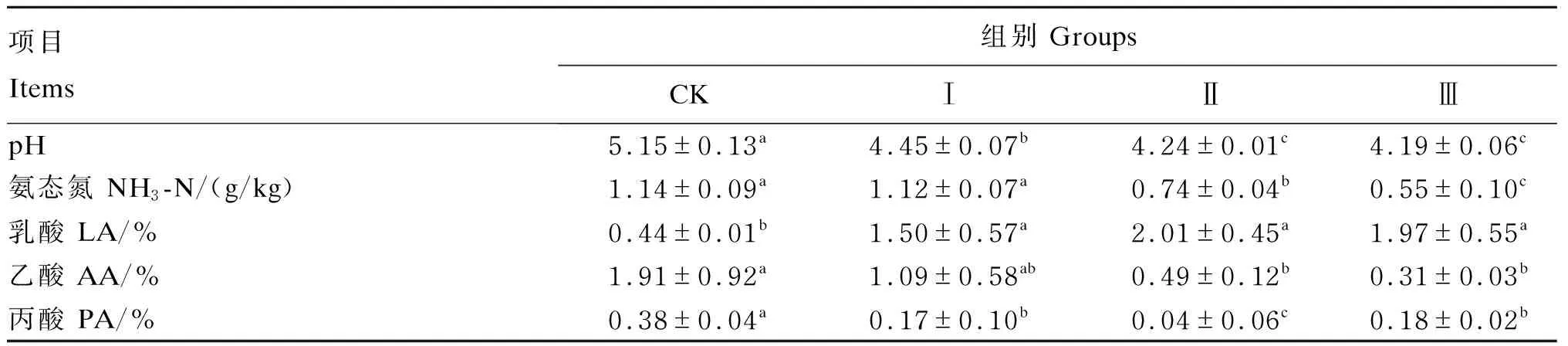
表3 苹果酸和嗜酸乳杆菌对圆叶决明青贮发酵特性的影响(干物质基础)Table 3 Effects of malic acid and Lactobacillus acidophilus on fermentation characteristics of Chamaecrista rotundifolia silage (DM basis)
2.3 苹果酸和嗜酸乳杆菌对圆叶决明青贮微生物多样性的影响
2.3.1 OTU分析
以97%的一致性进行OTU聚类,4组共得到1 919个不同的OTU。由图1可知,与CK组相比,各试验组OTU数量明显增加,4组OTU数量依次为试验Ⅲ组>试验Ⅰ组>试验Ⅱ组>CK组。其中,4组中核心OTU数量为151个,CK组及试验Ⅰ、Ⅱ、Ⅲ组特有OTU数量分别为51、150、112、248个。
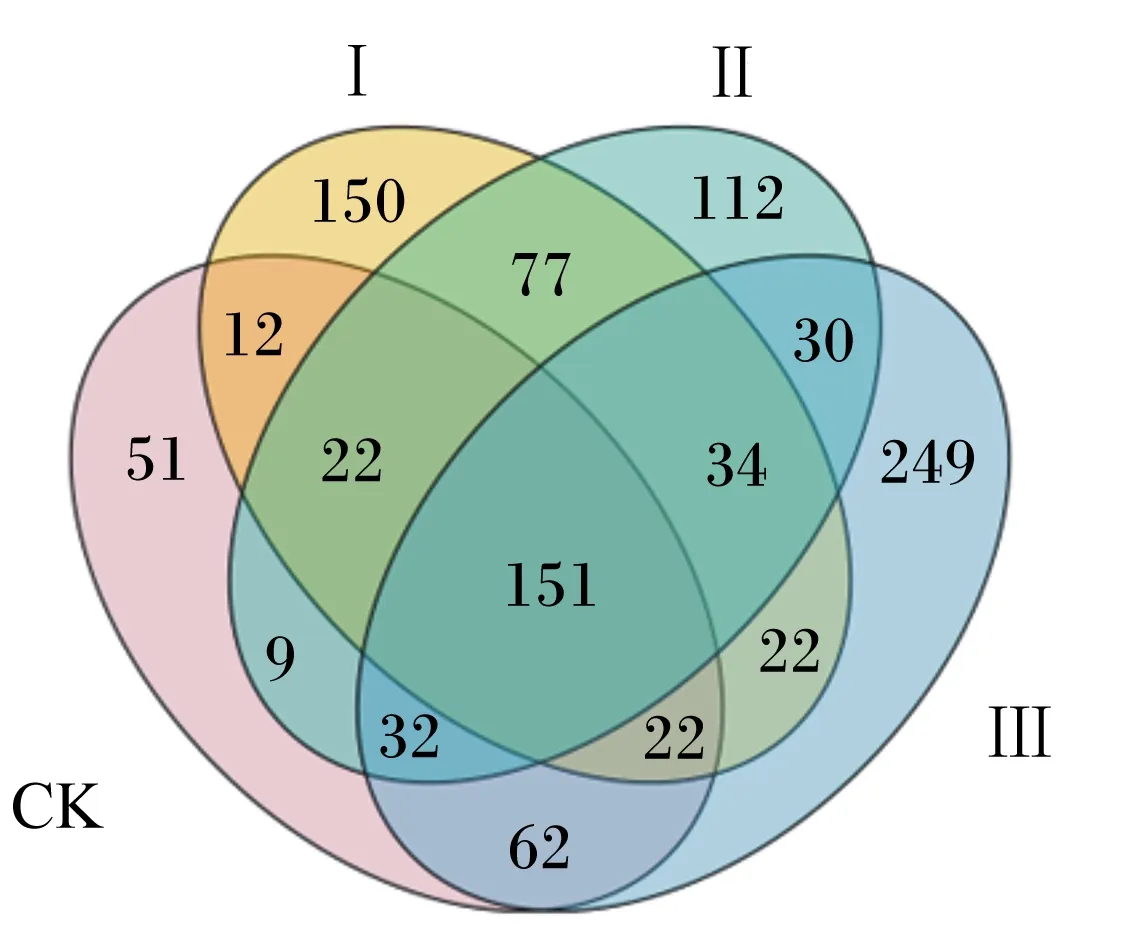
CK:对照组 control group;Ⅰ: Ⅰ组 group Ⅰ;Ⅱ:group Ⅱ; Ⅲ:group Ⅲ。下图同 the same as below。图1 青贮后微生物OTU分布Venn图Fig.1 Venn diagram of microbial OTU distribution after silage
稀释曲线能够反映测序数据量的合理性及样品的物种丰富度[15]。由图2可知,样本测序数据量为40 120个,随着测序数据量的增加,稀释曲线逐渐趋于平缓,表明本次测序结果较为合理。

图2 各组稀释曲线Fig.2 Dilution curves of each group
2.3.2 苹果酸和嗜酸乳杆菌对圆叶决明青贮微生物α多样性的影响
α多样性分析包含群落物种多样性和丰富度的分析,Chao1指数和ACE指数用于估计群落样本中包含的物种总数,Shannon指数和Simpson指数用来描述群落多样性(物种丰富度和均匀度)。由表4可知,与CK组相比,试验Ⅲ组Shannon指数和ACE指数显著增加(P<0.05);其中,试验Ⅲ组Shannon指数显著高于试验Ⅰ和Ⅱ组(P<0.05),试验Ⅲ组ACE指数显著高于试验Ⅰ组(P<0.05)。
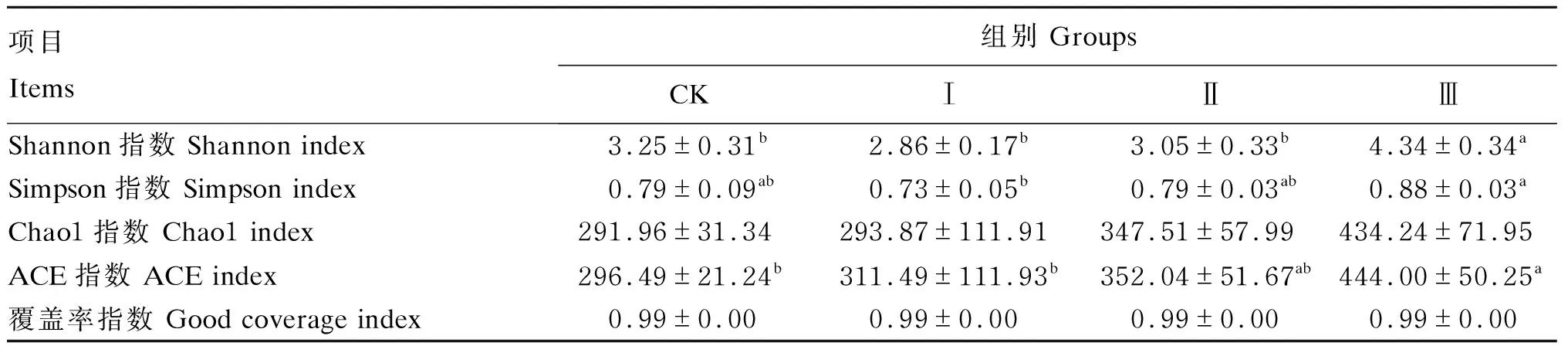
表4 各组α多样性分析Table 4 Alpha diversity analysis of each groups
2.3.3 苹果酸和嗜酸乳杆菌对圆叶决明青贮门水平微生物群落组成的影响
由图3和表5可知,各组圆叶决明青贮门水平微生物群落组成无明显差异,其中CK组优势菌门主要为厚壁菌门(Firmicutes,73.20%)、变形菌门(Proteobacteria,23.45%),两者总相对丰度达96.65%。与试验Ⅰ组相比,试验Ⅱ和Ⅲ组厚壁菌门相对丰度显著下降(P<0.05)。与CK和试验Ⅰ组相比,试验Ⅱ和Ⅲ组蓝藻菌门(Cyanobacteria)相对丰度显著增加(P<0.05);其中,试验Ⅱ组蓝藻菌门相对丰度显著高于试验Ⅲ组(P<0.05)。与CK组相比,试验Ⅲ组拟杆菌门(Bacteroidota)相对丰度显著增加(P<0.05)。

Firmicutes:厚壁菌门;Cyanobacteria:蓝藻菌门;Proteobacteria:变形菌门;Actinobacteriota:放线菌门;Bacteroidota:拟杆菌门;Halanaerobiaeota:盐厌氧菌门;Campilobacterota:弯曲杆菌门;unidentified_Bacteria:不明细菌;Deinococcota:脱氨基可卡因菌门;Acidobacteriota:酸杆菌门;Others:其他。图3 苹果酸和嗜酸乳杆菌对圆叶决明青贮门水平微生物群落组成的影响Fig.3 Effects of malic acid and Lactobacillus acidophilus on microbial community composition at phylum level of Chamaecrista rotundifolia silage

表5 苹果酸和嗜酸乳杆菌对圆叶决明青贮优势菌门相对丰度的影响Table 5 Effects of malic acid and Lactobacillus acidophilus on dominant bacterial phyla relative abundance of Chamaecrista rotundifolia silage %
2.3.4 苹果酸和嗜酸乳杆菌对圆叶决明青贮属水平微生物群落组成的影响
由图4和表6可知,各组圆叶决明青贮属水平优势菌属为乳杆菌属(Lactobacillus)、梭状芽孢杆菌属(Clostridium_sensu_stricto_12)、肠杆菌属(Enterobacter)等。与CK组相比,试验Ⅰ和Ⅱ组乳杆菌属相对丰度显著增加(P<0.05);其中,试验Ⅰ组乳杆菌属相对丰度显著高于试验Ⅱ和Ⅲ组(P<0.05)。与CK组相比,各试验组梭状芽孢杆菌属、果胶杆菌属(Pectobacterium)相对丰度显著降低(P<0.05)。与CK组相比,试验Ⅱ和Ⅲ组未被定义叶绿体(unidentified_chloroplast)相对丰度显著增加(P<0.05);其中,试验Ⅱ组未被定义叶绿体相对丰度显著高于试验Ⅲ组(P<0.05)。与CK组相比,试验Ⅲ组普氏梭菌属(Faecalibacterium)相对丰度显著增加(P<0.05)。

Lactobacillus:乳杆菌属;Clostridium_sensu_stricto_12:梭状芽孢杆菌属;unidentified_chloroplast:未被定义叶绿体;Enterobacter:肠杆菌属;Ochrobactrum:苍白杆菌属;Methylobacterium-Methylorubrum:甲基杆菌属;Faecalibacterium:普氏梭菌属;Pectobacterium:果胶杆菌属;Weissella:魏斯氏菌属;Others:其他。图4 苹果酸和嗜酸乳杆菌对圆叶决明青贮属水平微生物群落组成的影响Fig.4 Effects of malic acid and Lactobacillus acidophilus on microbial community composition at genus level of Chamaecrista rotundifolia silage

表6 苹果酸和嗜酸乳杆菌对圆叶决明青贮优势菌属相对丰度的影响Table 6 Effects of malic acid and Lactobacillus acidophilus on dominant bacterial genus relative abundance of Chamaecrista rotundifolia silage %
2.3.5 各组之间圆叶决明青贮微生物群落的差异物种
由图5可知,通过LEfSe分析(线性判别分析分数>4)对圆叶决明青贮微生物群落的差异物种进行分析,4组中共找到27个相对丰度差异的物种。门水平差异物种为试验Ⅱ中蓝藻菌门;属水平差异物种为试验Ⅰ中乳杆菌属,试验Ⅱ组中未被定义叶绿体,试验Ⅲ组中山羊葡萄球菌属(Staphylococcus_caprae)、普拉梭菌属(Faecalibacterium_prausnitzii)和壳聚糖酶产生菌属(Mitsuaria)。CK组在门水平和属水平均无差异物种出现。

Lachnospirales:无色螺旋菌目;Lachnospiraceae:螺旋藻科;Rhizobiaceae:根瘤菌科;Staphylococcus_caprae:山羊葡萄球菌属;Oscillospirales:示波螺旋目;Mitsuaria:壳聚糖酶产生菌属;Mitsuaria:松江菌属;Ruminococcaceae:瘤胃球菌科;Faecalibacterium_prausnitzii:普拉梭菌属;Staphylococcus:葡萄球菌;Lactobacillus_pantheris:混合乳酸杆菌;unidentified_chloroplast:未被定义叶绿体;Chloroplast:叶绿体;Cyanobacteria:蓝藻菌门; Bacilli:杆菌纲;Lactobacillales:乳杆菌目;Lactobacillus:乳杆菌属;Lactobacillus_rhamnosus:鼠李糖乳杆菌;Lactobacillus_zymae:乳酸杆菌;Clostridia:梭状芽胞杆菌;Lactobacillus_dextrinicus:乳酸杆菌属。图5 各组之间圆叶决明青贮微生物群落的差异物种Fig.5 Different species of Chamaecrista rotundifolia microbial community silage among all groups
3 讨 论
3.1 苹果酸和嗜酸乳杆菌对圆叶决明青贮营养品质和发酵特性的影响
本试验通过添加苹果酸和嗜酸乳杆菌对圆叶决明进行青贮处理,主要目的是通过快速降低pH,抑制CP降解,提高圆叶决明青贮饲料品质。pH的快速降低可抑制有害菌活性,防止蛋白质降解。本试验结果显示,所有添加剂处理的青贮饲料pH显著降低,表明该添加剂均能有效改善圆叶决明青贮品质,这一结论与Ke等[16]研究结果一致。有机酸、氨态氮是判定青贮饲料品质的关键指标,是乳酸菌与有害菌竞争的代谢产物。AA、PA在提高青贮饲料有氧稳定性方面均具有良好的效果[17],AA具有很好的抑菌作用,可有效抑制开窖后腐败菌的繁殖[18];PA可抑制好氧菌、酵母菌及梭菌增殖[19],从而减少营养物质的降解,保障青贮饲料品质。本试验中,试验Ⅱ和Ⅲ组AA、PA含量显著低于CK组,可能是因为pH的快速降低抑制有害菌增殖,发酵过程以同型发酵为主[20],并且随着青贮的持续发酵,乳酸菌含量不断积累,苹果酸同时会向LA转变[21],因此这也导致添加试验Ⅱ组LA含量显著升高,AA含量显著下降。有机酸的添加会使秸秆软化湿润,纤维结构松散,有利于NDF和ADF含量的降低[22]。本试验中,试验Ⅱ和Ⅲ组NDF和ADF含量显著低于CK组,表明添加苹果酸具有降低NDF和ADF含量的效果;而与试验Ⅱ组相比,试验Ⅲ组NDF和ADF含量均升高,表明混合添加苹果酸和乳杆菌对降低圆叶决明青贮纤维含量有抑制作用。李孟伟等[23]在研究苹果酸对反刍动物生长性能和瘤胃发酵的影响中发现,苹果酸作为三羧酸循环的中间产物,可有效提高CP含量和木质纤维素的表观消化率,减少青贮饲料氨态氮的产生。本试验中,试验Ⅱ组氨态氮含量显著低于CK组,与上述结果一致;试验Ⅱ和Ⅲ组DM、CP、WSC含量显著升高。这说明添加苹果酸和嗜酸乳杆菌可减少DM损失,抑制蛋白质水解,原因可能是苹果酸为整个青贮过程提供了更多的发酵底物[24];嗜酸乳杆菌能够加快发酵进程,抑制有害菌活性,减少底物损耗,从而保证青贮饲料发酵品质。但本试验中,与CK组相比,试验Ⅰ组WSC含量显著减少,可能是添加嗜酸乳杆菌加大了对发酵底物的需求,从而使青贮饲料的WSC含量显著降低。
3.2 苹果酸和嗜酸乳杆菌对圆叶决明青贮微生物多样性的影响
青贮是一个微生物群落演变的过程,主要是有益菌逐渐主导,抑制有害菌群生长的过程[25]。α多样性主要反映微生物群落物种丰富度、多样性及测序深度,主要通过Chao1指数、ACE指数来评价物种的丰富度,Simpson指数和Shannon指数来评价物种的多样性。李莉等[26]在研究象草中添加纤维素酶和淀粉青贮30 d后发现,添加纤维素酶和淀粉组Simpson指数和Shannon指数均高于对照组。本试验中,试验Ⅲ组OTU数量、Shannon指数、ACE指数均高于CK组,表明试验Ⅲ组物种多样性和丰富度较高;但在本试验中,试验Ⅰ组Simpson指数和Shannon指数低于CK组,ACE指数高于CK组,表明添加嗜酸乳杆菌有益于圆叶决明青贮乳酸杆菌增殖,抑制有害菌增殖。
本试验通过高通量测序发现,圆叶决明青贮后门水平优势菌群为厚壁菌门和变形菌门,其次为蓝藻菌门,与He等[27]研究结果一致。厚壁菌门是革兰氏阳性菌,主要包括产芽孢、非产芽孢和支原体菌群,可降解大分子物质,如纤维素、淀粉、蛋白质等[28],厚壁菌门和变形菌门可同时降解纤维类物质,为微生物活动提供更多底物[29]。变形菌门是一类革兰氏阴性菌,包括很多病原菌,如大肠杆菌、沙门氏菌等[30],可与乳酸菌竞争底物,且会导致CP含量下降和氨态氮含量的升高。拟杆菌门可做为糖、淀粉等非纤维性碳水化合物的主要分解者[31],可有效改善动物肠道微生物环境。蓝藻菌门作为热带牧草的主要微生物,在发酵过程中通常会被乳杆菌属和肠杆菌属所代替[32]。
通过进一步分析圆叶决明青贮后微生物群落变化,结果表明,各组微生物群落结构存在明显差异,各组优势菌属均为乳杆菌属,但经属水平物种注释及LEfSe分析,试验Ⅰ组乳杆菌属相对丰度高达87.05%,显著高于CK组。乳杆菌属是厚壁菌门的一种菌属,在青贮过程中能产生LA,快速降低pH[33],同时会抑制有害菌的滋生,进而减少CP、WSC含量的降解。Yang等[34]研究结果表明青贮饲料中LA含量与乳杆菌属相对丰度呈正相关。本试验中,试验Ⅱ和Ⅲ组LA含量显著高于CK组,且试验Ⅱ和Ⅲ组乳杆菌属相对丰度显著低于试验Ⅰ组,这可能是由于添加的苹果酸导致较强的酸性环境反而抑制乳酸菌的活性[35],从而使得乳杆菌属相对丰度显著降低;且通过α多样性分析发现,试验Ⅰ组的Simpson指数和Shannon指数较低,表示该组微生物多样性较低,因此添加嗜酸乳杆菌使得乳酸菌能够快速主导整个发酵过程,从而抑制有害菌的增殖,当乳杆菌属成为优势菌群时,微生物多样性呈下降状态[36]。研究表明,梭状芽孢杆菌属、肠杆菌属均可利用青贮饲料的LA和WSC,产生丁酸[37-38],阻止乳酸菌生长,且可通过氧化还原反应导致青贮饲料的腐败变质[39]。肠杆菌属的存在可能会消耗底物产生氨态氮,同时促进青贮饲料蛋白质的降解,破坏青贮饲料的营养成分,这也可能是导致试验组氨态氮含量较低的主要原因。本试验中,各试验组LA含量显著增加,梭状芽孢杆菌属和肠杆菌属相对丰度降低,说明各试验组通过发酵产生的LA足以将pH降低至抑制肠杆菌属和梭状芽孢杆菌属增殖的水平,使其有助于提高青贮饲料发酵品质;试验Ⅱ和Ⅲ组较低的AA含量可能是试验组较低的肠杆菌属相对丰度抑制了将LA转变为AA的过程[40],因此导致试验Ⅱ和Ⅲ组AA含量显著降低。此外,通过LEfSe分析,显示试验Ⅲ组中属水平差异物种为普拉梭菌属。研究表明,普拉梭菌属是粪杆菌属种的唯一种属,其自身有助于丁酸盐的产生[41],在生产中丁酸多以丁酸盐和丁酸甘油酯的形式存在,较高含量的丁酸会促进有害微生物分解蛋白质、糖类等物质,因此较高的普拉梭菌属相对丰度会降低青贮饲料品质。
4 结 论
苹果酸和嗜酸乳杆菌均能有效改善圆叶决明青贮营养品质、发酵特性,具体表现在DM、CP和LA含量升高,氨态氮含量下降;并且能够改善圆叶决明青贮微生物的结构和组成,具体表现在乳杆菌属相对丰度增加,变形菌门、梭状芽孢杆菌属、肠杆菌属相对丰度降低。本试验条件下,以单独添加嗜酸乳杆菌青贮效果较好。
致谢:
感谢福建农林大学庄益芬教授在青贮试验过程中的指导;感谢福建省农业科学院陈鑫珠、黄秀声、杨有泉等老师在试验材料与试验菌株获取方面的帮助。

