脱氢枞酸缩水甘油酯接枝羟丙基壳聚糖制备及性能研究
杨欣欣,郭 伟,蔡照胜,黄旭娟,王 婷,丁正青
(1.盐城工学院 化学化工学院,江苏 盐城 224051;2.中国林业科学研究院 林产化学工业研究所,江苏 南京 210042;3.江苏大学 化学化工学院,江苏 镇江 212000)
壳聚糖(CS)是一种天然的碱性多糖,具有优良的生物相容性和可降解性[1-2]。CS结构中引入羟丙基后得到的羟丙基壳聚糖(HPCS),不但比壳聚糖有更好的水溶性,而且有更好的成膜和吸湿保湿性能,已作为助剂广泛应用于食品、医药和化妆品等领域[3-5]。利用水溶性壳聚糖的亲水性还可以制备以其糖链为亲水基的高分子表面活性剂,如将含松香结构的活性季铵盐引入到水溶性羧烷基壳聚糖结构中,得到了对绿脓杆菌(P.aeruginosa)和产气大肠杆菌(E.aerogenes)有良好抑制效果的季铵盐型高分子表面活性剂[6]。松香是以树脂酸为主要成分的天然产物[7],其经歧化反应后可转化为以脱氢枞酸为主成分的歧化松香,而通过脱氢枞酸与环氧氯丙烷反应可得到脱氢枞酸缩水甘油酯(GDHA)[8]。GDHA作为含有亲油性菲环和环氧结构的松香衍生物,可与含活泼氢的水溶性高分子化合物进行亲核加成反应,生成以松香结构为亲油基的高分子表面活性剂[9]。徐志刚等[10]通过低相对分子质量的CS与GDHA反应,合成了(2-羟基-3-脱氢枞酰氧基)丙基壳低聚糖,而表面活性的研究结果表明取代度为18%左右的产物在水溶液中的临界胶束浓度可低至1.50 g/L,能实现的最小表面张力接近52 mN/mm。王婷等[11]以CS经羟乙基化改性生成的水溶性羟乙基壳聚糖为基础原料之一,以脱氢枞基缩水甘油醚为改性剂,制备得到了非离子表面活性剂(2-羟基-3-脱氢枞氧基)丙基羟乙基壳聚糖,其对苯-水乳液的稳定性优于Tween-60。本研究探讨了通过接枝以制备具有亲油亲水性的GDHA接枝HPCS(GDHA-g-HPCS)的可行性,并考察产物的表面活性、乳化性能及其随GDHA在HPCS上接枝度改变呈现的变化规律,同时探索了GDHA-g-HPCS在甘油磷酸钠(GP)存在下的凝胶化行为,以期为其在乳液稳定和药物负载与控制释放等领域的应用提供基础数据。
1 实 验
1.1 试剂与仪器
壳聚糖(CS),脱乙酰度(DD)87.95%,黏均相对分子质量(MV)为6.81×105,国药集团化学试剂有限公司;甘油磷酸钠(GP,纯度≥97%),生化试剂,苏州天可贸易有限公司;脱氢枞酸缩水甘油酯(GDHA,纯度≥65.0%),按文献[8]自制;蔗糖酯,酸值≤5.0 mg/g,游离糖≤10%,上海龙尼精细化工有限公司;单甘酯,化学纯,南京化学试剂有限公司;脂肪醇聚氧乙烯醚,AEO-9,国药集团化学试剂有限公司;其他试剂都为分析纯。
Nicolet 670型傅里叶变换红外光谱(FT-IR)仪,美国Nicolet公司;Bruker AVIII-500型核磁共振(NMR)仪,德国Bruker公司;UV-5500PC型紫外-可见分光光度(UV-Vis)计,上海元析仪器有限公司;FLASH 2000型元素分析仪,美国THERMO公司;JYW-200D型自动表面张力仪,承德市世鹏检测设备有限公司;Scientz-10N型冷冻干燥机。
1.2 合成路线
在反应过程中,首先是CS糖单元中的羟基或氨基在碱存在下对环氧丙烷进行亲核加成,将羟丙基引入CS糖单元中得到羟丙基壳聚糖(HPCS);然后HPCS再与GDHA进行亲核加成,得到HPCS中引进了疏水性松香结构的脱氢枞酸缩水甘油酯接枝羟丙基壳聚糖(GDHA-g-HPCS),具体路线见下图:
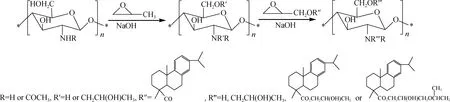
1.3 实验方法
1.3.1HPCS的制备 按类似文献[12]方法制备羟丙基壳聚糖。取5 g的CS分散于质量分数为30% 的NaOH水溶液中,并在-18 ℃下碱化6 h;将碱化后的CS转入三口反应瓶中,加入150 mL 异丙醇并搅拌分散;由滴液漏斗缓慢滴加23.62 g环氧丙烷,并在50 ℃水浴加热下搅拌,反应36 h后,冷却反应物料至室温再抽滤;得到的固体用300 mL蒸馏水搅拌分散后,再转移入透析袋于蒸馏水环境中透析至中性(每6 h换水一次)。透析后的物料经减压蒸发浓缩除去大部分水后,再用丙酮进行脱水除杂,最后经抽滤和冷冻干燥,得到HPCS。
1.3.2GDHA接枝HPCS的制备 按类似文献[12]方法进行接枝改性。搅拌下将4 g HPCS分散于150 mL二甲基亚砜中,搅拌至其完全溶解后,再加入计量的GDHA和四丁基溴化铵,并在60 ℃下反应8 h;冷却反应物料至室温,再加入乙酸乙酯以使接枝产物沉淀析出;对物料进行抽滤,并在搅拌下将得到的固体分散于300 mL蒸馏水中;将分散液转移入透析袋,并于蒸馏水环境中透析直至其pH值接近7(每6 h换水一次);对透析后的物料进行减压浓缩,待大部分水被除去后,再将浓缩液分散于丙酮中以实现脱水除杂,最后经抽滤和冷冻干燥,即得到GDHA-g-HPCS。
1.4 表征分析
1.4.1HPCS取代度及GDHA-g-HPCS接枝度的计算 分别测定HPCS和GDHA-g-HPCS的C及N质量分数,再根据式(1)和式(2)确定HPCS的取代度(DS)和GDHA-g-HPCS的接枝度(DG)。
(1)
(2)
式中:DS—HPCS的取代度,%;DG—GDHA-g-HPCS的接枝度,%;DD—CS的脱乙酰度,%;wC—被分析样品中C元素的质量分数,%;wN—被分析样品中N元素的质量分数,%。
1.4.2HPCS及GDHA-g-HPCS的结构表征 用KBr压片法进行CS、HPCS和GDHA-g-HPCS的FT-IR分析,UV-Vis法研究HPCS和GDHA-g-HPCS的紫外吸收行为,以D2O或D2O/HCl分别为溶剂进行样品的1H NMR分析。
1.4.3表面活性评价 以初始质量浓度(C0)为2.0 g/L的溶液为母液,分别测定经双倍稀释法形成的系列溶液的表面张力(γ)值,并作出GDHA-g-HPCS溶液γ值与其浓度(C)间的关系曲线,根据γ-lgC曲线确定GDHA-g-HPCS在水溶液中的临界胶束浓度(Ccmc)、Ccmc对应的表面张力(γcmc)及最小表面张力(γmin)。
1.4.4乳化能力测定 测定以GDHA-g-HPCS为乳化剂形成的苯-水乳液的稳定时间,并根据得到的乳液稳定时间评价GDHA-g-HPCS的乳化能力。
1.4.5GDHA-g-HPCS交联物的凝胶形成时间测定 测定由30 g/L的GDHA-g-HPCS(DG为2.81%)溶液和1 000 g/L的甘油磷酸钠(GP)溶液按不同体积比形成的混合液的凝胶化时间,及形成的凝胶在4 ℃ 环境中再完全转变为溶胶时所需的时间。
2 结果与讨论
2.1 GDHA-g-HPCS的结构表征
2.1.1DS和DG值 HPCS及GDHA与HPCS糖单元的物质的量比值分别为1、2、4、6和8时所对应的接枝改性产物的DS和DG值见表1。
由表1中结果可知,随着GDHA与HPCS物料比的增加,GDHA-g-HPCS的DG呈逐渐增加的趋势。其原因是GDHA量的增加,使得HPCS结构中的氨基和羟基上的活泼H获得更多与GDHA结构中环氧基团反应的机会,从而有效地增加了GDHA对HPCS的接枝率。
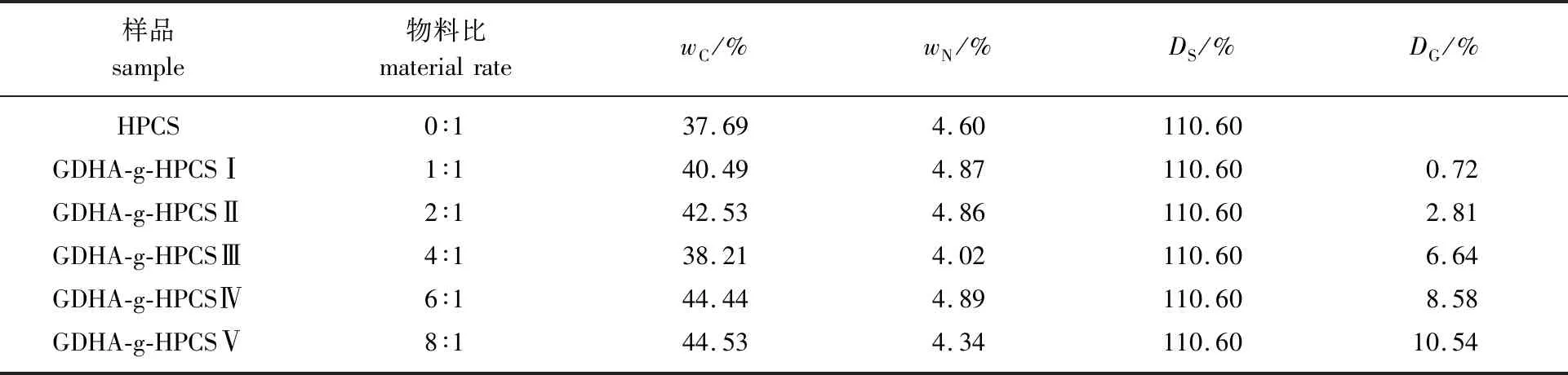
表1 不同GDHA与HPCS糖单元物质的量比(物料比)接枝产物的DS和DG值Table 1 DS and DG of GDHA-g-HPCSs with different molar ratio of GDHA and sugar unit of HPCS(material rate)
2.1.2FT-IR、UV-vis和1H NMR分析 CS、HPCS和GDHA-g-HPCS Ⅱ的FT-IR谱图见图1,HPCS和GDHA-g-HPCSⅡ的紫外-可见吸收光谱及1H NMR图见图2和图3。
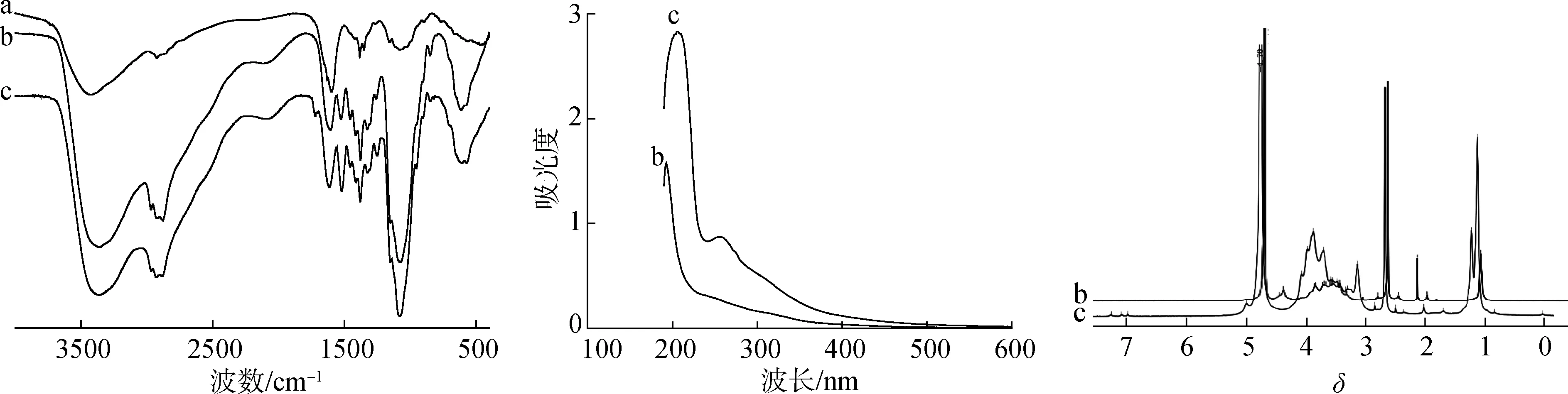
a.CS;b.HPCS;c.GDHA-g-HPCSⅡ图1 FT-IR图Fig.1 FT-IR spectra
与CS相比,在HPCS的FT-IR图中,2883 cm-1处有与亚甲基中νC—H相关的吸收峰,1380 cm-1处有与甲基中δC—H相关的吸收峰,说明羟丙基已被成功引入CS结构中;与HPCS相比,GDHA-g-HPCSⅡ的FT-IR图中,反映甲基和亚甲基存在的νC—H吸收峰强度明显增加,1253 cm-1处为仲醇或醚结构中C—O伸缩振动吸收峰,1728 cm-1处为酯羰基的伸缩振动吸收峰,说明GDHA被成功接枝到HPCS上。
图2中,HPCS水溶液在193 nm处有一窄而强的吸收峰,GDHA-g-HPCSⅡ水溶液在206 nm处出现类似峰;此外,GDHA-g-HPCSⅡ水溶液在255 nm处还有与芳环共轭结构相关的吸收峰。其原因为HPCS通过接枝反应转化为GDHA-g-HPCSⅡ时,有部分氨基与GDHA发生反应,导致HPCS中N—H的吸收峰部分发生红移;而GDHA接枝进入HPCS糖链中,其分子结构中脱氢枞基具有的芳环结构使GDHA-g-HPCSⅡ水溶液在近紫外区产生吸收。
在HPCS的1H NMR谱图中,δ4.42处有反映氨基葡萄糖(Glc N)或N-乙酰氨基葡萄糖(Glc NAc)单元C-1上的质子峰;δ4.10~3.85处有反映羟基氧取代糖单元(O取代Glc N和Glc NAc单元)C-5上的质子峰;δ3.69、3.57和3.45处有反映Glc NAc单元C-3、C-6及糖单元羟基上氧取代羟丙基(O取代羟丙基)中亚甲基、N取代羟丙基中次甲基和Glc NAc单元C-2上的质子峰;δ2.71处有反映C-6 上O取代羟丙基中次甲基和Glc N单元C-2上的质子峰,δ2.14的峰为羟基质子峰,δ1.97处有反映Glc NAc单元乙酰基中甲基的质子峰,δ1.08的峰为羟丙基中甲基的质子峰。
在GDHA-g-HPCSⅡ的1H NMR图中,除了有与HPCS结构中质子相关的基本峰外,在δ7.22、7.05和6.94处还出现了与脱氢枞基中芳环上质子相关的峰;同时,在δ1.15和1.05处的峰强度明显增强,δ2.14 处反映羟丙基中羟基质子存在的峰强度明显下降,说明在接枝改性产物中有更多的CH2和CH3,且部分羟丙基中的羟基参与了接枝反应。
2.2 GDHA-g-HPCS的表面活性
GDHA-g-HPCS水溶液的表面张力(γ)与其质量浓度(C)的关系曲线见图4。通过对图4进行分析,可以得到具有不同接枝度的GDHA-g-HPCS在水溶液中所对应的Ccmc、γcmc和γmin值,结果见表2。由表2中结果可知,随DG的增加,GDHA-g-HPCS在水溶液中形成胶束的能力逐渐增强,但其所能实现的γmin基本在45 mN/m左右。其原因应与GDHA的引入对接枝改性产物的亲油性的影响有关:DG值越大,说明有更多GDHA接枝进入HPCS,从而使接枝改性产物有更强的疏水性,并使水溶液中的GDHA-g-HPCS有更强的向溶液表面迁移或在溶液内部自组装形成胶束的推动力;而GDHA-g-HPCS在水溶液中所能实现的γmin与其在溶液表面吸附所能产生的非极性最大值有关。脱氢枞基的刚性及接枝产物的DG最大值仅为10.54%,使得不同DG的GDHA-g-HPCS在水溶液表面达到饱和吸附时所产生的非极性大小几乎相同,因而γmin相差不大。
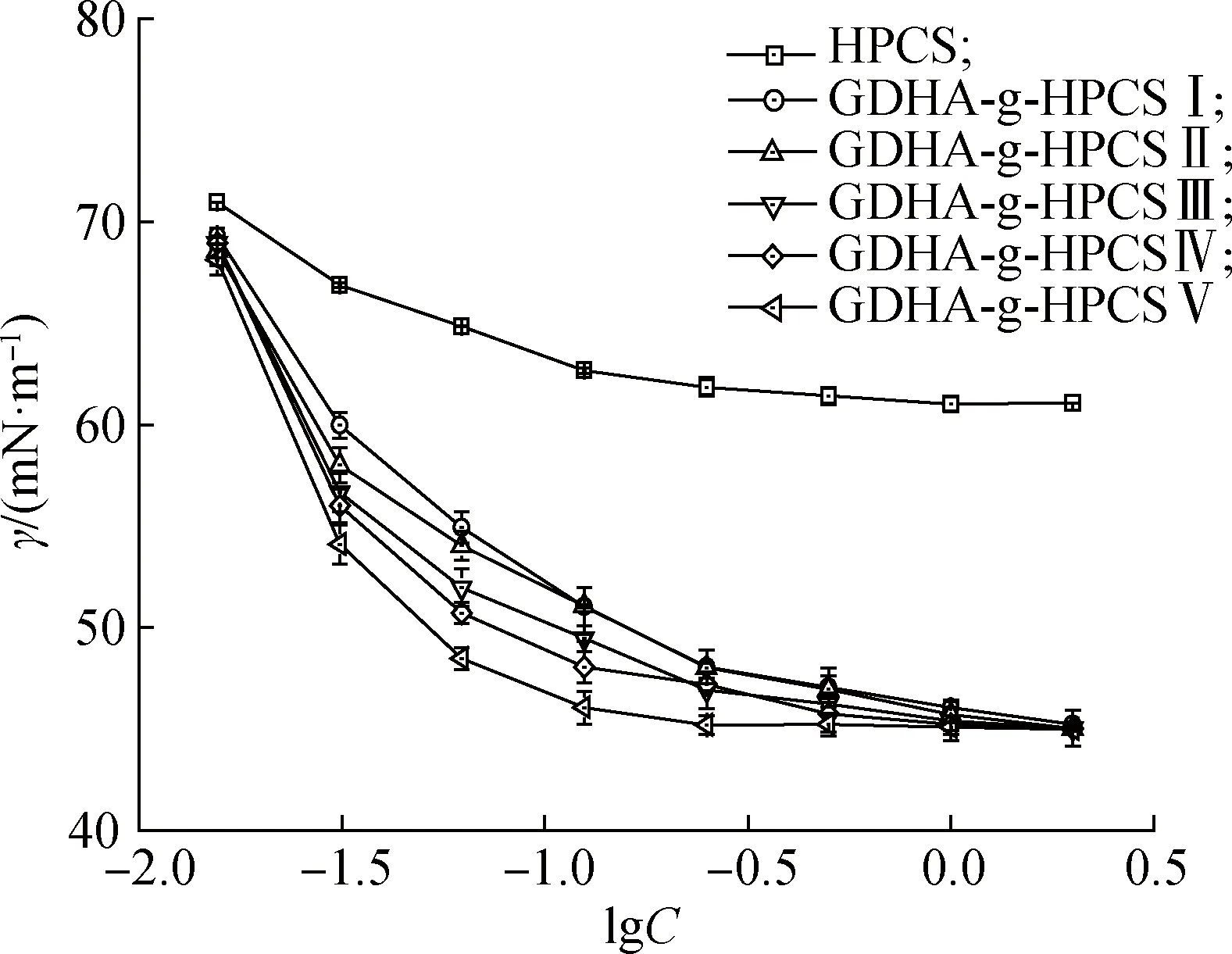
图4 GDHA-g-HPCS水溶液的γ-lgC曲线Fig.4 γ-lgC plots of GDHA-g-HPCS aqueous solution
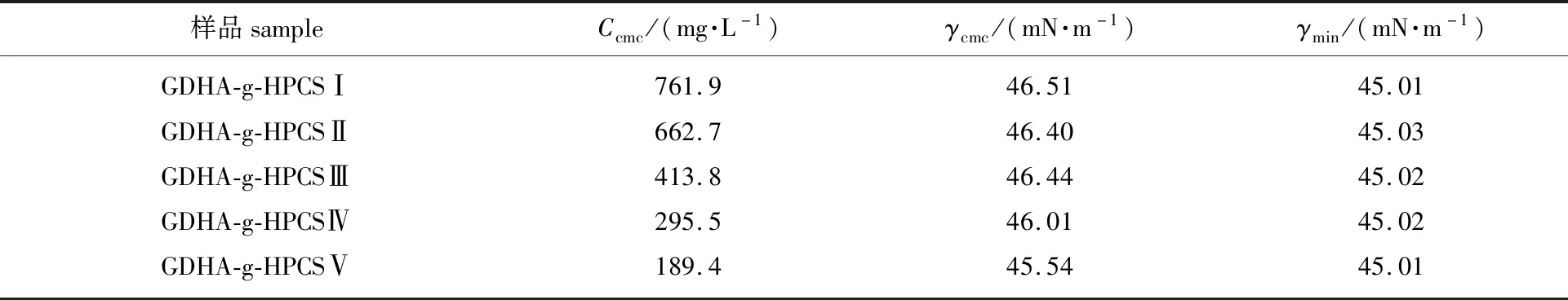
表2 不同接枝度GDHA-g-HPCS的表面活性参数Table 2 Surface activity parameters of GDHA-g-HPCS with different DG
2.3 GDHA-g-HPCS的乳化能力
GDHA-g-HPCS(Ⅰ~Ⅴ)、AEO-9、蔗糖酯及单甘酯分别作为乳化剂时形成的苯-水乳液的稳定时间分别为2 864、18 063、4 541、3 914、2 612、327、63和155 s。从乳液稳定时间可看出,不同接枝度的GDHA-g-HPCS对苯-水乳液的稳定性能均优于蔗糖酯、单甘脂和AEO-9;GDHA-g-HPCS对苯-水乳液的稳定时间随DG的增大呈现先增加后减少的趋势,并以DG为2.81%的GDHA-g-HPCSⅡ稳定时间最长(18 063 s)。这可能与DG对GDHA-g-HPCS在苯-水界面上形成的吸附层的稳定性的影响有关:DG的增大会导致GDHA-g-HPCS具有更强的亲油性,有利于其在苯-水界面吸附并有效地降低苯-水界面能;但当DG超过一定值后,接枝产物结构中亲水基团与亲油基团的分布比例失衡,不利于其按定向楔形理论在苯-水界面形成符合苯乳化所需的规整吸附层[13],导致苯-水界面膜强度减弱,从而使乳液的稳定性下降。
2.4 GDHA-g-HPCS交联物的凝胶形成时间
以壳聚糖为基础原料的水凝胶已经在组织工程、药物负载等众多领域获得应用,尤其是具有温敏特性的水凝胶[14-15]。本研究按文献[16~17]的类似方法,用倒瓶法研究了GDHA-g-HPCSⅡ以GP为交联剂形成的产物水溶液的凝胶形成过程。实验结果表明:由GP和GDHA-g-HPCSⅡ组成的混合水溶液,在低温时为具有良好流动性的微黄色澄清透明液体,但在37 ℃下恒温8 min后转化为流动性明显下降的黏稠的澄清透明物料,37 ℃下恒温20 min后转化为具有一定挂壁能力且在重力作用下可产生一定形变的半透明凝胶,37 ℃下恒温26 min后转化为挂壁和形态保持性能优良的不透明凝胶。将已经凝胶化的物料再置于4 ℃的环境中,42 min后,其又重新转化为具有流动性的微黄色澄清透明溶液。这些现象说明,GP在37 ℃下能通过离子交联使GDHA-g-HPCSⅡ水溶液形成凝胶[13],且该凝胶具有温敏特性。
3 结 论
3.1通过GDHA对水溶性HPCS的接枝改性,可以得到具有高分子表面活性剂特征的高分子化合物GDHA-g-HPCS,在GDHA对DS为110.60%的HPCS糖单元物质的量比值为8时,GDHA在HPCS上的接枝度(DG)为10.54%。
3.2随着DG从0.72%增加到10.54%,GDHA-g-HPCS在水溶液中的Ccmc值从761.9 mg/L降到189.4 mg/L,而γmin基本维持在45 mN/m左右;GDHA-g-HPCS稳定苯-水乳液的时间也随DG的增大呈先增后减的趋势,DG为2.81%的GDHA-g-HPCS稳定苯-水乳液的时间为18 063 s,优于蔗糖酯、单甘脂和AEO-9作为乳化剂时对苯-水乳液的稳定时间。
3.3由GP和GDHA-g-HPCS构成的混合物水溶液,在37 ℃下经26 min后可因GP对GDHA-g-HPCS的离子交联作用而完全凝胶化,且形成的凝胶在4 ℃的环境中保存42 min后又能重新转化为具有流动性的透明溶液,表明由GP和GDHA-g-HPC构成的混合水溶液具有可逆温敏特性的凝胶化行为。

