C19orf33在胰腺导管腺癌中的诊断及预后作用分析
钟慧敏 莫华倩 姜燕慧 沈婷 刘宜敏
胰腺癌(pancreatic adenocarcinoma,PAAD)是常见的恶性程度较高的消化系统肿瘤,发病率、死亡率分别位于恶性肿瘤中前10 位、第4 位[1]。手术治疗和化疗是其主要治疗手段,然而目前二者对PAAD 患者的总体生存率影响有限[2]。尽管CA19⁃9、CA125、CEA 等可作为PAAD 诊断和预后的临床标志物,但其预测准确性还有待提高[3]。因此,需要找到新的生物标志物以实现胰腺癌的早期诊断,把握胰腺癌的关键治疗时机。
C19orf33 基因是由4 个跨越约1 kbp 的外显子组成,位于HAI⁃2 基因下游的11 kbp 处[4]。研究表明,C19orf33 在多种肿瘤如卵巢癌中表达异常且与预后紧密相关[5]。但其在胰腺癌中的作用还尚未研究透彻。因此,本研究旨在通过生物信息学分析TCGA(The Cancer Genome Atlas)数据库中C19orf33 和临床相关信息,评估C19orf33 基因表达在胰腺癌中的诊断和预后价值,并对其潜在的作用机制进行探索。
1 临床资料
1.1 一般资料我们从TCGA 数据库和基因型组织表达数据库(Genotype⁃Tissue Expression,GTEx,V8 版本)中下载最新的RNA 测序数据和相应的临床病理信息(截止至2021 年1 月2 日)。患者均签署知情同意书并通过医院伦理委员会批准(2021⁃KY015)。病例排除标准:(1)“0”基因表达值;(2)临床资料不完整;(3)组织病理类型不为PAAD 的患者;(4)生存时间<1个月的患者;共纳入178例符合标准的PAAD 样本和336 例正常胰腺组织样本。为了提高筛选结果的可靠证据,我们另外从GEO(Gene Expression Omnibus)数据库下载GSE71729数据集的RNA 芯片表达和相关临床数据,包括145例肿瘤组织和46例胰腺正常组织[6]。
1.2 差异表达基因筛选R 软件deseq2 包、GEO2R 分别用于筛选TCGA⁃PAAD、GTEx 和GSE71729 数据集中胰腺癌和正常胰腺组织的差异表达的基因(differentially expressed genes,DEGs)及与C19orf33 相关的DEGs[7];R 软件ggplot2 包绘制差异表达火山图和上调及下调DEGs 的韦恩图(Venn),确定可信的DEGs。差异表达的筛选阈值为:|log2(FC)|>2&p.adjust<0.05。
1.3 生存分析采用基因表达中位数作为分组依据,Kaplan⁃Meier 法分析不同组的OS 和PFI 的预后差异,预后数据来自《Cell》的一篇文章[8]。
1.4 差异表达及ROC分析Mann⁃Whitney U 检验探索TCGA⁃PAAD、GTEx 数据集胰腺癌与正常胰腺组织及肿瘤不同T 分期亚组之间的C19orf33 表达差异,R 软件包ggplot2 绘制箱式图。受试者工作特征曲线(receiver operating characteristic curve,ROC)曲线下面积(area under the curve,AUC)预测C19orf33 表达对患者是否罹患胰腺癌和肿瘤T 分期的诊断价值。
1.5 REACTOME 和KEGG GSEA 分析参考基因集合为MSigDB(v7.4)[9]中的c2.cp.v7.2.symbols.gmt[Curated],每次分析重复1000 次,用Benjamini⁃Hochberg 方法进行P 值矫正,以标准化富集分数(normalized enrichment score,NES)>1.5,错误发现率(false discovery rate,FDR)<0.25 且p.adjust<0.05作为显著富集标准。
1.6 统计学分析所有统计学分析和可视化均使用R 软件(v.3.6.3)进行。Excel 软件(v2020)进行统计描述;χ2检验和Fisher 精确检验进行统计检验。Kaplan⁃Meier 法计算生存率;使用单因素和多因素Cox 比例风险模型进行生存分析。具有统计学意义的检验水准为P<0.05。
2 结 果
2.1 差异表达基因筛选及C19orf33 的生存分析和差异表达结果见图1。
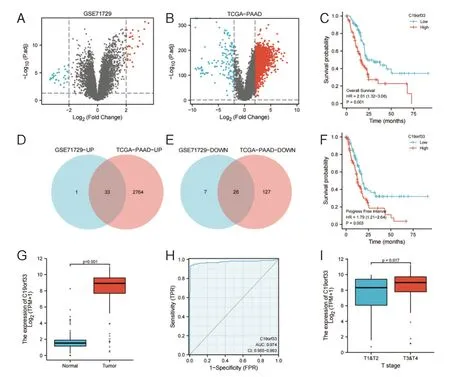
图1 差异表达基因筛选及C19orf33 的生存分析和差异表达结果
2.2 C19orf33 是胰腺癌OS 相关的独立预后危险因素见表1。
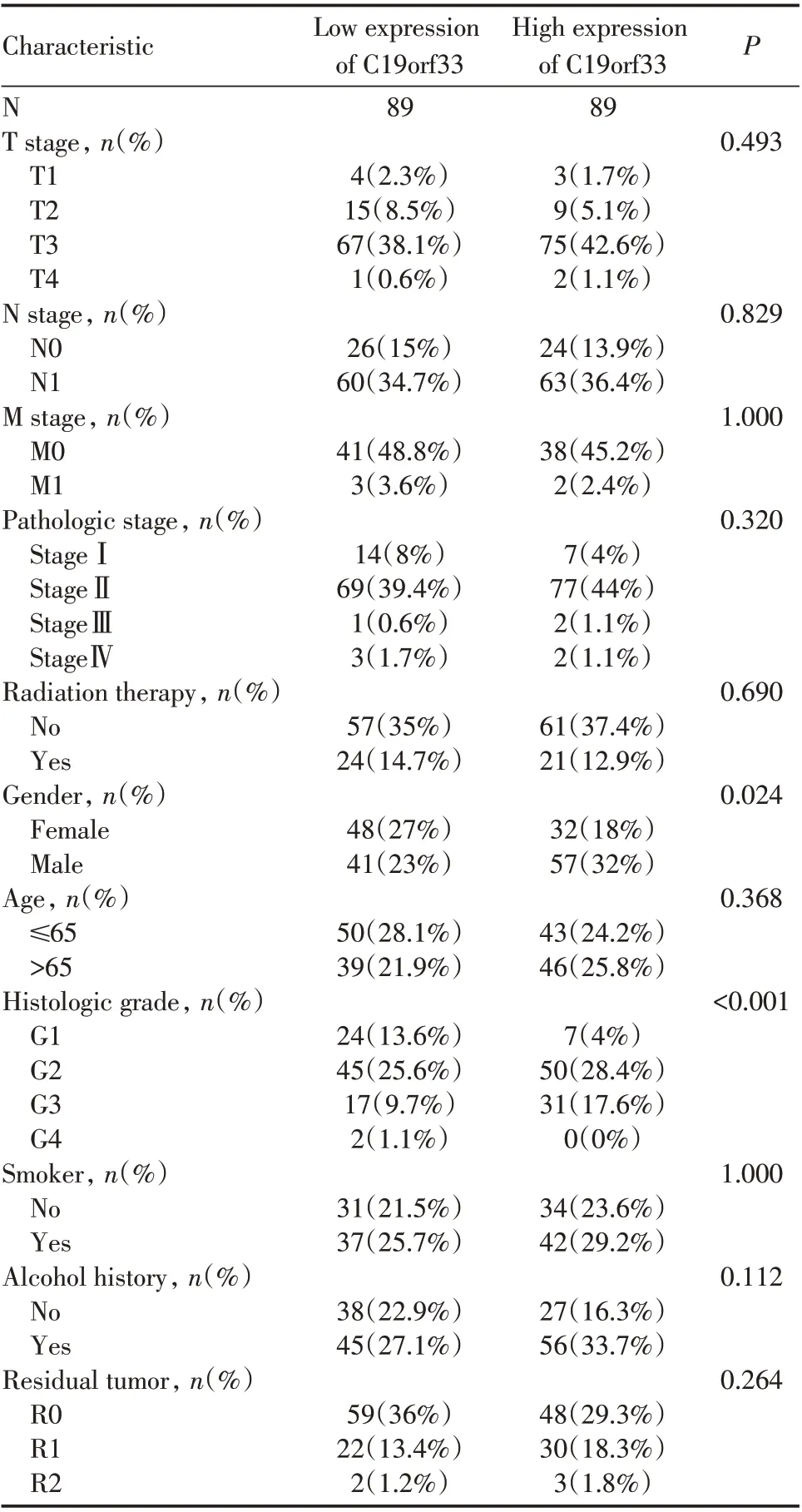
表1 胰腺癌患者C19orf33 相关的基线资料表
2.3 胰腺癌患者中基于C19orf33 表达水平的REACTOME 和KEGG 功能富集分析见图2。
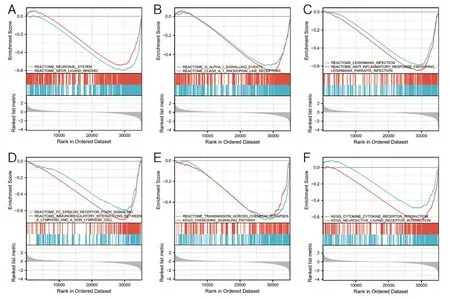
图2 REACTOME 和KEGG GSEA 分析胰腺癌中C19orf33 高、低表达组DEGs 富集的功能和通路
3 讨 论
胰腺癌是常见的消化系统恶性肿瘤,易发生转移,预后极差,且当前治疗手段对PAAD 患者的总体生存率影响有限。研究表明C19orf33 高表达与多种肿瘤的预后较差紧密相关。然而,C19orf33在PAAD 中的临床意义、作用和分子机制仍不明确,因此C19orf33 在胰腺癌肿瘤发生发展中的确切作用值得进一步研究。
在这项研究中,我们筛选发现C19orf33 在PAAD 中具有差异表达,进一步地,我们发现C19orf33 表达水平与PAAD 患者的总生存率及无进展间期呈负相关(P均<0.05),同时,ROC 曲线分析也证实C19orf33 表达可作为胰腺癌理想的诊断生物标志物。与我们研究结果相似,研究发现在乳头肾细胞癌、结直肠癌[10]中,C19orf33 高表达,且与其预后差相关。这表明C19orf33 可作为恶性肿瘤患者的预后预测标志物。然而其具体相关作用机制尚不明确。
有研究表明C19orf33 可分别通过调节上皮⁃间充质转化或与Hippo 通路YAP1 协调作用进而抑制乳腺癌细胞系或甲状腺乳头状癌细胞的进展[11]。本研究中,我们也发现C19orf33 在神经活性配体和受体间相互作用、趋化因子信号通路等多个信号通路上聚集,由此可见,C19orf33 在免疫相关的生物学过程中发挥着一定作用。但是C19orf33 与这些通路之间的确切相互作用关系还有待进一步的实验验证。
综合上述分析,C19orf33 不仅对胰腺癌患者的疾病状态具有诊断价值,而且是胰腺癌的独立预后危险因素,但尚需开展更多的实验来进一步验证。

