心脏术后静脉-动脉体外膜氧合辅助患者血管并发症对预后的影响及危险因素分析
徐 博,蔡 彤,李呈龙,杜中涛,杨 峰,崔永超,邢智辰,辛 萌,王鹏程,江春景,贾 明,王 红,侯晓彤
静脉-动脉体外膜氧合(veno-arterial extracorporeal membrane oxygenation, V-A ECMO)是在心脏术后心源性休克(postcardiotomy cardiogenic shock,PCS)患者中广泛应用的一种临时经皮机械循环辅助装置。 部分患者经过V-A ECMO 辅助过渡到自身心功能恢复或接受更高级别心室辅助装置植入,为后续治疗提供时间[1]。 成功置管是V-A ECMO患者预后良好的基础,常用置管方式包括股动静脉经皮穿刺置管和外科切开置管[2-3]。 股动脉置管相关的血管并发症是V-A ECMO 最常见、且最严重的并发症之一,包括V-A ECMO 置管侧远端肢体缺血和出血[4-5]。 常规放置股动脉远端灌注管可以有效防止肢体远端缺血,但仍有部分患者出现下肢缺血需要外科处理,并影响到患者的预后[6-8]。 V-A ECMO 插管相关出血虽不及肢体远端缺血危及生命,但发生率较高,给V-A ECMO 患者的管理造成困难。 本研究对接受V-A ECMO 辅助的心脏术后心源性休克患者血管并发症的发生情况进行分析,以评估血管并发症发生的危险因素以及对患者预后的影响。
1 资料与方法
1.1 临床资料 本研究为单中心回顾性研究,纳入2017 年1 月至2020 年12 月接受股静脉-股动静(V-A) ECMO 辅助的331 名成人PCS 患者。 对于不能脱离心肺转流(cardiopulmonary bypass, CPB)的患者在术中建立ECMO 辅助,撤离CPB 后返回ICU。 术后发生难治性室性心律失常、进行性心脏功能衰竭或特发性心脏骤停的患者多于ICU建立ECMO 辅助,或由普通病房建立ECMO 辅助后转入ICU。
PCS 的临床标准包括: 在正性肌力药、磷酸二酯酶抑制剂或主动脉内球囊反搏(intra-aortic balloon pump,IABP) 的支持下,收缩压小于80 mmHg,中心静脉压大于12 mmHg 且进行性升高,终末期器官衰竭[尿量小于0.5 ml/(kg·h)] 并出现代谢性酸中毒(pH 小于7.3,血清乳酸浓度大于3.0 mmol/L)。
1.2 ECMO 管理方法 V-A ECMO 插管由经过严格训练的ECMO 团队成员完成。 插管采用切开直视或经皮穿刺技术置入。 使用改良Seldinger 技术完成股动静脉插管及远端灌注管的置入,股静脉插管选用Bio-Medicus 19 Fr 或21 Fr 插管,尖端放置于右心房水平。 股动脉插管选用Bio-Medicus 15 Fr或17 Fr 插管。 患者的股动脉插管远端利用超声引导技术或直视下切开置入6 Fr 远端灌注插管以保证插管同侧远端肢体灌注。
ECMO 运转后,调整ECMO 流量,使混合静脉血氧饱和度(SvO2)维持在75%以上。 患者插管前应用肝素(0.5 mg/kg),ECMO 辅助期间,若无活动性出血,尽早给予肝素持续静脉泵入,维持活化凝血时间(activated clotting time,ACT)180 ~220 s。 若血红蛋白水平低于80 g/L,则给予输注悬红。 补充血小板使血小板数量维持在50×109/L 以上。
ECMO 撤机指征:使用小剂量正性肌力药物即可维持血流动力稳定;床旁超声心动检查结果提示心脏运动良好,左心室射血分数(left ventricular ejection fraction, LVEF)≥25%。 撤机前进行ECMO试停机试验,试停成功后拔除股动静脉插管,停止ECMO 治疗。
1.3 观察终点 血管并发症分为严重血管并发症和轻度血管并发症。 严重血管并发症定义为需要外科手术干预的ECMO 插管部位出血或ECMO 插管远端肢体缺血。 外科手术指征包括插管部位出血需要手术止血,以及下肢缺血恶化需要手术干预(血栓清除、筋膜切开术或截肢)。 需进行手术干预但因患者死亡或自动出院及转院而未进行手术干预的并发症同样记录为严重血管并发症。 轻度血管并发症只记录轻度下肢缺血病例,即ECMO 置管一侧下肢皮温凉、苍白或趾端紫绀但无需外科处理。 患者的临床预后终点为住院生存及撤机成功。 撤机成功定义为患者撤除V-A ECMO 后存活超过48 h。 其他并发症包括神经系统并发症(经CT 证实的缺血性脑卒中、出血性脑卒中及脑死亡)、高胆红素血症及合并肾替代治疗。
1.4 统计学方法 应用SPSS 26 统计学软件建立数据库并进行分析,计量资料以均数±标准差(±s)表示,计数资料以率或百分比表示。 计量资料的比较采t检验或Mann-Whitney U 检验,计数资料的比较采用卡方检验。 危险因素采用Logistic 回归分析,单因素P<0.1 的变量均纳入多因素分析。 Kaplan Meier 法绘制生存曲线并进行比较。P<0.05 具有统计学意义。
2 结 果
2.1 患者基础资料 2017 年1 月至2020 年12 月期间,本研究共纳入331 例患者,男性235 例,平均年龄(58.8±13.2)岁,接受手术类型包括冠状动脉旁路移植术(coronary artery bypass grafting,CABG)、瓣膜手术、CABG 合并瓣膜手术、主动脉手术、心脏移植、经皮冠状动脉介入治疗等。 体外心肺复苏(ECMO CPR,ECPR)50 例(15.1%),不能脱离CPB 在术中建立ECMO 212 例(64.0%)。 ECMO 脱机率、住院生存率、ECMO 辅助时间、ICU 时间、住院时间、神经系统并发症、高胆红素血症、接受肾替代治疗等具体患者资料详见表1。
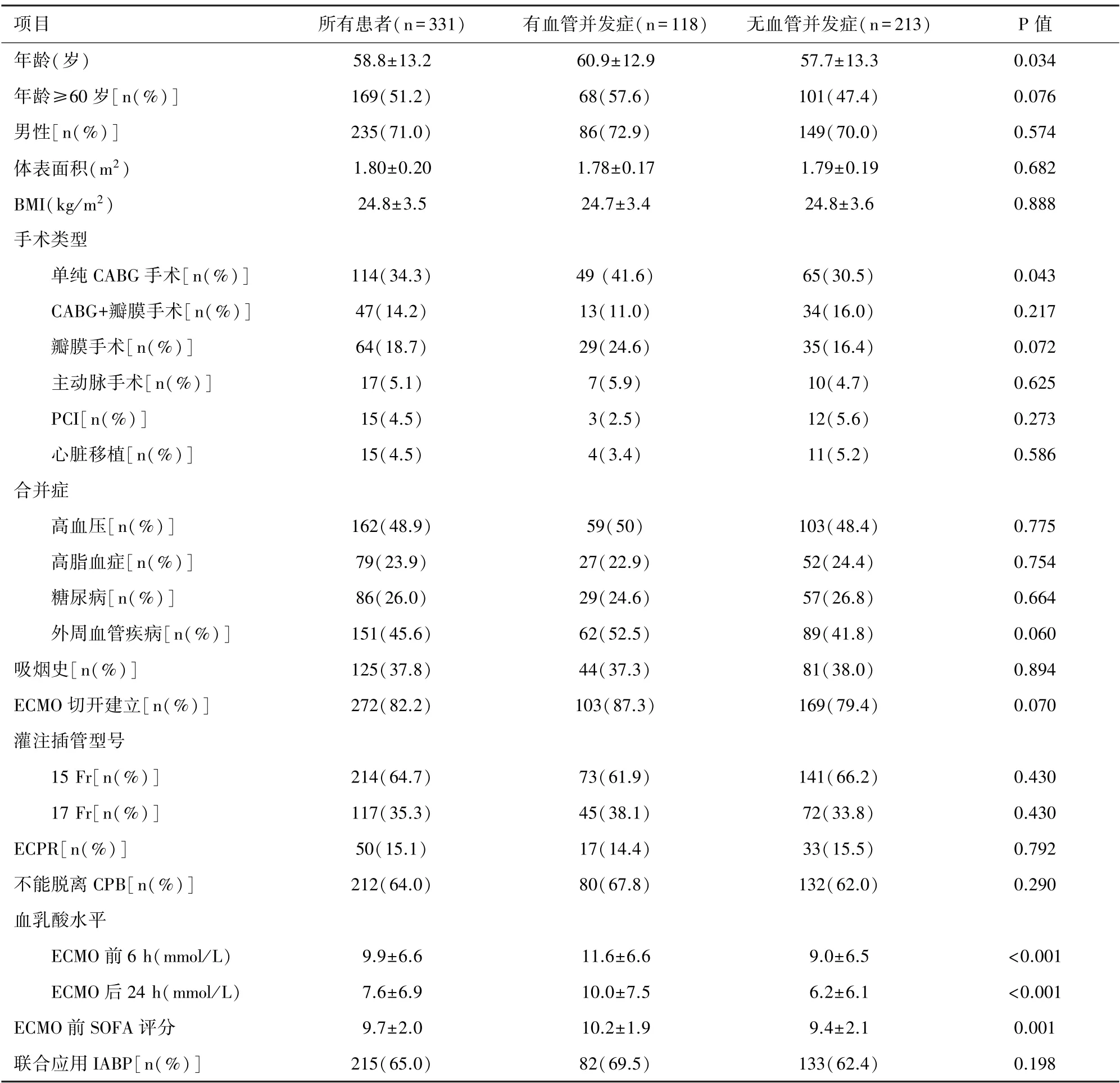
表1 患者基础资料与有、无血管并发症患者间的比较
2.2 血管并发症的危险因素分析 所有331 例患者中,118 名患者(35.6%)发生血管并发症,其中6名患者(1.8%)出现下肢缺血或插管处动脉血栓且需手术治疗,16 名患者(4.8%)插管部位出现明显的出血或血肿,需要手术探查。 其余96 名患者出现下肢缺血、发绀等症状,但无需手术治疗。ECMO 支持时间和ICU 时间无显著差异。 见表3。Kaplan-Meier 生存曲线显示无血管并发症患者的累积生存率明显优于有血管并发症的患者(P<0.05)。见图1。
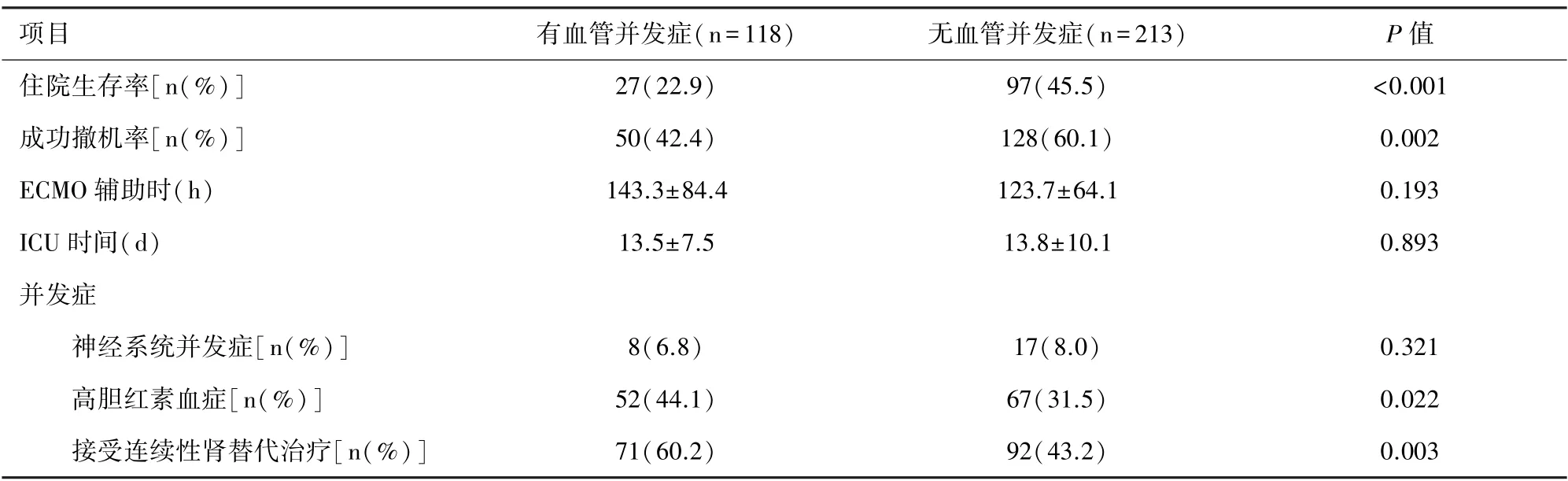
表3 行ECMO 患者血管并发症对患者预后的影响
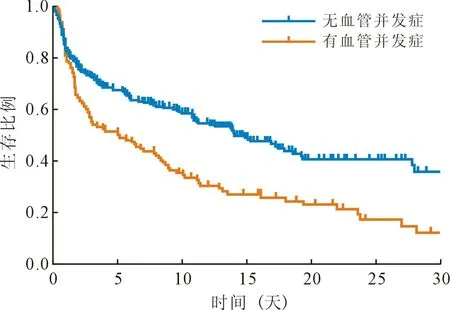
图1 两组患者的Kaplan-Meier 生存曲线
3 讨 论
ECMO 并发症是影响患者结局的重要因素,其中血管并发症相关性更高[9-10]。 有研究显示,与股动静脉V-A ECMO 相关的肢体缺血发生率为10%~70%[11-12]。 这种范围较大的发生率是由于患者基线特征、ECMO 适应证、插管技术、肢体缺血定义、监测方式、远端灌注方式和干预时间等方面的研究不同所致[9,13]。 下肢缺血可能导致筋膜腔室综合征,严重者需要筋膜切开处理,导致运动功能缺陷或截肢的风险较高,甚至最终带来致命的结果[14]。 另一种常见血管并发症是插管部位出血,根据体外生命支持组织登记数据,外周V-A ECMO 患者插管部位出血并发症发生率为18.5%[15]。 血小板计数减少、溶血、消耗性凝血病以及全身肝素化可进一步增加VA ECMO 支持期间的出血风险,导致患者输血制品量更多,严重影响了V-A ECMO 支持效果[12]。 本研究中331 例患者中,有118 名患者(35.6%)出现了血管并发症,包括下肢缺血及插管部位出血,无须进一步外科处理的血管并发症,比例相对较高。 其中需要外科处理的肢体缺血发生率为1.8%、出血为4.8%,为严重血管并发症,与先前报道的发生率基本一致。
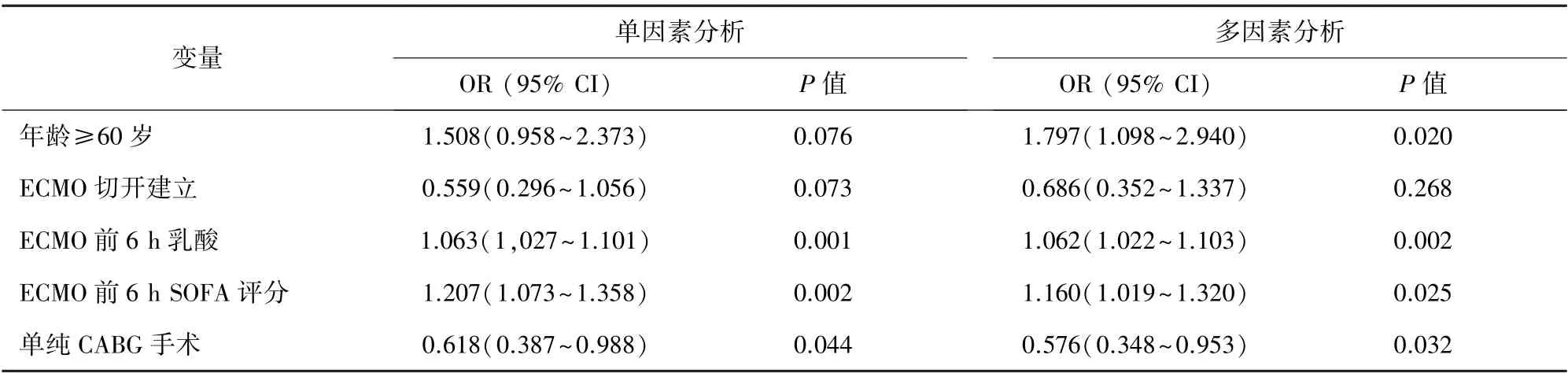
表2 行ECMO 患者发生血管并发症的危险因素分析
然而,关于血管并发症对患者预后影响仍存在争议。 本研究显示,发生血管并发症的患者ECMO 脱机率与存活率显著低于未发生血管并发症的患者,这与Tanaka 及Yang 等人的观点一致,他们证实了血管并发症和住院死亡率之间有较强的相关性[8,12]。 相比之下,Bisdas 等人研究了143 例股动脉插管V-A ECMO支持的患者,其中17 例(11.9%)出现了血管并发症,有和无血管并发症患者的早期及晚期死亡率比较无统计学差异。 除此之外,神经并发症和需要肾脏替代治疗的肾功能衰竭与不良预后相关[16-17]。
由于出现血管并发症患者具有较差的临床预后,确定其危险因素并积极预防血管并发症的发生对V-A ECMO 患者非常重要。 多因素分析显示ECMO 前6 h 血乳酸水平和SOFA 评分较高与血管并发症发生率增加有关。 血乳酸水平越高的患者临床症状更严重,远端组织灌注不足及循环不稳定在这些患者中更常见。 另一危险因素是患者年龄大于或等于60 岁,本研究通过单因素分析发现有血管并发症组患者年龄较无血管并发症组更高,这可能与高龄患者血管条件更差相关。 而原发病手术方面,单纯CABG 手术是ECMO 血管并发症的保护性因素,这可能是因为单纯CABG 手术相较于其他心脏手术类型患者病情较轻相关。 另一值得关注的是,本研究中外周动脉疾病及联合应用IABP 与下肢血管并发症的发生无关。 既往研究中对外周动脉疾病和联合应用IABP 是否是下肢缺血发生的相关因素存在争议[12,18-20]。
目前预防血管并发症是各ECMO 中心关注的核心问题之一。 在置管方式上本中心更倾向于采用经皮穿刺置管。 虽然直接切开后,血管暴露准确,可预防一些置管并发症发生,但经皮插管后穿刺口创伤小,感染和出血的发生率似乎较切开置管更低,从而减少血管并发症的发生率。 条件允许时,超声引导下穿刺甚至血管造影透视下穿刺有助于提高插管安全性。 但本研究显示,穿刺置管并不能减少下肢血管并发症的发生,这可能与本中心切开及穿刺操作经验较为丰富,并常规安置远端灌注插管相关。 VA ECMO 股动脉插管有可能阻碍下肢血流,从而减少插管部位远端血流灌注,多篇研究指出,预防性地将相对较细的远端灌注插管插入股浅动脉,增加下肢远端灌注,可降低下肢缺血发生率[10,21]。 此外,积极监测下肢灌注变化对缺血并发症的预防和早期识别起到关键作用。 护理人员及医生应至少每6 h 检查患者双侧肢体外观、皮温、是否出现发绀及花斑、坏疽等。 此外还可采用近红外光谱技术(near infrared reflectance spectroscopy, NIRS)连续监测双侧下肢氧饱和度,并进行双下肢对比。 如NIRS 提示下肢氧饱和度下降并存在缺血,应检查远端灌注管是否通畅,以排除血栓或环路打折发生。 若骨筋膜室压力上升,怀疑筋膜室综合征出现,应积极进行预防性筋膜切开术。 通过这些预防措施,更好的避免致残甚至致死性血管并发症的发生。
本研究局限性如下。 首先,本研究是一项单中心回顾性研究。 其次,本研究纳入的患者数量较少,各类严重血管并发症例数较少,因此与轻-中度的血管并发症合并分析。 第三,本研究未进行随访,未明确血管并发症对存活出院患者远期预后的影响,这需要在后续研究中完善。
4 结 论
血管并发症是接受V-A ECMO 支持的成人PCS患者中常见的并发症之一。 年龄大于或等于60 岁、ECMO 前6 h 血乳酸水平和SOFA 评分是发生血管并发症的独立危险因素,手术方式为单纯CABG 手术为血管并发症发生的独立保护性因素。 此外,血管并发症与较高的住院死亡率相关。 尽管需要更多的数据和更大的患者队列来证实本文的研究结果,但对成人PCS 患者来说,血管并发症的预防和早期识别十分重要。

