新疆单中心体外膜氧合技术治疗成人急性呼吸窘迫综合征预后的因素分析
王于强,周旺涛,通耀威,蒋晓芳,陈军仿,于湘友,宋云林
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种以低氧血症和呼吸系统力学改变为特征的呼吸衰竭综合征,包括高碳酸血症、肺动脉高压、死腔增大和肺顺应性下降[1]。 ARDS约占重症监护室(ICU)入院人数的10%[2];小潮气量通气、高呼气末正压、俯卧位通气等措施应用后,病死率仍高达46%[3]。 传统的机械通气等措施可能不足以确保血液氧合和脱羧,甚至产生呼吸机相关性肺损伤等并发症。 体外膜氧合技术(extracorporeal membrane oxygenation,ECMO)是抢救这类顽固性低氧血症、无法耐受容量限制性策略的ARDS 患者的合理有效选择[4],可使患者的循环衰竭状态和低氧血症得以快速改善,为原发病的治疗争取机会。本研究旨在分析本院ECMO 疗效与影响ECMO 治疗的危险因素,总结临床经验。
1 对象及方法
1.1 研究对象 回顾性分析2018 年1 月至2020年12 月新疆医科大学第一附属医院ICU 收治符合ECMO 上机适应证的ARDS 患者15 例,其中男性7例,女性8 例,年龄20 ~73(49.6±16.3)岁。 ARDS诊断标准以“2012 年柏林标准”为依据。 ECMO 适应证:①采用传统治疗无效(机械通气、俯卧位通气等),在吸纯氧条件下氧合指数(PaO2/FiO2)<100 mmHg(1 mmHg =0.133 kPa)超过4 h;②动脉血pH值<7.25 并伴有动脉二氧化碳分压(PaCO2)>60 mmHg 超过6 h;③机械通气时间<7 d;④传统机械通气中出现呼吸机相关肺损伤;⑤无抗凝禁忌。ECMO 禁忌证:①终末期疾病,病理生理过程不可逆;②存在中枢神经系统损害。 本研究所有患者均签署了ECMO 治疗知情同意书,所有治疗获得患者或家属的知情同意。
1.2 研究方法 回顾收集患者ECMO 过程中相关资料,包括:①一般情况:性别、年龄、体质量指数(body mass index, BMI);②术前情况:诊断、吸烟状况、基础疾病、手术史、ECMO 前有创机械通气时间、发病至应用ECMO 时间、入院至应用ECMO 时间等;③治疗前(6 h 内最差指标)及治疗后24 h 和ECMO 撤离前(撤离前24 h 内)临床资料:体温、呼吸频率、心率(heart rate, HR)、平均动脉压(MAP)、动脉血气分析、PaO2/ FiO2、急性生理与慢性健康状态评分系统Ⅱ(acute physiology and chronic health evaluationⅡ, APACHEⅡ)评分、序贯器官衰竭评估(sepsis-related organ failure assessment, SOFA)评分、血管活性肌力评分(vasoactive-inotropic score,VIS)、血常规、生化指标、炎症指标以及ECMO 参数等;④ECMO 辅助并发症情况:包括机械并发症、机体并发症等;⑤终点观察指标:住院时间、住ICU 时间、ECMO 是否成功撤离(成功撤离:撤机后存活时间≥24 h,24 h 内无再次ECMO 辅助治疗)[5]、生存情况等。 根据患者出院30 d 存活情况分为2 组:存活组和死亡组。
1.3 ECMO 治疗 ①适应证均由同一医生决定,所有患者均采用静脉-静脉(veno-venous, V-V) ECMO 模式,置管途径均选择股静脉-颈内静脉。 管道型号根据患者情况决定,选择超声引导下经皮穿刺置管,置管完成后利用X 光片确定管道位置,根据情况及治疗效果调整管路深度。 ②ECMO 设备均采用ECMO 系统套件包,包括离心泵(SORIN,英国或MAQUET Rotaflow,德国)、成人型氧合器(SORIN 或MAQUET)及其ECMO 套件管道。 ③ECMO 管理:a:镇静镇痛。 所有患者均接受丙泊酚或咪达唑仑以及舒芬太尼的联合镇静、镇痛治疗。 b:呼吸机采用肺保护性通气策略,均联合压力控制通气,可结合肌松剂及俯卧位(时间>6 h)等措施。 c:抗凝管理:持续静脉泵入肝素,监测活化凝血时间(activated clotting time,ACT),维持160 ~220 s,监测血小板计数、出血情况,动态调整抗凝要求。 ④血气分析监测氧合器膜前、膜后以及患者动脉血气,治疗期间要求膜后血气氧分压>200 mmHg,动脉血氧饱和度维持90%以上。 ⑤流量管理:根据患者监测指标来调整流量,一般维持在50~90 ml/(kg·min),膜肺的氧浓度维持80%以上。 ⑥血流动力学:维持MAP 在60 mmHg以上,如患者出现循环难以维持甚至心脏骤停时,及时更改ECMO 模式为静脉-静脉-动脉辅助模式(V-V-A ECMO )。
1.4 统计学方法 采用SPSS 26.0 统计软件进行数据分析。 符合正态分布的计量资料采用均数±标准差描述,组间比较采用t检验;非正态分布的计量资料采用中位数和四分位数间距[Q(Q1,Q3)]描述,组间比较采用Mann-Whitney U 检验;计数资料采用例(率)描述,组间比较采用卡方检验或Fisher 精确概率检验;经Mauchy 球形假设检验,数据均满足协方差矩阵球对称的多次测量数据采用重复测量的方差分析法;筛选出可能影响ECMO 预后的因素,进行受试者工作特征(receiver operating characteristic,ROC)曲线分析。 以P<0.05 为差异有统计学意义。
2 结 果
2.1 患者的一般资料及结局 撤机成功9 例(60%),存活为8 例(53.3%) ,ECMO 治疗时间为(281.4±195.5)h,住院时间(27.1±14.4)d。 病因分为:心脏外科术后ARDS 5 例(其中冠状动脉旁路移植术4 例,升主动脉置换术1 例),其射血分数43(40,45)%,VIS 28(10,114.5)分,其中1 例V-V ECMO 模式转为V-V-A ECMO。 肺源性ARDS 10例(其中病毒感染4 例,衣原体感染1 例,结核感染3 例,细菌感染2 例)。
2.2 存活组和死亡组患者的基础情况 年龄、性别、BMI、术前合并疾病(高血压、糖尿病、恶性肿瘤、脑血管意外)方面比较无明显差异(P>0.05),而治疗前是否转运(院外转运)比较,差异有统计学意义(P=0.026)。 见表1。
表1 ECMO 治疗ARDS 患者临床基础资料(±s)
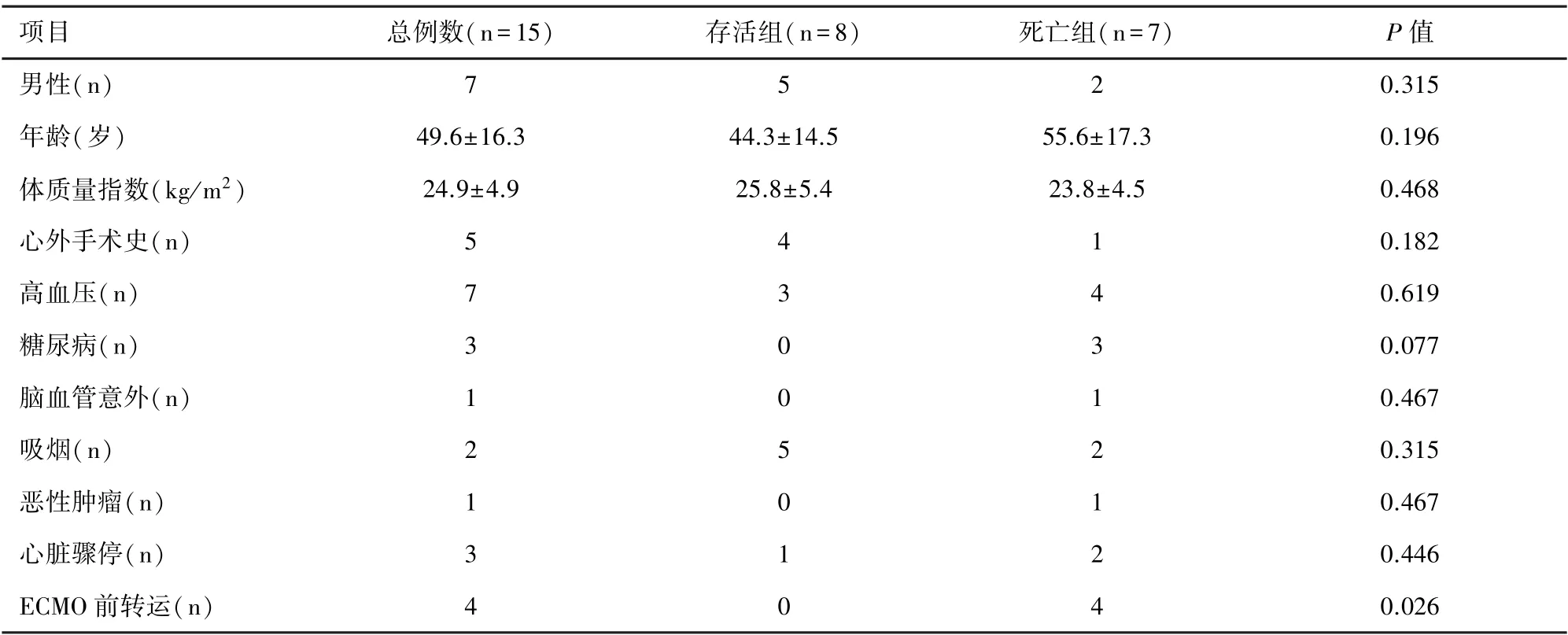
表1 ECMO 治疗ARDS 患者临床基础资料(±s)
注:P 值为存活组与死亡组比较
项目总例数(n=15)存活组(n =8)死亡组(n =7)P 值男性(n)7520.315年龄(岁)49.6±16.344.3±14.555.6±17.30.196体质量指数(kg/m2)24.9±4.925.8±5.423.8±4.50.468心外手术史(n)5410.182高血压(n)7340.619糖尿病(n)3030.077脑血管意外(n)1010.467吸烟(n)2520.315恶性肿瘤(n)1010.467心脏骤停(n)3120.446 ECMO 前转运(n)4040.026
2.3 两组间ECMO 治疗前、治疗后24 h、撤机前临床资料对比 存活组与死亡组ECMO 治疗24 h 中性粒细胞比值比较,差异有统计学意义(P=0.023);两组撤机前MAP、PaO2、PaCO2、乳酸(Lactic acid,Lac)、中性粒细胞比值、淋巴细胞比值、血小板、C 反应蛋白(C-reaction protein, CRP)、APACHEⅡ评分比较,差异有统计学意义(P<0.05);除上述指标外,其余数据比较差异无统计学意义(P>0.05)。 见表2。
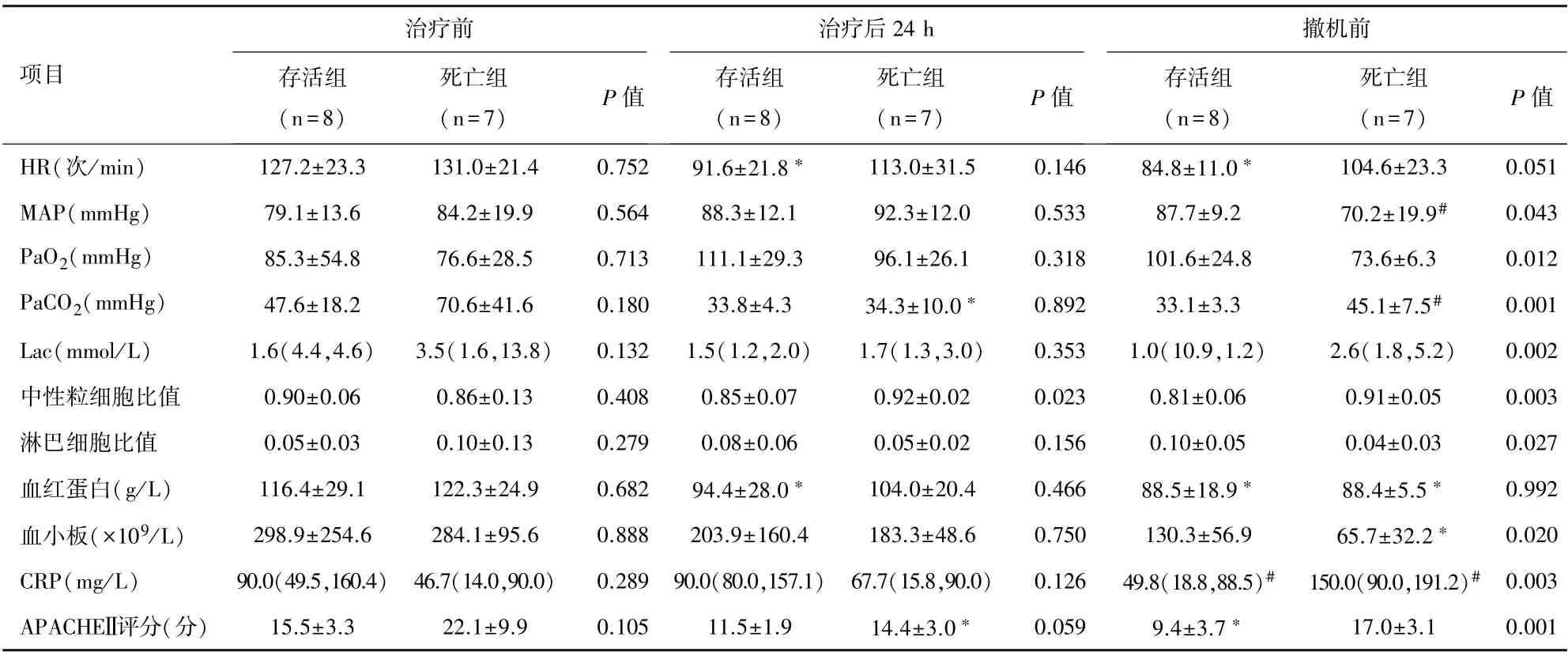
表2 ECMO 治疗两组治疗前、24 h、撤机前一般资料的比较
2.4 两组间与不同时间点的数值比较 重复测量的方差分析结果示两组Lac、白介素6(interleukin,IL-6)、SOFA 评分差异无统计学意义(P>0.05),其时间点之间差异无统计学意义(P>0.05);而HR、PaCO2、血红蛋白、血小板不同时间点间差异有统计学意义(P<0.05);两组PaO2/FiO2、APACHEⅡ评分差异有统计学意义(P<0.05),不同时间点之间差异有统计学意义(P<0.05),时间和分组间存在交互作用,两组PaO2/FiO2、APACHEⅡ评分随时间变化趋势差异有统计学意义(P<0.05)。 见表3、图1。
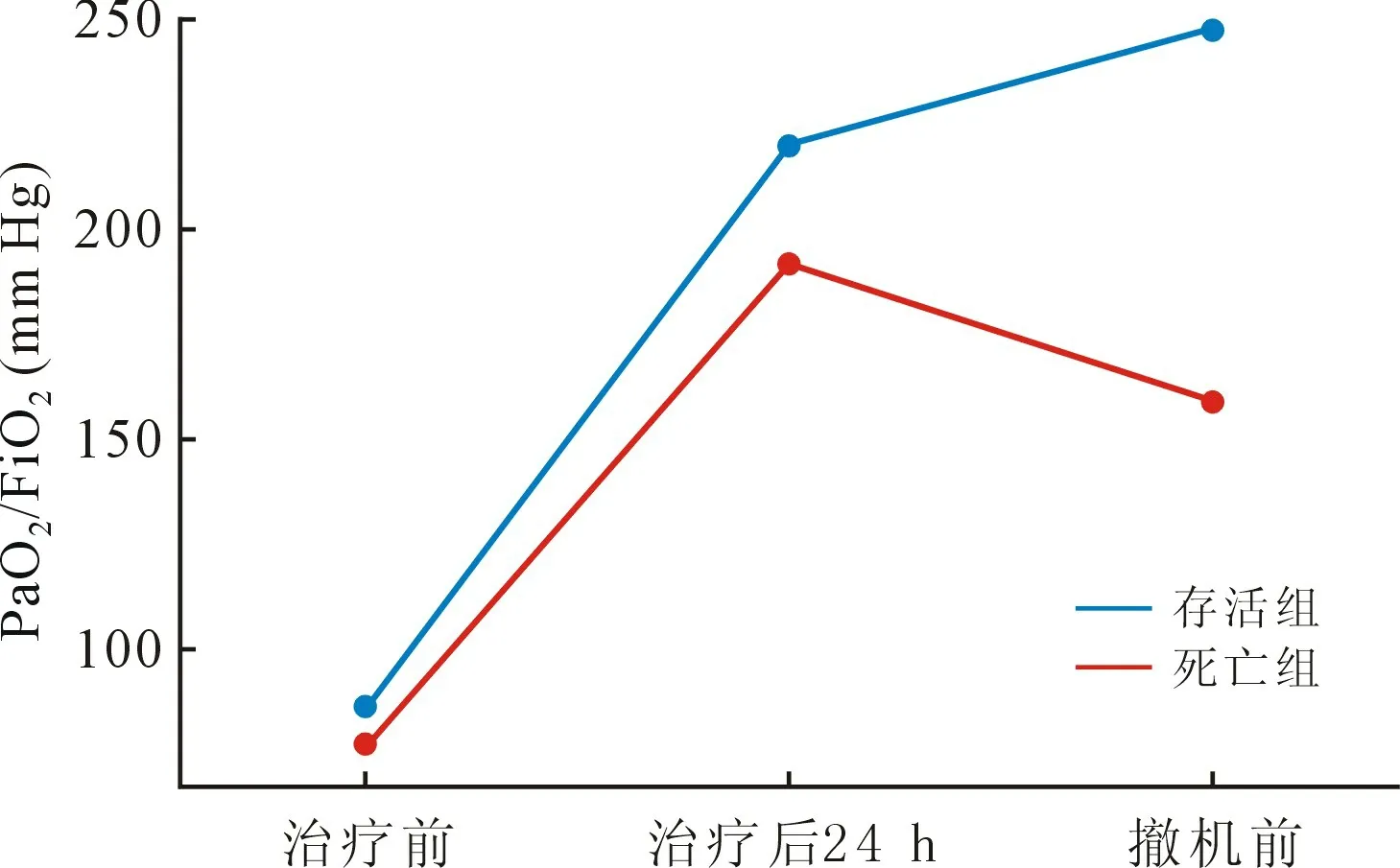
图1 ECMO 治疗时PaO2/FiO2随时间变化趋势
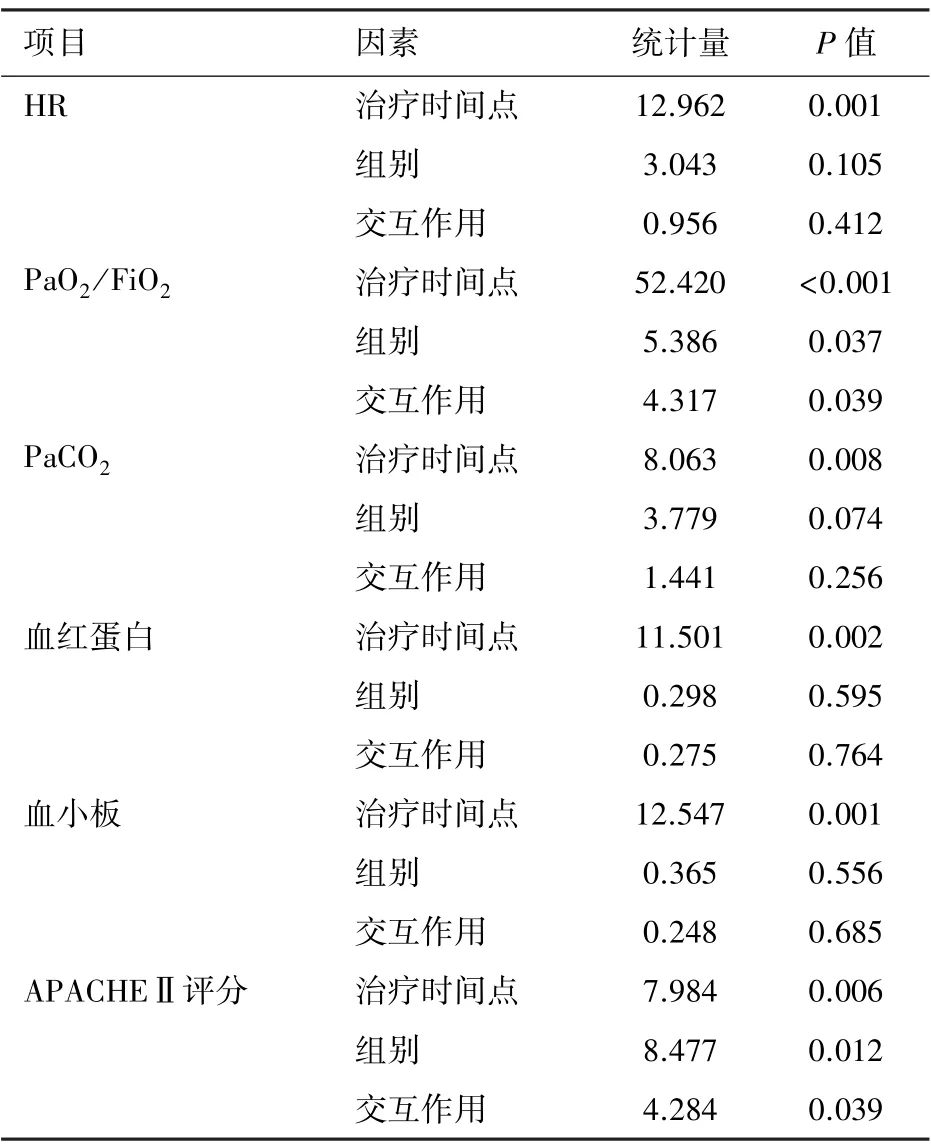
表3 ECMO 治疗时间与分组的效应分析
2.5 两组预后与并发症比较 存活组与死亡组ECMO 辅助时间、机械通气时间、住院时间、ICU 滞留时间、住院费用等差异无统计学意义(P>0.05);两组ECMO 是否成功撤机比较,差异有统计学意义(P=0.001);在并发症方面,存活组与死亡组机械并发症、脑梗死、气胸、感染、四肢缺血、是否行连续肾替代治疗(continuous renal replacement therapy,CRRT)发生情况比较,差异无统计学意义(P>0.05);死亡组出血发生情况多于存活组,差异有统计学意义(P=0.035)。 见表4。
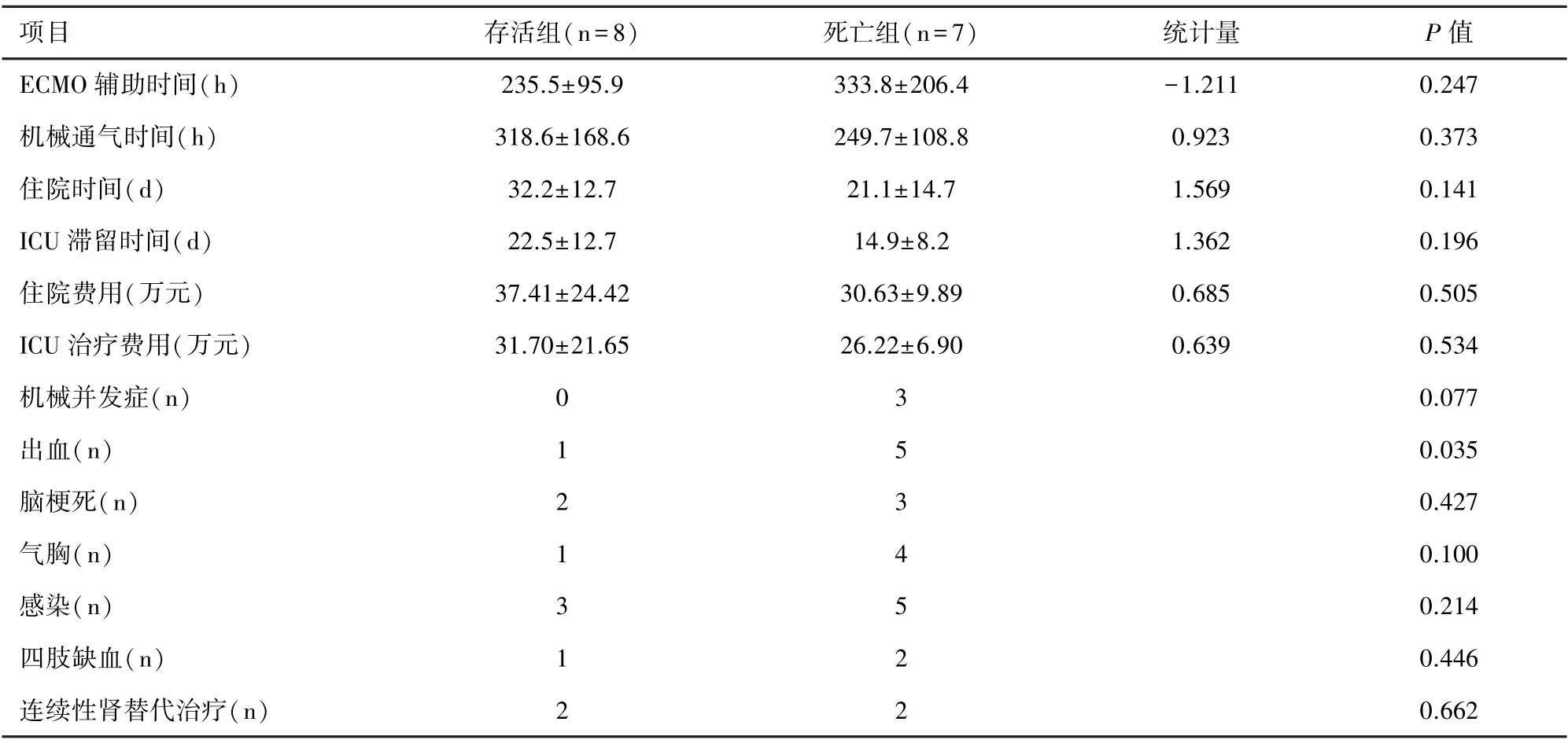
表4 ECMO 治疗患者预后与并发症数据的比较
2.6 ROC 曲线分析 将不同时间点的APACHEⅡ评分绘制成ROC 曲线,结果提示:治疗24 h、撤机前的APACHEⅡ评分均有统计学意义(P<0.05),治疗后24 h APACHEⅡ评分ROC 曲线下面积为(0.804±0.117)(95% CI:0.575 ~1.00),截断值为14.5 分,其敏感度为57.1%,特异度为99.9%;撤机前APACHEⅡ评分ROC 曲线下面积为0.938(95% CI:0.807 ~1.00),截断值为13.5 分,其敏感度为85.7%,特异度为87.5%。 见图2。
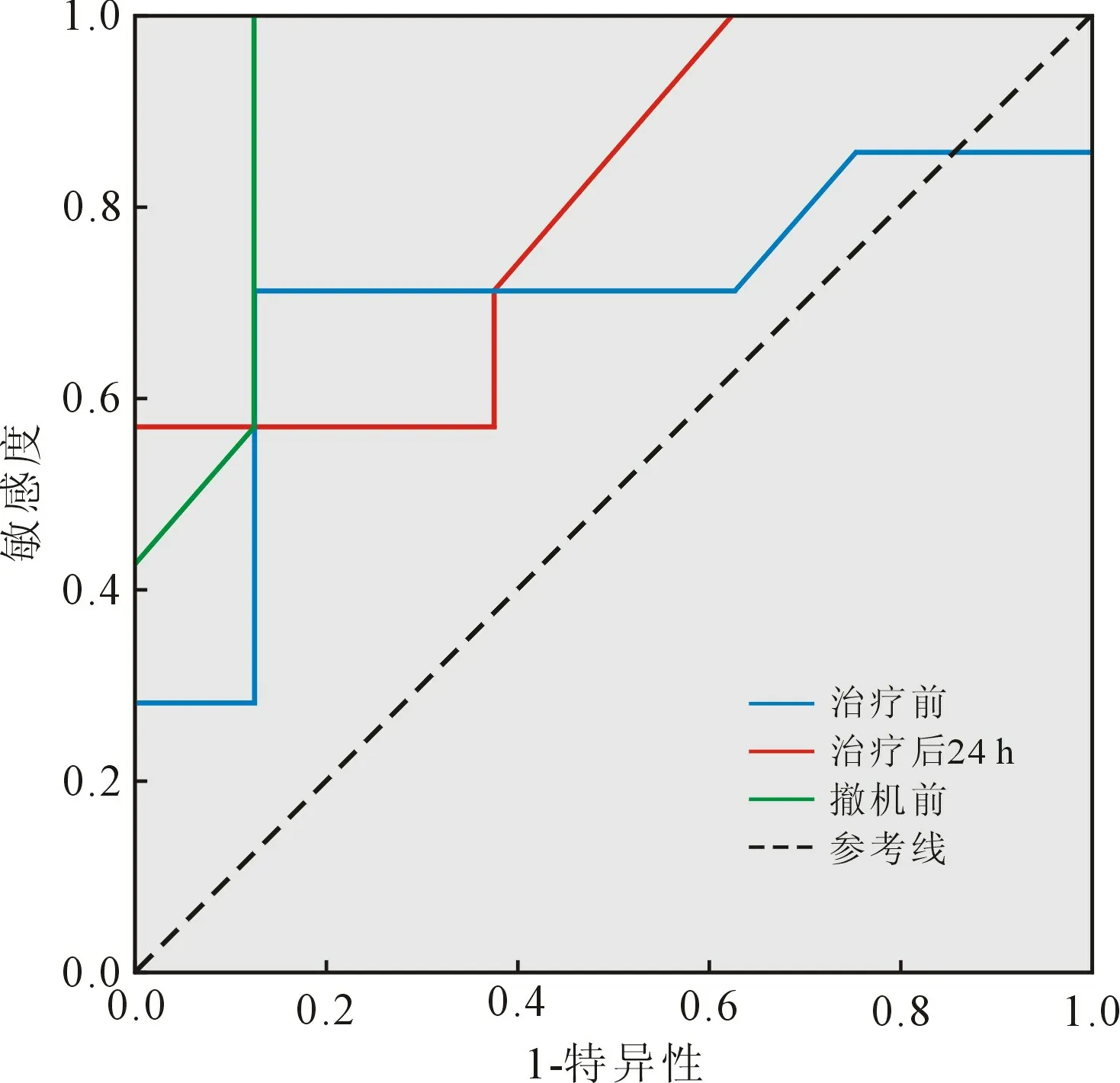
图2 ECMO 治疗ARDS 患者不同时间点APACHEⅡ评分ROC 曲线
3 讨 论
ARDS 是一种过度的肺部炎症反应,严重者可快速进展为多器官功能衰竭,造成患者死亡。 ECMO作为一种治疗重症ARDS 的重要技术,随着技术进步不断发展,应用逐渐增多并且取得不错的效果[6-7],可显著降低死亡率。 然而,目前临床上ARDS 死亡率仍较高[8],临床上可见部分重症ARDS患者接受ECMO 治疗预后不同[9],这就需要更多研究发现可能影响其预后的因素,以指导后续的研究及治疗方案;通过分析本中心ECMO 治疗ARDS 前、中、后期可能影响患者存活的因素,可为临床治疗提供一定依据。
心脏外科术后因体外循环造成的系统性炎症反应及肺部缺血再灌注损伤、吸烟等因素,可发生严重的ARDS,虽然发病率低,但死亡率极高,对这些患者应用ECMO 治疗可改善预后,本组有5 例心脏外科术后ARDS 患者应用V-V ECMO,死亡比率占20%,研究显示心脏手术后ARDS 患者的死亡率约为15%~80%[10];大多数心脏外科术后ARDS 患者因合并心功能差应用V-A ECMO,达到心肺双重辅助功能[11-12],但V-A ECMO 的并发症相比V-V ECMO更多、更严重[13],而本研究中5 例患者的射血分数及VIS 评分表明其心功能较好,故应用V-V ECMO模式,降低机械通气压力及增加冠状动脉氧供,改善心功能;当患者后期心功能恶化或难以维持时,可转换为V-V-A 模式,提供部分循环辅助功能。
本研究中,ECMO 治疗前存活组与死亡组的主要临床资料均无明显差异,但死亡组转运例数显著多于存活组;其主要原因可能与延误病情、病情较重、ECMO 上机时间延长相关;就地及时进行ECMO治疗,再转运至ECMO 中心可能会降低患者死亡率。Mikael[14]等研究发现经ECMO 转运的患者与未经ECMO 转运的患者生存率相当,且并发症的发生无明显差异。 由于新疆地广人稀,医疗资源集中在三甲型医院,本院为新疆少数率先开展ECMO 技术的医院,目前正在建立ECMO 中心、“轮辐式”医院网络,逐渐辐射周边地区,开展中远距离ECMO 转运,可能增加这类未得到及时有效救治患者的存活率。
本研究中通过比较两组3 个时间点不同指标的差异,采用重复测量的方差分析,发现两组PaO2/FiO2、PaCO2、HR、APACHEⅡ评分较治疗前明显改善,这是由于V-V ECMO 通过替代肺功能,增加氧供,排除CO2作用,纠正器官缺氧、高碳酸血症和胸腔内压升高,改善血流动力学影响[15]。 而两组血红蛋白、血小板较治疗前明显下降,这是由于ECMO 管路与动力泵产生的剪切力,严重消耗红细胞与血小板等血细胞,造成其组份改变明显,若血红蛋白及血小板严重减少,提示需要输注血制品[7]。 CRP 是一种急性时相反应蛋白,在感染时明显升高,对炎症反应有较高的灵敏度,是反映机体各种感染和非感染性炎症的较敏感的指标[16]。 死亡组撤机前CRP 明显高于存活组,提示死亡组撤机前仍存在感染,全身炎症反应未得到控制,两组中各有1 例心脏术后ARDS 患者发生感染并发症。 淋巴细胞比值减少常提示机体免疫受到抑制,当淋巴细胞百分比持续小于20%,预示病情危重[17],这就解释本研究中死亡组撤机前淋巴细胞百分比显著低于存活组的原因。其次根据图1 所示,两组PaO2/FiO2不同时间点变化趋势差异明显,且撤机前PaO2/FiO2明显低于存活组,死亡组肺功能恢复不如存活组。 这些结果提示肺部感染严重程度、治疗过程中感染控制情况以及肺自身功能恢复情况影响患者的预后。
本研究中,APACHEⅡ评分不同时间点间差异明显,两组间APACHEⅡ评分存在差异(死亡组各时间点均高于存活组),其时间点与分组的交互作用表现为存活组与死亡组APACHEⅡ评分随时间变化趋势不同,死亡组呈现“先降后增”趋势,提示APACHEⅡ评分可评价ECMO 治疗效果、预测死亡情况。 在临床中,APACHEⅡ评分作为严重ARDS 死亡率的预测方法,具有较好的敏感度[18]。 多项研究[19-20]表明APACHEⅡ评分可以较好的预测ARDS 患者应用ECMO 的死亡率。 通过ROC 曲线分析,发现治疗后24 h、撤机前APACHEⅡ评分预测患者死亡ACU 面积大(P<0.05),其中撤机前APACHEⅡ评分ACU面积最大;综上表明,APCHEⅡ评分是影响ECMO患者死亡的影响因素,可通过治疗24 h 以及撤机前APCHEⅡ评分预测患者死亡。
本研究中,死亡组出血并发症明显多于存活组,提示出血并发症是影响患者预后的因素。 接受V-V ECMO 治疗成人患者中的最常见的并发症就是出血,其中17%的患者需要外科手术干预[21]。 这是由于ECMO 治疗所需的肝素化以及血小板和凝血因子缺乏,高度容易出血。 这需要通过输注血制品、纤维蛋白原等措施纠正凝血状态[22]。 ECMO 患者的预后与ECMO 的并发症有关,为提高ECMO 患者的生存率,应积极预防及处理ECMO 相关并发症。
本研究存在的不足之处:①本研究为单中心回顾性分析样本量较少,未能做出多因素分析的结果;②本研究中存在病因为心脏外科术后ARDS,因病例数少,只进行了描述,其对结果产生的影响不明确;③研究中有部分病例因为经济原因要求放弃ECMO治疗,此类病例均被认定为死亡组,可能会对结果产生一定影响。
综上,ECMO 治疗成人ARDS 期间、治疗后24 h、撤机前APACHEⅡ评分(分别为14.5 分、13.5 分)可预测患者的预后情况;治疗前是否转运、撤机前CRP、淋巴细胞比值、出血并发症均可能是影响患者存活的因素;患者满足适应证后,应尽早应用ECMO,积极预防、处理并发症的发生,可能提高患者的生存率。

