健骨颗粒抗去卵巢大鼠骨质疏松的血清代谢组学研究
刘文静 杨娟 黄美雅,3 张楚天 孙攀 黄云梅,3*
1.福建中医药大学药学院,福建 福州 350122 2.福建中医药大学中西医结合研究院,福建 福州350122 3.福建省中西医结合老年性疾病重点实验室,福建 福州 350122
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是因机体雌激素水平下降,骨质流失增加,骨微结构破坏,易致骨折的一种代谢性疾病[1]。中医理论认为绝经后骨质疏松症的主要发病基础是机体肾亏脾虚,故临床上以补肾健脾、强筋壮骨为用药原则。健骨颗粒是临床常用经验方,由煅狗骨、淫羊藿、山茱萸、党参、山药等中药组成,具有补肾健脾、强筋壮骨之功效。前期实验[2-5]表明健骨颗粒可通过降低miR-14及CylinD1等的表达促进成骨细胞分化,通过抑制RANKL等的表达从而抑制破骨细胞形成,发挥治疗绝经后骨质疏松症的作用。
代谢组学主要研究疾病、药物效应或其他刺激反应所引起机体代谢物波动的详细情况[6]。中药方剂发挥作用通常是方剂中有效成分网络对机体疾病状态下生物分子网络调节的综合结果[7],适合以“组学”的手段进一步开展系统性的研究。本文在前期健骨颗粒实验基础上通过对大鼠血清代谢组学研究,探讨健骨颗粒对去卵巢骨质疏松大鼠的作用机理,以期为临床防治绝经后骨质疏松症提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1药材:健骨颗粒组方为煅狗骨、淫羊藿、山茱萸、山药、党参等。原药材购于福建省医药公司,由福建中医药研究院中试车间负责加工制备,每克健骨颗粒含原生药2.9 g。
1.1.2仪器:Discovery Wi双能X线骨密度仪(美国 Hologic公司);IG-A1000 N万能材料试验机(日本岛津仪器公司);Q Exact质谱仪(美国Thermo Scientific公司);UltiMate 3000高效液相系统(美国Thermo Scientific公司 );HYPERSIL GOLD AQ色谱柱(100 mm × 2.1 mm,1.9 μm,美国Thermo Scientific公司)。
1.1.3动物:60只3月龄SPF级雌性SD大鼠,质量(280±20)g,许可证号:SCXK(浙)2014-0001,购于浙江省实验动物中心,饲养于福建中医药大学实验动物中心鼠类实验室,环境设施为SPF级,合格证号:SYXK(闽)2014-0005。在温度 21 ℃、相对湿度 70 %~80 %、通风良好、自然光照的环境下,给予大鼠标准饲料饲养,自由进食、饮水、活动。
1.2 方法
1.2.1动物实验及样本采集:将60只雌性SD大鼠随机分为正常组、模型组和健骨颗粒组,每组20只。模型组和健骨颗粒组经腹腔注射0.3 mL/100 g 的10%水合氯醛麻醉,摘除双侧卵巢,术后每只肌注8万单位青霉素抗感染,正常组仅切除卵巢周围少量脂肪组织,其余操作同卵巢切除组。术后常规喂养一周后,健骨颗粒组大鼠按生药5.8 g/(kg·d)给予健骨颗粒药液,其余组给予等量生理盐水灌胃。分别于第6 周、12 周各取材一半,取右侧股骨、胫骨及第四腰椎进行骨密度及生物力学检测,并随机每组选4只大鼠取腹主动脉血分离血清。本次动物实验经福建中医药大学动物伦理委员会批准,并遵守所有与动物伦理使用相关机构和政府的法规。
1.2.2骨密度检测:将大鼠右侧股骨放置在带有小动物骨密度测定软件的骨密度(bone mineral density, BMD)扫描仪探头下检测,经计算机自动分析得出大鼠右侧股骨 BMD 相关数据。
1.2.3骨骼生物力学性能检验:将右侧胫骨及第四腰椎去除周围软组织,分别运用三点抗弯法和压缩法测定胫骨与腰椎的最大载荷。
1.2.4色谱及质谱检测:正离子流动相:缓冲液 A=0.1 %甲酸、水、10 mmol/L 醋酸铵;缓冲液 B=0.1 %甲酸、水、90 %乙腈,10 mmol/L 醋酸铵。负离子流动相:缓冲液 A=5 %(v/v)乙腈-10 mmol/L 醋酸铵,pH 9;缓冲液 B=90 %(v/v)乙腈-10 mmol/L 醋酸铵,pH 9。梯度洗脱:0~1 min,100 % A,0 % B;9~12 min,0 % A,0 % B;12.1~15 min,100 % A,0 % B;流速0.35 mL/min。质量控制(quanlity contral,QC)样品进行正离子扫描及负离子扫描(全扫描范围m/z 70~1 050),离子强度TOP15的母离子进行二级质谱鉴定。母离子使用HCD方法碎裂,进行二级质谱序列鉴定,获得质谱检测原始数据。
1.3 数据处理
通过Compound Discover(CD)软件进行数据提取处理,基于QC样品TIC图叠加,查看LC-MS检测系统的稳定性。通过mzCloud和综合数据库ChemSpider在线搜索鉴定化合物,Pathway Analysis数据库检索和确认差异代谢物,综合单变量统计和多变量统计分析筛选具有潜在生物学意义的差异代谢物。样品间归一化处理及样品代谢物间标准化处理后,采用正交偏最小二乘判别分析( OPLS-DA)制火山图。t检验考察代谢物组间差异的显著性,运用SPSS17.0对差异性代谢物取Log后进行单因素方差分析。通过差异代谢物的代谢通路和显著差异代谢物富集分析筛选潜在的靶标路径。
2 结果
2.1 骨密度检测结果
大鼠右侧股骨骨密度如表1所示,与正常组相比,同期模型组骨密度下降(P<0.01);与模型组相比,同期健骨颗粒组大鼠骨密度均升高(12周,P<0.01)。

表1 股骨近端骨密度检测结果Table 1 The test result of bone mineral density(g/cm2,
2.2 骨生物力学检测结果
大鼠胫骨与腰椎的最大载荷结果如表2所示。与正常组相比,同期模型组骨组织生物力学最大载荷均下降(P<0.05或P<0.01);与模型组比,同期健骨颗粒组大鼠胫骨及第四腰椎的最大载荷均升高(6周腰椎最大载荷P<0.05,12周均为P<0.01)。
表2 各组大鼠胫骨及第四腰椎最大载荷检测结果
2.3 基于LC-MS/MS平台的大鼠血清代谢组学检测
QC样品的稳定性试验考察基于HPLC-MS/MS平台正离子模式(positive ion mode,Pos)和负离子模式(negative ion mode,Neg)两种电离方式同时检测,大大提高代谢物覆盖率。QC样品TIC图叠加显示LC-MS系统稳定性结果如图1,各血清样品中的离子峰分离较明显。
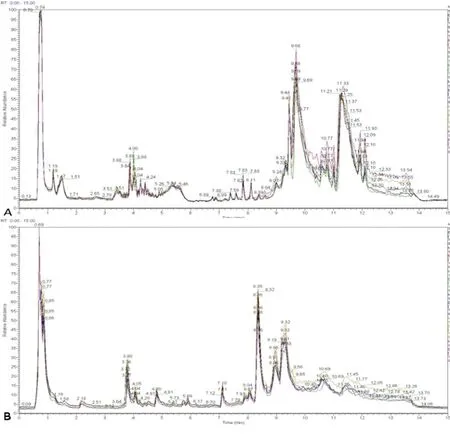
图1 大鼠血清样品TIC图Fig.1 TIC picturefrom LC-MS/MS spectra of serum注:A:正离子模式;B:负离子模式。
2.4 分层聚类分析血液数据结果
分层聚类分析所得热图(图2)直观显示出正负离子通道鉴定的所有血清代谢物在各组之间的含量变化趋势。图中水平轴和垂直轴分别代表样品与变量信息,正常组与其他各组显著分开。模型组与正常组组间差异提示去卵巢大鼠机体代谢发生变化;健骨颗粒组与模型组组间差异明显,提示中药对去卵巢大鼠的代谢有调节作用。
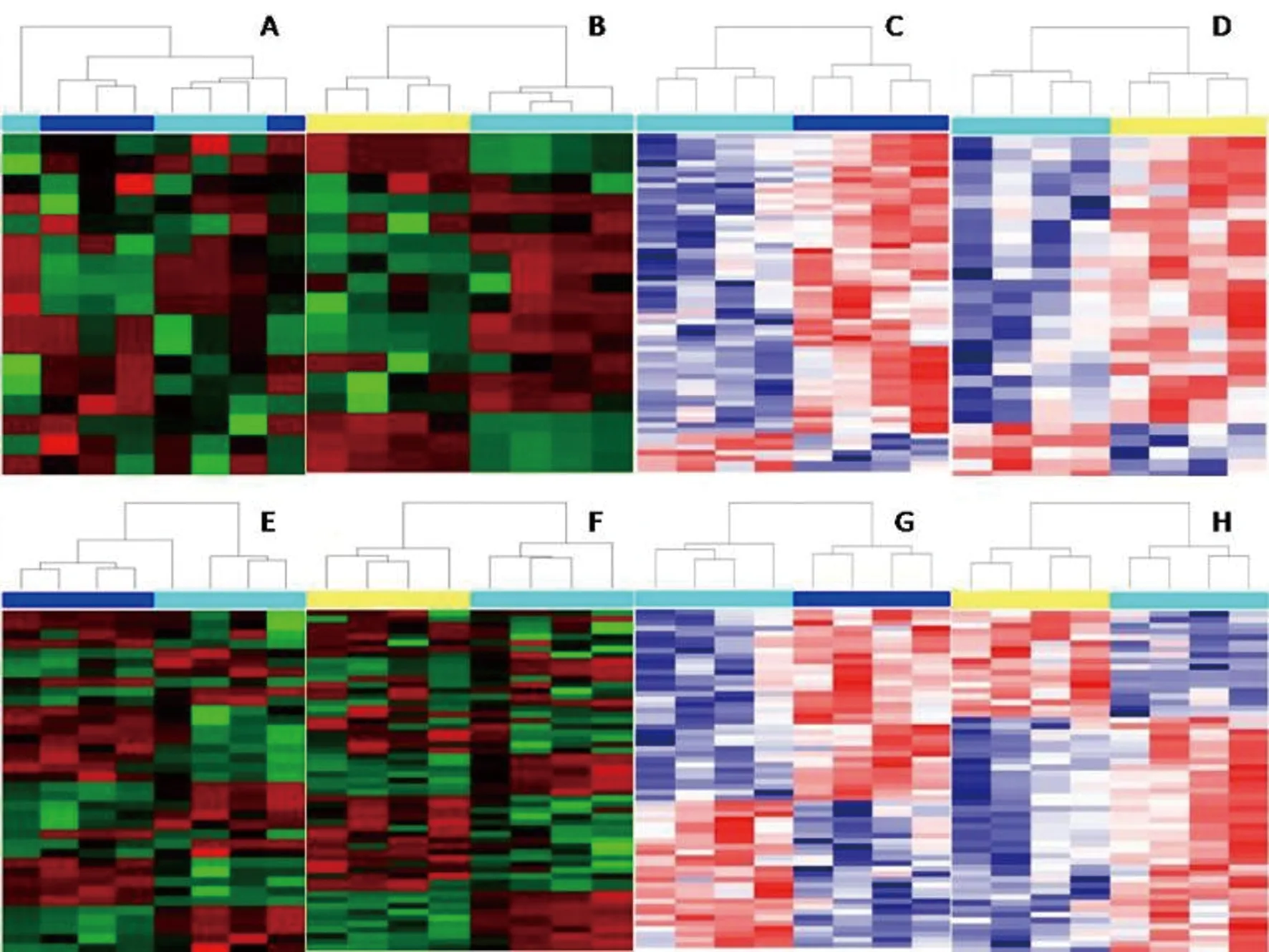
图2 分层聚类对比分析各组大鼠血清内源性物质的相关性Fig.2 Clustering result of endogenous materials of rats serum metabolites shown as heatmap注:A、E:6周正常组/模型组;B、F: 6周模型组/健骨颗粒组;C、G:12周正常组/模型组;D、H: 12周模型组/健骨颗粒组;A~D为正离子模式;E~H为负离子模式;-正常组;-模型组;-健骨颗粒组;颜色深浅反映变量值大小,红色:含量最高,绿色/蓝色:含量最低。
2.5 绝经后骨质疏松大鼠机体代谢表型的变化
正常组、模型组及健骨颗粒组组间代谢物谱差异的OPLS-DA结果如图3所示,正常组和模型组的血清样本点在PCI维可以完全分离,且各样本点在一定范围内聚集较好,说明去卵巢后骨质疏松大鼠机体生理及物质代谢情况已经发生了明显变化。采用 7 倍交叉验证法验证OPLS-DA模型可靠性,结果见表3。从生理代谢物的变化层面可认为本研究建立的模型成功,可靠性较高。

表3 OPLS-DA 模型的主要参数Table 3 Main parameters of the OPLS-DA model

图3 大鼠血清OPLS-DA得分图Fig.3 OPLS-DA score plots derived from LC-MS/MS spectra of serum注:A、E:6周正常组/模型组;B、F: 6周模型组/健骨颗粒组;C、G:12周正常组/模型组;D、H: 12周模型组/健骨颗粒组;A~D为正离子模式;E~H为负离子模式。
2.6 绝经后骨质疏松症相关潜在生物标志物的鉴定及差异代谢物分析
本研究使用OPLS-DA模型中变量重要性投影(VIP)参数评价且经t检验筛选差异性代谢物,结果见图4。经t检验筛选出27种差异代谢物作为潜在的生物标志物并进行单因素方差分析。研究发现,与正常组相比,模型组中脂质代谢及嘧啶代谢的相关代谢产物乙酰左旋肉碱、花生四稀酸、硬脂酸、胆汁酸、皮质酮及尿苷、胞嘧啶核苷、尿嘧啶等含量均下降,与模型组相比,健骨颗粒组其含量均上升;模型组中氨基酸代谢相关的缬氨酸及L-精氨酸的含量均上升,健骨颗粒组含量与模型组相比均下降(表4)。其中,16-羟基十六烷酸、硬脂酸、泛酸等组间对比差异显著(P<0.05),具体结果见图5。

表4 归一化处理血清与绝经后骨质疏松模型相关的生物标志物的信息Table 4 Normalized serum biomarker information related to postmenopausal osteoporosis model
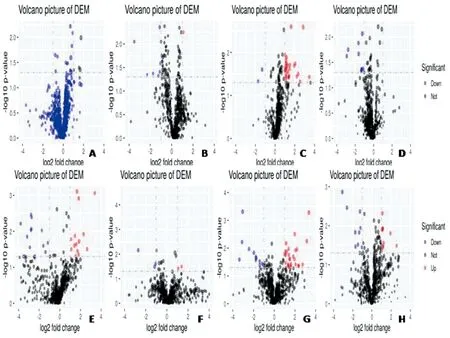
图4 差异代谢物筛选火山图Fig.4 Volcano picture of DEM about potentially different metabolites注:A、E:6周正常组/模型组;B、F: 6周模型组/健骨颗粒组;C、G:12周正常组/模型组;D、H: 12周模型组/健骨颗粒组;A~D为正离子模式;E~H为负离子模式;红色:显著上调的代谢物;蓝色:显著下调的代谢物;黑色:阈值外的代谢物。
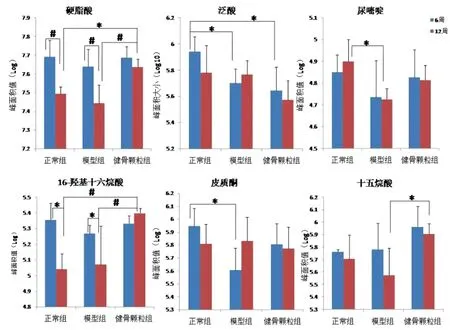
图5 具有显著差异性的代谢产物Fig.5 Metabolites with significant difference注:组间对比显著差异性,*P<0.05;组间对比显著差异性,#P<0.005。
2.7 血清中差异代谢物相关代谢通路分析
经路径分析,结合“2.6”项结果对所富集的代谢通路筛选见表5。泛酸和辅酶A、初级胆汁酸、类固醇激素及不饱和脂肪酸的生物合成、嘧啶代谢和其他次生代谢产物的生物合成影响值大于0.10,提示OPLS-DA所筛选出的差异代谢物与这些代谢途径密切相关,说明健骨颗粒发挥治疗作用与这些代谢途径有关。

表5 构建分析通路结果(Impact > 0.10)Table 5 Result from pathway analysis (Impact>0.10)
3 讨论
卵巢切除术是经典的绝经后骨质疏松症动物模型制作方法,结果显示,本次实验造模成功,药物干预后骨密度与骨生物力学指标均有所改善,表明健骨颗粒对去卵巢后骨质疏松症有治疗作用。
绝经后体内雌激素水平下降,炎性因子浓度及氧化应激标志物均升高[8-9]。动物实验表明,去卵巢后大鼠体内雌激素水平下降,从而引起代谢机制紊乱及内源性代谢物含量变化,尤其是体内脂代谢。此外,雌激素可减少胆汁酸排出[10-11],缓解蛋白消耗,调节多种炎性疾病[12-15]。代谢组学研究[16-18]发现,去卵巢后骨质疏松大鼠体内雌激素水平下降,可引起脂代谢、核酸代谢及氨基酸代谢紊乱,导致肥胖、脂肪肝、骨质疏松等一系列疾病。中药干预可调节大鼠机体的脂代谢、氨基酸代谢及核酸代谢等[19-20],使机体恢复正常。本研究结果与文献报道大体一致,去卵巢大鼠体内脂代谢、核酸代谢和氨基酸代谢异常,健骨颗粒干预后大鼠体内脂代谢、核酸代谢及氨基酸代谢得到调节,机体有恢复正常的趋势,其中脂类代谢的变化尤其显著。
脂类代谢包括脂肪酸代谢、初级胆汁酸合成、类固醇生物合成、花生四稀酸代谢、神经鞘磷脂的合成等。脂肪酸类具有抗炎功能[21-22]。胆汁酸可影响维生素D的肠道吸收,对成骨细胞有破坏作用,影响进钙、磷吸收,新骨形成及旧骨溶解,致低骨密度及骨流失,引起胆汁淤积性骨质疏松症[23-24]。与模型组相比,健骨颗粒组中这些代谢产物的含量有恢复正常的趋势,但6周胆汁酸含量变化除外。推测其因卵巢切除后体内雌激素含量下降致胆汁酸代谢增强,所以模型组胆汁酸含量明显升高。此外,乙酰左旋肉碱具有运输脂肪的能力,与正常组相比,模型组中其含量下降,与模型组相比,健骨颗粒组含量上升,表明药物干预可调节机体脂代谢。脂代谢相关物质的含量变化说明去卵巢骨质疏松大鼠机体脂代谢紊乱,健骨颗粒可通过改善脂代谢对绝经后骨质疏松起一定的干预调节作用。
本次筛选的相关代谢产物还有皮质酮、缬氨酸、泛酸、大豆苷元以及与核酸代谢相关的尿嘧啶、尿苷及胞嘧啶核苷。其中,皮质酮可诱导氧化应激,与花生四稀酸相互作用干扰正常生理行为[21],致成骨细胞凋亡增加,分化能力减弱及雌激素护骨作用降低[8,25]。缬氨酸是人体必需氨基酸之一及生糖氨基酸。其缺乏会抑制嗜中性与嗜酸性白细胞增殖[26],影响免疫功能及抑制炎症调节功能。泛酸是脂肪酸合成类固醇所必需的物质,是合成辅酶A(CoA)的重要成分,CoA参与生物体内糖类、脂肪、蛋白质的代谢[27]。大豆苷元可促进人成骨样细胞分化,使骨量增加,骨结构改善,可改善骨质疏松症状[28-29]。核酸类物质具有遗传、介导和催化生化反应、提供或转移能量等功能。其含量变化说明模型组机体核酸代谢及氨基酸代谢异常,而健骨颗粒可改善去卵巢后骨质疏松机体核酸代谢及氨基酸代谢。
综上,基于LC-MS技术的代谢组学研究发现,去卵巢后大鼠体内脂代谢、嘧啶代谢及氨基酸代谢等紊乱,健骨颗粒干预可改善其代谢情况。因此,健骨颗粒可能通过调节多种代谢通路从而改善绝经后骨质疏松症。

