CuBi2O4/CdMoO4 复合光催化材料的制备及其可见光降解性能研究
谭雪飞,邹慧君,袁 萍,张小芳,姚祖英
(四川轻化工大学,四川 自贡 643000)
随着全球经济的飞速发展,人们对能源问题和生存环境越来越关注。解决日益严重的能源枯竭和环境污染问题,是实现可持续发展、提高人们生活质量和保障国家能源安全的迫切需要[1]。最近几年,半导体光催化技术在有机污染物降解、CO2还原、医疗卫生、环境污染治理等多个领域受到广大研究者的青睐[2-3]。其中在环境治理领域,与其它传统方法相比,半导体光催化技术能够有效利用太阳能,将有机污染物直接催化降解为小分子如二氧化碳、水等,成本低廉,且不会对环境产生二次污染,因此引起了全世界科学家的广泛关注[4]。
尖晶石型化合物作为一种新型的半导体功能材料,具有窄的带隙和优异的光电化学性能,是一类极具潜力的可见光催化剂[5-6]。目前p型半导体材料CuBi2O4的电性能已得到广泛的应用,但在光催化领域的研究较少[7]。在各种半导体光催化剂中,CdMoO4具有独特的物理化学性质和较低的制备成本,同时在紫外光下具有较高的光催化活性,因此在光催化研究领域受到人们一定的关注[8-9]。但CdMoO4的禁带宽度约为3.3eV,只能在紫外光下降解有机污染物,对太阳光的利用率极低,因此研究者通过离子掺杂、贵重金属修饰等多种方法来改善CdMoO4的禁带宽度。
本文将p型半导体材料CuBi2O4与n 型半导体材料CdMoO4复合,利用 CdMoO4对电子的转移,减少CuBi2O4光生载流子的复合作用,制备了p-n 异质结可见光催化剂,进而提高了CuBi2O4的抗光腐蚀性能。制备的复合材料不仅提高了CdMoO4在可见光下的催化作用及应用范围,还延长了CuBi2O4的光催化寿命[10-11]。
1 实验部分
1.1 实验原料
五水硝酸铋、三水硝酸铜、硝酸镉、钼酸钠、无水乙醇、亚甲基蓝(均为AR)。实验用水均为去离子水。
1.2 光催化材料的制备
CuBi2O4和 CuBi2O4/CdMoO4(9∶1)的制备:按照摩尔比1∶2,量取Cu (NO3)2·3H2O 和 Bi (NO3)3·5H2O,然后将Bi (NO3)3·5H2O 加入100mL 的0.3mol·L-1冰乙酸溶液中,80℃下搅拌,使其完全溶解。将Cu(NO3)2·3H2O 水溶液逐滴加入上述溶液中,最后用3mol·L-1的NaOH 调节混合溶液的pH=14。将棕色溶液转移至100mL 不锈钢反应釜中,180℃水热反应12h。沉淀物用去离子水和无水乙醇反复清洗后,放置在烘箱中70℃恒温干燥10h,收集样品待测试。
合成CuBi2O4/CdMoO4(9∶1)复合材料:先在100mL 去离子水中加入摩尔比为1∶1 的Cd(NO3)2·4H2O 和Na2MoO4·2H2O,磁力搅拌。将制备好的0.50g 的CuBi2O4加入上述Cd2+溶液中,持续搅拌60min,使混合溶液完全分散。将分散液转移到100mL水热反应釜中,180℃下烘箱中反应12h。最终产物用去离子水和无水乙醇洗涤数次,70℃干燥10h。
采用X 射线衍射仪(XRD)对样品的晶体结构和晶粒尺寸进行表征;采用扫描电镜(SEM)对所制备样品的形貌进行测定;采用紫外可见光谱仪,在400~800nm 波长范围内,测定样品降解亚甲基蓝(MB)的紫外吸收图。
1.3 催化剂的可见光催化活性和稳定性测试
在可见光照射下,测试所制备样品对亚甲基蓝的降解效果,以此评估CuBi2O4/CdMoO4复合催化剂的光催化活性。在浓度为10mg·mL-1的亚甲基蓝溶液中,加入0.3g·L-1制备的催化剂,首先暗反应30min,使溶液达到一定的吸附-解析平衡,然后打开光源进行光催化反应。100min 内,每隔一定的时间,用移液枪移取3mL 反应溶液,高速离心后用紫外可见分光光度计测定其吸光度。反应结束后回收光催化剂,用去离子水和无水乙醇反复清洗后70℃烘干,按上述条件重复进行光催化实验,循环回收实验次数为3 次。
按式(1)计算样品对MB 的降解率A:
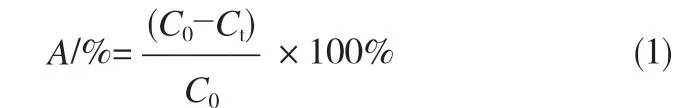
式中,C0为亚甲基蓝的初始吸光度,Ct为催化降解t 时间后亚甲基蓝的吸光度。
2 结果与讨论
2.1 XRD 分析
用XRD 对合成的光催化剂的相组成和相纯度进行了表征。由图1 可知,纯的CuBi2O4与标准卡片(JCPDF 42-0334)匹配良好。位于2θ=28.01°、30.72°、37.44°、52.97°处的衍射峰,分别对应(211)、(002)、(202)、(213)晶面,未发现多余的衍射峰[12-14],表明已成功合成了纯的CuBi2O4晶体。纯的CdMoO4样品中,各衍射峰与CdMoO4(JCPDF 85-0888)的四方相结构吻合良好。位于29.16°、31.9°、34.67°、47.87°处的衍射峰,分别对应(112)、(004)、(200)、(204)晶面[15-17]。图1 中,CuBi2O4/CdMoO4纳米复合材料的衍射峰与纯的CdMoO4和 CuBi2O4吻合良好,表明CdMoO4和CuBi2O4可共存。未发现任何明显的杂质峰存在于复合材料中,表明CuBi2O4/CdMoO4异质结光催化剂已成功制备。

图1 不同的合成光催化剂样品的X 射线衍射谱图
2.2 样品的形貌分析
用扫描电镜对所制备的样品进行形貌表征,得到纯CuBi2O4、纯CdMoO4、CuBi2O4/ CdMoO4复合材料的形貌分析结果。从图2(A)中可以看出,纯的CuBi2O4呈均匀的蝴蝶结状。如图2(B)所示,纯的CdMoO4为纳米微球,尺寸大多在0.4μm 左右。从图2(C)中可以明显观察到CdMoO4纳米微球负载在CuBi2O4上,部分CuBi2O4的形貌在复合产物中发生了断裂。对复合材料CuBi2O4/CdMoO4进行电子能谱 EDS 分析(图3),发现复合材料主要由Cu、Bi、O、Cd、Mo 等5 种元素组成,进一步证明复合材料已成功合成。

图2 不同样品的 SEM 图谱
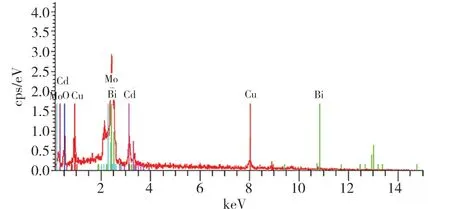
图3 CuBi2O4/CdMoO4 复合材料的EDS 图
2.3 光生电荷分离效率的测试
为了获得更多的证据支撑上述CuBi2O4/CdMoO4复合材料增强的光降解MB 活性,通过电化学工作站进行了瞬态光电流测试(I-t,图4)和电化学阻抗测试(EIS,图5)。瞬时光电流结果主要用于评估光照激发下产生的电荷载流子的寿命,以及光生电子-光生空穴对的有效分离能力。如图4 所示,CuBi2O4/CdMoO4样品的光电流信号最强,纯的CdMoO4的光电流信号最低,说明复合材料能显著提高光生电荷的分离效率。EIS 主要反映所制备样品与反应界面的电荷转移效率,弧半径越小,电阻越小,电荷之间的转移效率越高。从图5 可以看出,复合光催化剂的弧半径最小,更有利于提高光催化活性。
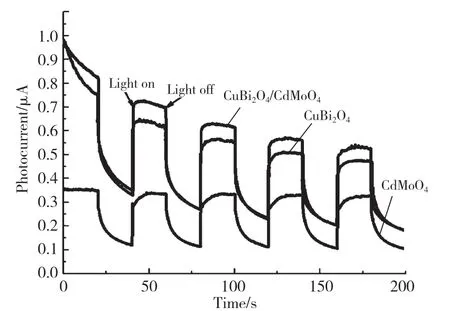
图4 瞬时光电流-时间曲线
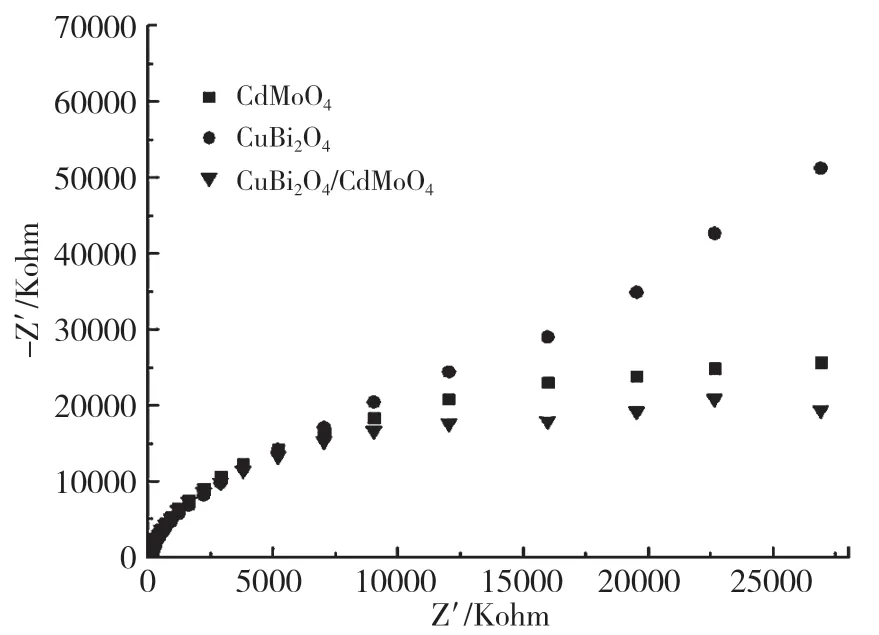
图5 电化学阻抗
2.4 光催化实验结果与讨论
图6 为复合样品CuBi2O4/CdMoO4在可见光照射下对亚甲基蓝的紫外吸收光谱图。由图可知,随着降解时间的增加,亚甲基蓝的浓度不断下降,表明制备的材料对MB 有很好的降解作用。图7 为不同催化剂的光催化实验结果,由图可知,未加催化剂样品的溶液中,亚甲基蓝不会在可见光下发生降解;暗反应30min 内,各催化剂均对染料有一定程度的吸附作用,打开光源后,不同样品的降解速度有明显区别。纯的CuBi2O4和CdMoO4的降解率远远低于复合产物,100min 内,纯的CuBi2O4降解率仅为51.20%,CdMoO4的降解率为30.12%,主要是由于CdMoO4的禁带宽度较宽,在可见光下几乎不能降解有机污染物。随着CdMoO4纳米微球负载在CuBi2O4表面,样品对亚甲基蓝的降解率升至84.53%。实验结果证明,CdMoO4的加入有效提高了CuBi2O4中光生电子和空穴对的分离率,提高了光催化降解效率。
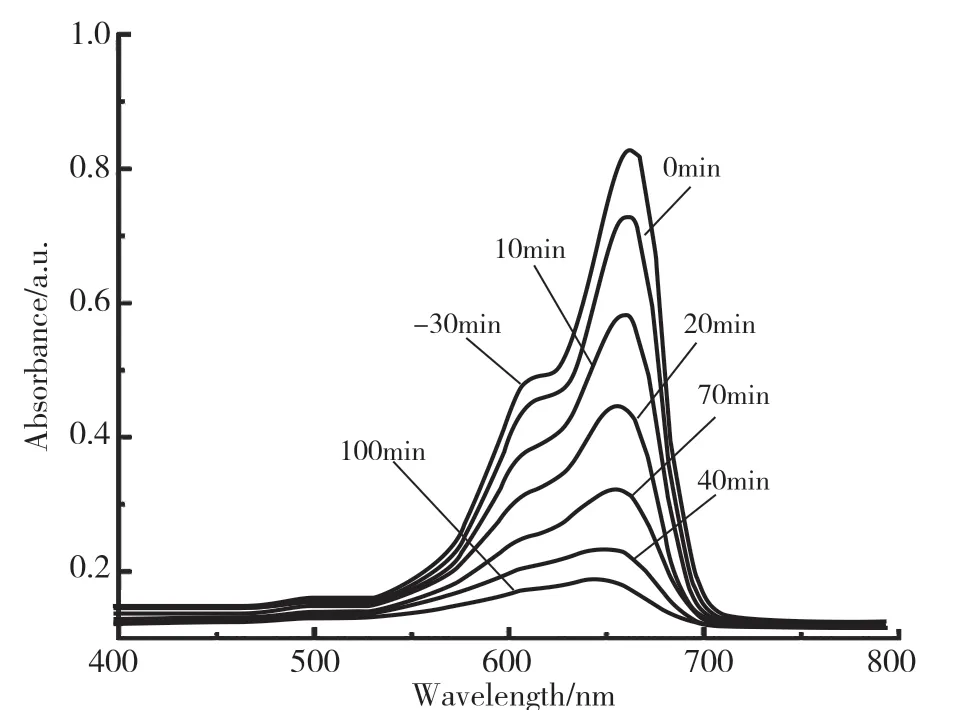
图6 CuBi2O4/ CdMoO4 对亚甲基蓝溶液的吸收光谱图
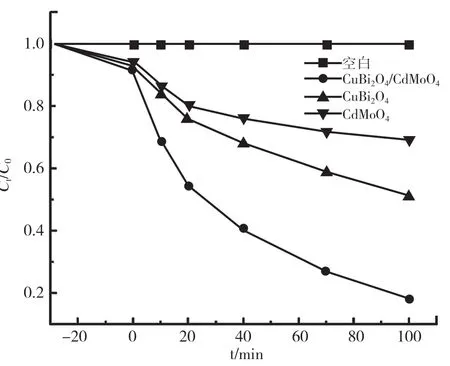
图7 各样品对亚甲基蓝的降解效果
2.5 光催化稳定性
用光催化降解亚甲基蓝的3 次循环实验来验证CuBi2O4/CdMoO4复合光催化材料的稳定性,结果如图 8 所示。在可见光照射下,3 次循环实验中,亚甲基蓝的降解率分别为 84.6%、75.2%和69.8%,与首次的降解率相比,有轻微的下降,原因是在实验过程中,催化剂在离心洗涤过程中有少量的丢失。实验结果证明,CuBi2O4/CdMoO4复合光催化材料具有较为优异的稳定性。
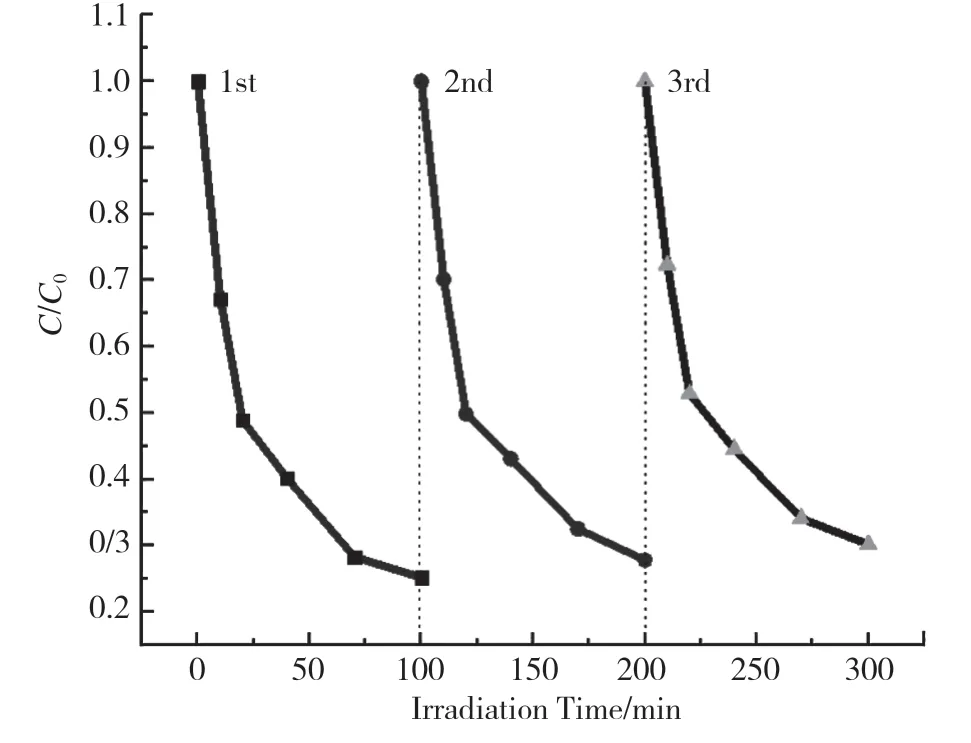
图8 CuBi2O4/ CdMoO4 循环降解亚甲基蓝的效果
3 结论
本文采用水热合成法制备了CuBi2O4/CdMoO4复合光催化剂。掺杂CdMoO4后,CuBi2O4的形貌结构未发生变化,CuBi2O4中光生电子和空穴对的复合率降低了,CdMoO4在可见光下的催化作用增强了,极大提高了其在可见光下的催化效率。采用不同的表征手段,对所制备样品的晶相结构和形貌特征等进行了表征,并在可见光下,将所制备的样品用于亚甲基蓝的降解实验。实验结果表明,CuBi2O4/CdMoO4复合光催化剂光催化降解染料的活性,远远高于纯的CuBi2O4和CdMoO4。循环回收实验结果证明,制备的复合光催化剂具有良好的稳定性。

