乳腺癌二维超声、彩色多普勒血流显像、剪切波弹性成像、造影参数联合评估与病理对照
高曼丽,蔡芹芹,包 迪,谢晴晴,刘 辉,乔 薇
南京医科大学附属宿迁第一人民医院超声医学科,江苏 宿迁223800
乳腺癌为临床常见肿瘤疾病,近年来其发病率呈明显上升趋势[1]。据报道,乳腺癌患者5 年内生存率为75%,其中临床Ⅳ期患者仅有15%的生存率[2]。乳腺癌的早期发现、早期诊断对降低其死亡率具有重要意义。随着诊疗技术的发展,超声已成为目前临床上诊断乳腺疾病重要手段,包括二维高频超声、彩色多普勒血流显像(CDFI)、剪切波弹性成像和超声造影技术。目前关于乳腺癌诊断研究,多通过单独二维或CDFI或剪切波成像或造影超声和部分二者、三者进行联合诊断,均有一定诊断价值,但关于上述超声检查技术均联合应用的研究尚无[3]。但受到乳腺肿物形态的多样性及乳腺条件限制,二维高频超声、CDFI、剪切波弹性成像、超声造影技术单独诊断在乳腺疾病中仍有不足[4]。有研究采用剪切波弹性成像技术联合超声诊断乳腺良恶性病变的特异性不到90%[5]。为进一步提高乳腺癌超声多参数诊断乳腺癌高准确性,本研究将通过乳腺癌超声多参数(二维、CDFI、剪切波弹性成像、造影)检查评估与术后病理结果对照,分析各技术诊断乳腺癌的敏感度、准确度。现报道如下。
1 资料与方法
1.1 一般资料
选择2018年4月~2020年9月我院诊治的乳腺占位性病变患者61例(72个病灶)。纳入标准:病灶为实性、囊性肿快为主;资料完整者;超声检查7 d内行手术切除进行病理检查;乳腺病灶最大径<8 cm。排除标准:纳入研究前接受治疗者;妊娠期、哺乳期女性;有乳腺手术史者;伴心、肝、肾等重要器官严重疾病者;合并其他恶性肿瘤、免疫系统疾病者;因其他疾病导致乳腺转移者;超声图像质量差者;有淋巴及远处转移者。61例患者的年龄为20~74(36.67±9.67)岁,病灶直径0.7~5.2(1.93±0.32)cm。所有患者均行二维高频超声、CDFI、剪切波弹性成像、超声造影,随后进行手术病理检查。本研究经我院伦理委员会批准,所有患者均签署知情同意书。
1.2 检查方法
超声设备采用AixPlorer彩色多普勒超声诊断仪(法国SuperSoic Imagine),L15-4线阵探头,探头频率4~15 MHz,量程0~180 kPa。
二维超声:患者取仰卧位,完全暴露乳腺及双腋窝;探头长轴与乳管长轴平行或垂直,以乳头为中心从1~12时钟位,放射状顺/逆时针连续转动扫查,同时配合纵、横、斜位扫查至乳房周边。观察肿块及周围组织二维声像图特征,包括肿块的大小、位置、形态、包膜、边缘、纵横比、内部回声、有无钙化及其周边结构是否扭曲等情况进行BI-RADS分类。判定标准:良性:肿块为椭圆形,包膜光滑,内部回声均匀或较均匀,内未见明显微钙化,后方无声影,纵横比<1,无淋巴结转移,一般BI-RADS分类<4类;恶性:圆形或不规则形,边缘不光整(边缘不清晰、成角、毛刺及小分叶等),包膜不光整、厚薄不均或无包膜,内部回声不均匀,内见微钙化,后方伴声影,纵横比>1,可伴淋巴结转移,一般BI-RADS分类≥4类。
CDFI:在二维高频超声扫查基础上,对肿块进行CDFI扫描。按Adler半定量法进行判断:0级:肿块内无血流信号;Ⅰ级:肿块内可见少量1~2个点状或细棒状的血流信号;Ⅱ级:肿块内可见3~4个点状血管或1个较长血管的中量血流信号;Ⅲ级:肿块内可见5个及以上点状血管或2个较长血管的多量血流信号。其中0、Ⅰ级为良性病灶,Ⅱ、Ⅲ级诊断为乳腺癌。
超声造影:在二维高频超声扫查基础上,对肿块进行造影扫查。造影剂:研制超声造影剂声诺维(SonoVue,意大利Bracco),注入5 mL 0.9%生理盐水轻轻摇匀配成白色乳状悬浮液,后取2.5 mL经肘静脉注射,若第一次造影不够理想,再行第二次造影。根据病灶位置,启动造影模式,扫查过程中,采用动态模式存储并记录,造影:3~6 min,后通过回放进行分析。判断标准[6]:当病灶出现:(1)肿块体积明显增大,边缘不规则,分界不清;(2)肿块周围见粗大扭曲血管进入;(3)肿块增强强度明显高于周围组织;(4)肿块内有充盈缺损区;(5)肿块内造影剂增强不均匀;(6)乳腺病灶造影后病灶组织面积较造影前明显增加(<1.7 cm的病灶造影后测量值增加3 mm以上与≥1.7 cm病灶造影后测量值增加4 mm以上为明显增加)。符合以上表现中2项及以上可诊断为恶性肿块,反之为良性肿块,一般良性肿块以均匀增强为主。
剪切波弹性成像:在二维高频超声扫查基础上,对肿块进行剪切波弹性成像模式切换,设置取样框即感兴趣区ROI,取样框为默认的矩形,可完全覆盖病灶;嘱患者屏气,静置3 s,图像稳定后冻结图像,将图像储存,通过定量分析系统测量ROI的弹性模量值,同一病灶取3个点位进行定位测量,并根据其平均值联合BI-RADS分类对病灶性质进行诊断。良性:感兴趣区内肿块表现为均匀蓝色或以蓝色为主;病灶表现:椭圆形,光滑包膜,均匀或较均匀内部回声,无或粗大钙化病灶,纵横比<1,无或少收缩期峰值流速<20 cm/s、RI<0.7 血流;SWE-Emax≤70 kPa,SWE-Emean≤30 kPa,且肿块质地软,BI-RADS分类<4类。恶性:感兴趣区ROI内肿块表现为内部以黄色、橘红色为主,周边为蓝色;病灶表现:圆形,欠光滑、分叶状,不均匀低内部回声,微钙化,纵横比>1,较丰富收缩期峰值流速>20 cm/s、RI>0.7血流,伴转移淋巴结;SWE-Emax>70 kPa,SWE-Emean>30 kPa,且肿块质地较硬,BI-RADS分类>4类[7]。
联合诊断:二维、CDFI、剪切波弹性成像、造影诊断中任何一项结果为恶性则该病例为恶性,反之为良性。
病理检查:所有患者超声检查结束7 d内进行手术切除术,将切除组织送至病理室,由2名具有高级职称病理医师采用双盲法进行病灶性质鉴定。
所有患者诊断结果以病理检查结果为最终结果。上述检查均由知晓患者年龄,但不知其他临床信息的2名乳腺疾病诊疗方向的高职称超声医师进行扫查,当2位医师诊断意见不一致时,经讨论后给出一致结果。
1.3 统计学分析
采用SPSS22.0软件对数据进行统计分析,计算二维、CDFI、剪切波弹性成像、超声造影的敏感度、特异性、准确度并进行ROC曲线分析。各技术的准确度比较行χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 病理结果
病理结果示,61例(72个病灶)中有43例恶性:51个病灶,浸润性导管癌31例(37个),导管原位癌8例(10个),浸润性腺癌4例(4个);18例良性:21个病灶,其中乳腺纤维瘤12例(14个)、腺病5例(6个)、乳头状瘤1例(1个)(图1)。
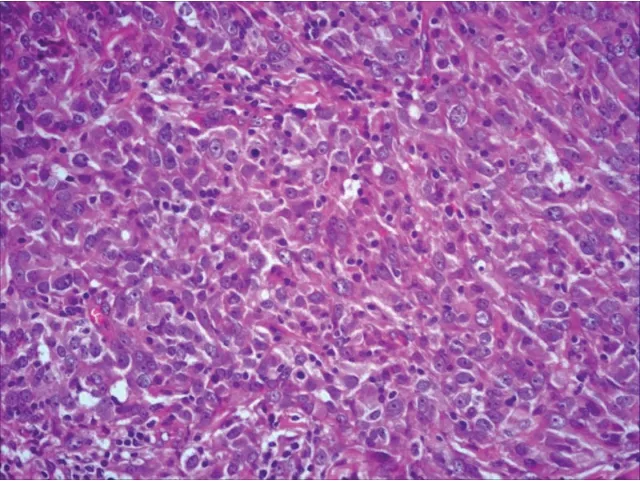
图1 某女性患者,浸润性导管癌Ⅲ级(HE,×200)Fig. 1 A female patient,grade III invasive ductal carcinoma(HE,×200).
2.2 超声图像
二维高频超声:良性肿块为椭圆形,包膜光滑,内部回声均匀或较均匀,内未见明显微钙化,后方无声影,纵横<1;恶性肿块为形态不规则,界清或不清,边缘成角及小分叶改变,内部回声不均匀,内见微钙化,后方回声轻度衰减,纵横比<1;恶性肿块(图2A)。剪切波弹性成像:良性肿块,感兴趣区ROI内肿块表现为均匀蓝色或以蓝色为主,SWE-Emax≤70 kPa,SWE-Emean≤30 kPa,且质地较软;恶性:感兴趣区ROI内肿块表现为内部以黄色、橘红色为主,周边为蓝色,分布不均匀;或中部彩色部分缺损,周边以黄色、橘红色为主,成“硬环征”、“马蹄征”、“多彩征”等,SWE-Emax>70 kPa,SWE-Emean>30 kPa,且肿块质地较硬(图2B)。CDFI:按Adler半定量法良性病灶CDFI血流信号多为0级、I级,少部分为Ⅱ级;恶性病灶多为Ⅲ级(图2C)。造影:良性病灶典型均质性增强,部分与周边乳腺组织边界不清,以周边灌注为主的弱增强,消退快速;恶性病灶表现为肿块造影后体积明显增大,中部未见增强,边缘增强,肿块整体不均匀型造影增强,多数形态不规则,消退缓慢(图2D)。

图2 同病理结果病例的二维高频超声、剪切波弹性成像、CDFI及造影图像Fig. 2 Two-dimensional high frequency ultrasound imaging,shear wave elasticity imaging,CDFI imaging and contrast-enhanced ultrasound imaging of patient with same pathologic result.
2.3 二维、CDFI、剪切波成像、造影及联合结果
二维超声诊断乳腺癌敏感度47.06%(24/51),特异性66.67%(14/21),准确度52.78%(38/72);CDFI 敏感度60.78%(31/51),特异性71.43%(15/21),准确度63.89%(46/72);剪切波成像敏感度82.35%(42/51),特异性80.95%(17/21),准确度81.94%(59/72);造影敏感度86.27%(44/51),特异性85.71%(18/21),准确度86.11%(62/72);联合敏感度94.12%(48/51),特异性90.48%(19/21),准确度93.06%(67/72)。二维、CDFI、剪切波成像、造影、联合检查的曲线下面积依次为0.569、0.661、0.817、0.860、0.923。联合诊断乳腺癌准确率高于单独二维、CDFI、剪切波成像、造影检查(χ2=31.062,P<0.05,表1、图3)。

表1 二维、CDFI、剪切波成像、造影及联合结果Tab.1 Combined examinations of two-dimensional high frequency ultrasound,CDFI,shear wave elasticity imaging and contrastenhanced ultrasound(n)

图3 二维、CDFI、剪切波成像、造影单独超声技术及联合超声多参数诊断的ROC曲线Fig. 3 ROC curves of single and combined examinations of two-dimensional high frequency ultrasound,CDFI,shear wave elasticity imaging,and contrast-enhanced ultrasound.
3 讨论
近年来,超声技术在疾病鉴别诊断中发挥重要作用,使得诊断乳腺病变的准确性提高[8]。超声技术包括二维、CDFI、剪切波弹性成像、造影等。
二维超声诊断乳腺组织的重要依据是能检测乳腺内小病灶及应用高频率探头能较大程度的提高图像质量,实现二维高频超声诊断作用;且该技术诊断乳腺疾病方便快捷、安全无辐射等优势,可较清晰显示病灶位置、形态及血流情况,从而判断肿瘤性质[9]。研究发现单独二维高频超声诊断乳腺癌敏感度和准确度约50%[10];另有研究报道,单独二维高频超声诊断价值较低,不能对病灶血管、软硬度进行评价,存在局限性[11]。有研究发现二维高频超声联合SWE诊断乳腺癌的敏感度、特异性、准确率分别为98.25%、85.92%、91.41%[12]。本文二维高频超声诊断结果与上述研究相似,且认为乳腺癌有多种特征表现,易因重叠征像致其误诊,使该技术准确性降低。
CDFI是一种通过刺激肿瘤、周围组织生成的新生血管,鉴别肿瘤血管性质的诊断技术。有学者表明,CDFI技术诊断乳腺癌患者有一定价值[13]。临床资料显示,恶性肿瘤血管在形态、功能上与良性肿瘤血管不同,可根据肿瘤血管表现诊断疾病[14]。恶性肿瘤内血管数多,血管壁较薄,多为紊乱状血管,分布不规则,管腔大小不一;而良性乳腺病灶多数无血流或少血流表现。为此,观察肿瘤内血管特点可区分其性质。Adler分级法是根据血管丰富程度的半定量法,是目前临床上“公认”的鉴别肿瘤性质的方法,恶性肿瘤以Ⅱ~Ⅲ级居多。有研究显示,CDFI敏感度约为60%,准确度约为64%[15];也有研究发现超声二维彩色多普勒联合超声剪切波弹性成像技术诊断乳腺癌的敏感性为88.5%、特异性为90.6%、准确性为94.5%[16],结论与本文相似,表明CDFI诊断乳腺癌疾病有一定价值,但准确度偏低,有待提高。可能是因该技术不能有效区分肿瘤的软硬度,而肿瘤的性质恰好与肿瘤软硬度有关。该技术诊断乳腺疾病存在局限性。
剪切波弹性成像是一种应用超声技术探测机体内部组织硬度的成像技术,与传统弹性成像性质诊断技术不同,该技术为动态弹性成像的定量诊断,对于软组织有较好的诊断作用。剪切波弹性成像技术扫查时利用超声探头向感兴趣发射声脉冲得到剪切波,形成组织弹性图,并叠加在灰阶超声图像上;通过定量分析系统测量组织弹性模量值,客观评价病灶硬度,从而实现组织弹性特征的实时量化分析。有研究发现,剪切波弹性成像技术鉴别无典型声像图特征及不同软硬度肿块的肿瘤弹性值不同[17];弹性模量值的大小可反映组织弹性大小,且其值越大,组织硬度越高[18]。既往研究报道,剪切波成像技术诊断乳腺癌敏感度约为82%,准确度约为82%[19];有学者采用剪切波弹性成像联合常规超声诊断乳腺结节的敏感度93.6%,特异性分别76.8%,准确性87.4%[20],与本研究结果相似,表明单独用剪切波成像技术诊断乳腺癌有一定价值,但其诊断准确度仍有上升空间。
超声造影技术是一种无创性评估肿瘤组织内微血管灌注情况的影像学技术。大量研究指出,超声造影可弥补彩色多普勒超声在肿瘤新生血管诊断方面的不足及实时动态显示组织、肿瘤微血管的结构、形态和分布特征的技术,且超声造影副作用极低,对重要脏器无明显的毒副作用[21-22]。为此,临床上实施超声造影前无需检测患者肝肾功能。将超声造影剂注入血液中,可通过造影剂微气泡的气-液界面增加血流信号,增加组织血流对比度,从而检测低速血管,有利于充分、清晰显示肿瘤微血管。超声造影在鉴别肿块性质过程中,根据肿瘤内部及周围血管的动态变化判断其性质,恶性肿瘤在超声造影中以肿瘤周围见粗大扭曲血管进入,肿瘤增强明显高周围组织,肿块内造影剂增强不均匀,且造影后病灶组织面积明显增加为主。有研究用超声造影诊断乳腺癌敏感度约为87%、准确度88%[23]。与本研究结果相似,表明超声造影诊断效能较高。ROC曲线是反映特异性、敏感性连续标量的综合指标,可明确试验的正确程度,为此,本文将二维高频、CDFI、剪切波弹性成像、超声造影技术行联合诊断,旨在探讨其更高诊断效能方法,结果示联合诊断乳腺癌准确率高于单独二维高频、CDFI、剪切波弹性成像、造影超声检查;表明联合诊断可提高诊断乳腺癌准确率。
综上所述,乳腺癌超声多参数(二维、CDFI、剪切波成像、造影)联合诊断可提高诊断乳腺癌准确率,从而更接近病理诊断结果。