基于金属钆-儿茶酚构建的纳米影像探针在小鼠正常器官的双模态成像
刘 杰,王玉柱
重庆北部宽仁医院放射科,重庆401121
MRI与荧光成像(FI)相结合构建的多模态影像探针是近年来无创性分子成像方法的重要研究方向之一[1-3],MRI/FI影像探针在提高单细胞敏感度和亚细胞分辨率的同时,又能实现较强的组织穿透力,有效弥补了两种成像方式的不足[4-6]。既往研究已经成功设计和评估了大量该类影像探针,如基于pH敏感或热分解的FI-MRI双峰成像探针[7-9],但多存在弛豫率低、荧光发射波长较短以及稳定性差等缺点,阻碍了该类探针的实际应用[10-12]。为解决该类探针既往研究中的不足,能够更好应用于实际,本研究通过两步反应制造了一种新型的MRI-FI探针:首先使用硝酸钆、单宁酸(TA)和聚乙烯吡咯烷酮分别作为金属、配体和粘合剂,通过受控的金属-儿茶酚配位组装工艺合成了钆-酚类配位聚合物纳米颗粒;再选择罗丹明B(RB)作为荧光基团,与配位聚合物表面共价偶联,构建最终的MRI-FI 双峰探针TAGd@RB,并进行MRI体内和FI的体内、外成像实验。现报道如下。
1 材料与方法
1.1 材料合成
双模态含钆影像探针TA-Gd@RB(由重庆大学生物材料学院研制),载Gd3+含量为8.2%,载RB含量为12.5%,临床医用DTPA-Gd购自西安瑞禧生物科技有限公司出品。TA-Gd@RB的合成示意图(图1)。

图1 TA-Gd@RB合成示意图Fig. 1 Synthetic schematic diagram of TA-Gd@RB.
1.2 荧光成像
TA-Gd@RB聚合物以20 mg/mL的浓度溶解在磷酸盐缓冲液(PBS)中。将健康雄性KM小鼠(重庆医科大学实验动物中心,20±2 g,8~10周)随机分为2组(n=5),
Assembly Attach RB尾静脉注射TA-Gd@RB 1次(注射量20 μL,20 g/kg),PBS设为对照组。在注射后0.5、1、2、4、12和24 h在小动物超灵敏荧光成像系统(VISQUEIn-vivoSmart-LF,Viewers)上进行体内以及主要器官的离体荧光成像。所有动物程序均按照《实验动物护理和使用指南》进行,并经重庆医科大学动物伦理委员会批准。
1.3 磁共振成像
TA-Gd@RB体外弛豫率测定在临床1.5 T临床磁共振扫描仪(GE SIGNA Creator)上进行。将含有不同钆浓度的TA-Gd@RB复合溶液置于试管中进行体外进行扫描,以临床DTPA-Gd作为对照组,通过它们的T1加权MR图像获取相应的1/T1值。弛豫率值(r1)是根据1/T1与Gd浓度(mmol)的曲线拟合结果的斜率计算的。
TA-Gd@RB体内MR成像研究选用10只健康雄性KM小鼠(20±2 g,8~10周),随机分为2组(n=5)。使用水合氯醛(10 wt%,80 μL)麻醉动物,通过尾静脉将50 μL TA-Gd@RB(注射剂量400 μg/mL Gd3+)溶液一次注射到动物体内,以临床DTPA-Gd作为对照组,然后在不同的注射时间后进行使用临床1.5 T磁共振扫描仪(GE SIGNA Creator)进行扫描,并获取T1 加权冠状MRI。成像参数如下:TR/TE=330/18.2ms,FOV100mm,层厚3 mm。
2 结果
2.1 MR成像
体外弛豫率图示两组T1图像的亮度随着钆离子浓度的增加而变亮,表明信号强度和浓度之间的依赖性(图2A)。与DTPA-Gd相比,TA-Gd@RB随着钆离子浓度的增加,T1图像变得更亮。随后,将弛豫时间的倒数与钆离子浓度作图,然后对所得曲线进行线性拟合后计算弛豫率r1。结果显示TA-Gd@RB的纵向弛豫率r1为6.94 mmol-1s-1,是临床DTPA-Gd的1.7倍(r1=4.09 mmol-1s-1,图2B)。
在体内成像中,将TA-Gd@RB以400 μg/mL Gd3+浓度通过尾静脉注射到小鼠体内,并以临床DTPA-Gd作为对照,在注射前和注射后1、4、8、24 h收集冠状位T1加权图像。结果显示TA-Gd@RB在1~4 h肝脏的信号逐渐增强(图2C),最大增强幅度约110%(图2D),8 h观察信号强度降低;膀胱的信号8 h内一直持续强化,24 h观察信号强度恢复至注射前水平。而注射临床DTPAGd后,肝脏在1 h内强化并达到强化峰值,4 h观察信号强度明显降低,而膀胱信号强度则在8 h恢复至注射前水平。肝脏和膀胱的MRI增强效果和成像时间明显不如TA-Gd@RB(图2E~F)。TA-Gd@RB在肝和膀胱能达到更好的增强效果,成像窗口时间也更长。

图2 MR成像结果Fig. 2 Results of magnetic resonance imaging.
2.2 荧光成像
在小动物活体成像系统上评估了小鼠的FL成像性能。对照组整只小鼠均未发现荧光信号(图3A)。而实验组在注射后0.5、1 h,能够清晰地观察到小鼠全身明亮的荧光,具有良好的信噪比(图3B~G)。荧光成像信号在注射后1 h 达到峰值,然后随着时间的增加开始下降,12 h后荧光信号变得非常微弱,24 h后在小鼠体内完全消失。
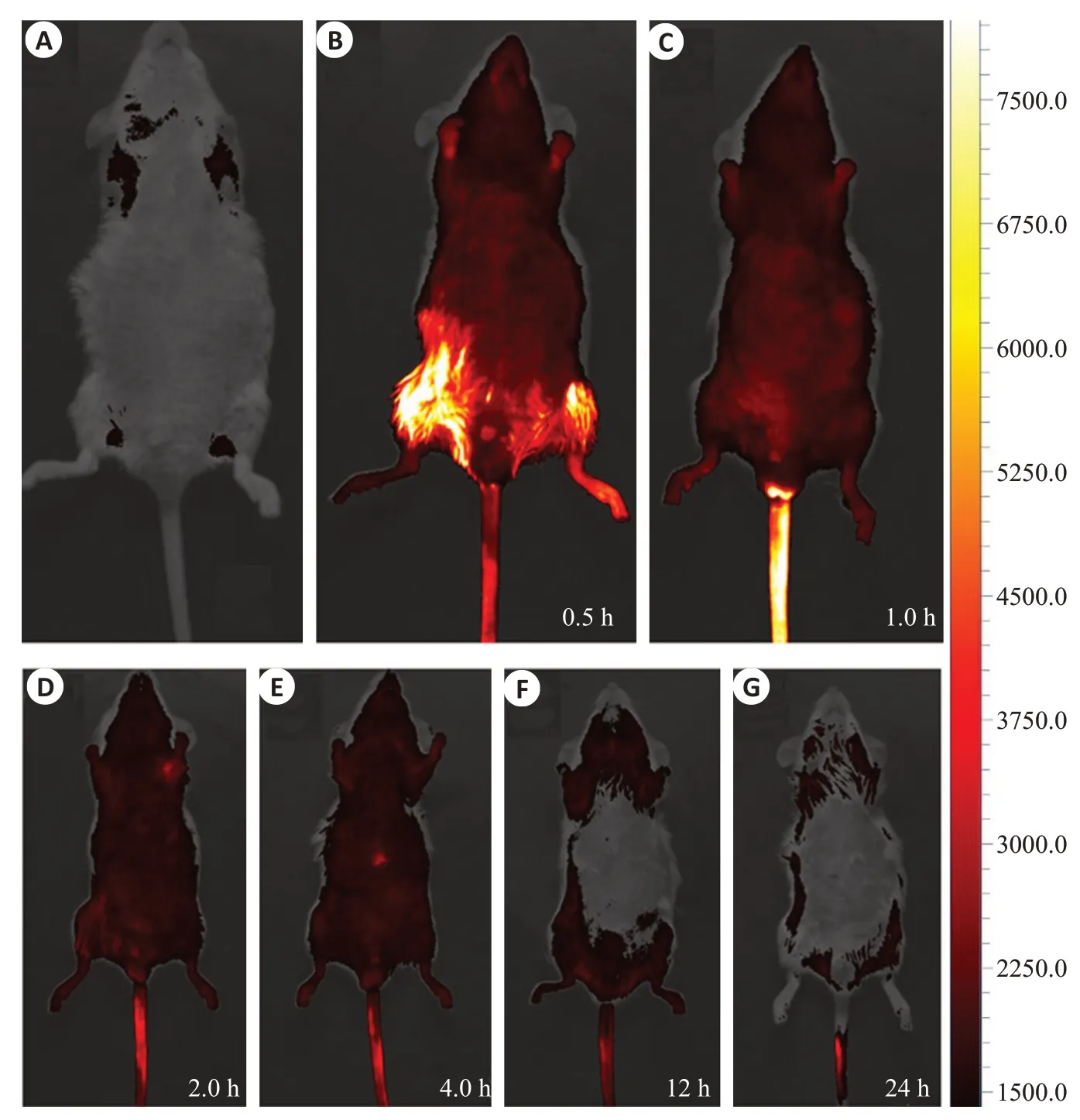
图3 在不同时间点静脉注射TA-Gd@RB的小鼠体内荧光成像Fig. 3 In vivo fluorescence imaging of mice with intravenous injection of the TA-Gd@RB at different time points.
然后,在不同时间点采集主要器官的离体荧光图像,以探索TA-Gd@RB复合材料的生物分布和排泄途径。选择大脑、肾脏、肝脏、心脏、胃、肺、脾脏、睾丸和肠作为解剖器官。肝、脾、胃、睾丸和肠的荧光信号总是比脑、肺、心脏和脾脏的荧光信号强得多,脑和肺的信号在3 h后消失,肾、肝、胃、睾丸和肠器官的信号在24 h后消失,这与全身荧光成像是一致的(图4)。
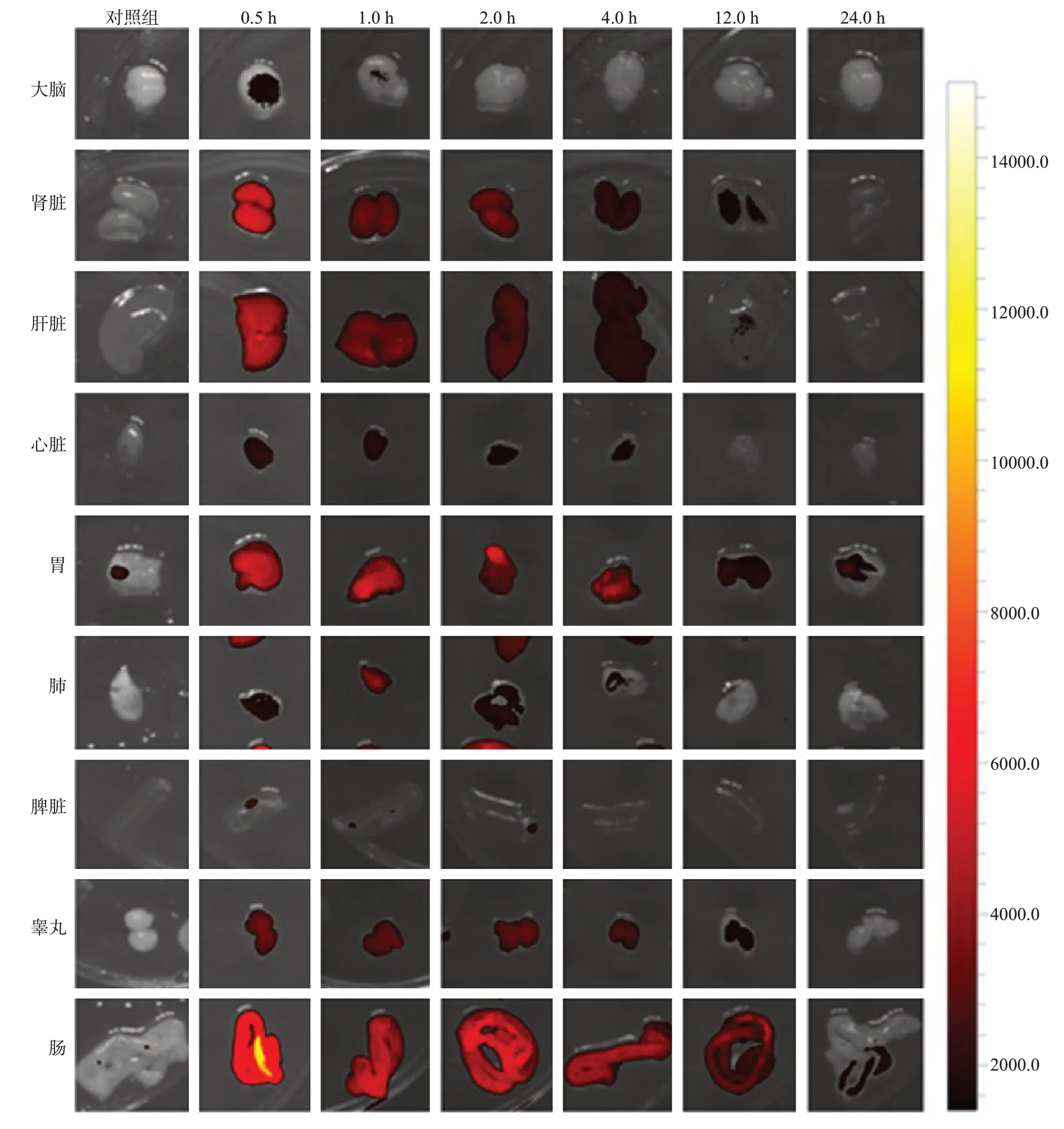
图4 在不同时间点静脉注射TA-Gd@RB对小鼠进行实时离体荧光成像Fig. 4 Real-time ex vivo fluorescence imaging of mice with intravenous injection of the TA-Gd@RB at different time points.
3 讨论
FI的高分辨率和MRI对穿透深度的不限制相结合,MRI/FI近年来引起了广泛关注。精心设计和制备具有优异生物相容性和高精度的MRI-FI成像探针对其成像性能至关重要。既往已有基于T1造影剂和荧光材料的FI-MRI双峰成像探针的研究[13-16]。pH敏感的FIMRI双峰成像探针是通过将辐射荧光探针和Gd-DOTA复合物连接到聚(N-(2-羟丙基)甲基丙烯酰胺)来构建的,该探针的荧光强度随着细胞内pH值从4变为7而变化,T1 MRI信号不受pH值变化的影响,但对T2有明显影响[17-18]。另外一种靶向配体c(RGDyK)偶联Gd@C-dots是通过空气气氛煅烧法制备的,该探针发出强烈的蓝色荧光,r1弛豫率高达5.88 mmol-1s-1,在采用一步水热技术后,r1弛豫率可达6.27 mmol-1s-1[19-21]。通过热分解过程,钆喷酸葡甲胺用作碳源和Gd(III)源,合成具有3~4 nm 均匀粒径的Gd(III)掺杂碳点,该探针具有优良的成像性能和低毒性等优点,但体内稳定性较差[22-23]。而柠檬酸、乙二胺和GdCl3 也可以通过200 ℃的水热处理制备Gd掺杂的MRI/FI双模态探针,但量子产率较低[24-25]。因此,虽然既往制备了多种MRI/FI探针,但这些探针的弛豫率低,荧光发射波长较短,这些缺点阻碍了探针的实际应用。本研究合成的TA-Gd@RB双模态探针有效地克服了上述研究的不足,合成示意图充分说明了TA-Gd@RB的制备路线。本研究以硝酸钆和单宁酸为金属配体源,在碱性条件下首次合成了钆-酚配位聚合物纳米颗粒。由于纳米粒子表面含有大量的羟基基团,成为一种高度修饰的MRI造影剂纳米载体,这样的结构能够使载体表面有更多的可以修饰的基团,使其实现功能的多样化。随后,荧光基团罗丹明B以共价键结合在Gd-酚配位聚合物纳米颗粒的表面,构建最终的MRI/FI双峰成像探针。TA-Gd@RB呈实心球形结构,尺寸为50~100 nm,水溶性极佳,探针的纵向r1值为6.94 mmol-1s-1,具有良好T1造影剂效果。同时,探针所载的荧光含量较高,发射波长较长,达590 nm,其所具有的红色荧光特性使其在一定程度上具有抵抗生物背景干扰的能力。
在体内MR成像的研究中,TA-Gd@RB肝脏的信号增强时间长,强化幅度高,这表明TA-Gd@RB在静脉给药后很快进入肝脏并实现T1增强信号,肝脏的信号在注射后4 h内继续增加,4 h后逐渐减弱至注射前的水平,表明TA-Gd@RB在体内有着长时间的血液循环时间,这主要得益于TA-Gd@RB有着良好的形貌和纳米尺寸结构,降低了其在体内血液中的降解速率,为提升成像窗口时间提供了保证,也有效地解决了既往研究中[22-23]MRI/FI双模态影像探针成像效果好而稳定性差的不足。而膀胱在注射TA-Gd@RB后的持续强化,表明TA-Gd@RB 能够在体内被降解并释放小分子Gd3+螯合物,并及时地经膀胱清除体外,避免了Gd3+螯合物在体内长时间的滞留所带来的潜在毒性可能,保证了TA-Gd@RB的安全性。
在观察TA-Gd@RB的荧光实验中,我们发现脑组织可以观察到微弱的荧光信号,这表明TA-Gd@RB具有穿过血脑屏障的潜在可能性。更重要的是,主要器官的荧光信号可以间接反映TA-Gd@RB在小鼠体内的代谢途径。首先,在注射后0.5 h检测到肾脏和睾丸中的强荧光信号,并且这两个器官中的荧光信号随着时间的增加而基本同步衰减,这表明TA-Gd@RB可以通过肾脏系统的新陈代谢排出体外,与体内磁共振成像结果相符合,有效的保证其安全性。另外,小肠区域的荧光信号总是最强的,这可能是因为TA-Gd@RB会在小肠中积累或通过肠道排出体外。同时在胃、肝和大肠器官中也发现了荧光信号的同步衰减,这表明该复合物在肝脏中代谢后可能以粪便的形式从肠道系统排出。总体而言,TA-Gd@RB在体内的存在两条代谢途径,经膀胱排泄和从粪便经肠道排出,代谢途径的增多,表明TAGd@RB能有效的被清除出体外,极大地增加了其使用的安全性。
综上,基于钆-酚类配位聚合物的新型MR/FI双模态影像探针TA-Gd@RB具有优异的FI/MRI性能,相信该探针在未来能有效地可视化其它疾病模型,促进用于疾病诊断的分子成像探针的发展。