AchE、NT-3对唤醒麻醉下三叉神经半月节微球囊压迫术预后的预测价值
周 启,邓玲玲
(1湖南中医药大学第一附属医院麻醉科,长沙 410021;2长沙市第三医院麻醉科,长沙 410035)
三叉神经痛(trigeminal neuralgia,TN)是临床常见的面部疼痛,主要表现为三叉神经中一支或多支区域短暂性、阵发性、反复性的电击样剧痛[1]。唤醒麻醉下三叉神经半月节微球囊压迫术(percutaneous microballoon compression,PMC)是新型的经皮微创术式,操作简单、创伤小、安全性高,适用于伴有严重基础疾病无法开颅手术、高龄及药物治疗无效的TN患者,但是仍存在部分患者术后疼痛无改善,或部分改善、复发的现象[2]。乙酰胆碱酯酶(acetylcholinester⁃ase,AchE)是胆碱能神经传导中的关键酶,广泛分布于神经系统及红细胞中,参与神经细胞生物学行为及神经肌肉接头发育、神经受体强化,进一步探索其生理功能是临床研究神经系统损伤与修复的重要基础[3]。神经营养因子3(neurotrophin-3,NT-3)由星型胶质细胞合成及分泌,研究发现其是神经元增殖、分化、功能维持,以及神经损伤后修复及再生的必需因子,且在病理性、生理性神经疼痛传导中起到关键作用[4]。本研究选取100例行PMC治疗的TN患者,分析AchE、NT-3水平对其预后的影响,并探讨两者预测价值,以期指导临床。
1 资料与方法
1.1 研究对象选取2016年1月—2018年1月在湖南中医药大学第一附属医院行唤醒麻醉下三叉神经半月节微球囊压迫术的TN患者100例(按照优效性平行随机对照试验样本量计算公式取α=0.025,β=0.2,则μ1-α=1.96,μ1-β=0.84,将以上参数代入上述公式得出样本量),其中男性48例,女性52例,年龄29~78岁,平均年龄(59.54±10.74)岁。纳入标准:(1)符合《三叉神经痛与面神经疾病学》中TN诊断标准[5],≥3个月的疼痛反复、局限性发作,突发突止;疼痛区域为三叉神经面部分布区单支或多支;存在明确扳机点;疼痛缓解期无任何症状;(2)发作形式固定、刻板;(3)符合PMC手术指征;(4)同意接受随访。排除标准:(1)伴有神经系统阳性体征;(2)三叉神经损毁史,开颅外科治疗史;(3)经颅脑CT检查发现脑膜瘤、听神经瘤、胆脂瘤、三叉神经鞘瘤等颅内、外继发性病变;(5)临床资料缺失。本研究在医院伦理委员会批准后进行,患者或家属对研究内容知情同意。
1.2 方法
1.2.1 血清AchE、NT-3水平检测术前抽取100例患者空腹静脉血5 mL,离心收集上清冷冻保存待用。采用胆碱酯酶酶抗原免疫测定法检测AchE,采用酶联免疫吸附法检测NT-3,严格按照试剂盒说明书要求设计检测步骤。
1.2.2 唤醒麻醉下三叉神经半月节微球囊压迫术100例患者均采用全麻方式,咪达唑仑2 mg、雷莫司琼0.3 mg、丙泊酚3~4 mg/kg、地塞米松10 mg静脉注射。然后置入Ambu喉罩3#或4#。采用静脉持续微量输液泵推注丙泊酚1~2 mg/kg,并持续吸入1%~2%丙泊酚保留自主呼吸维持麻醉。全麻后保持患者仰卧位,头稍微后倾10~20°。定位穿刺点(患侧口角外侧2~3 cm位置,以同侧颧弓水平外耳道前方3 cm、瞳孔下方0.5 cm为参考点)。经Hartel前入路法穿刺,采用CTZ-14号导管针,C型臂引导下将穿刺针刺入卵圆孔并进行确认。拔出穿刺针芯后,将5号球囊(带有导管)导入Meckel腔隙中,撤出导管后向球囊中注入造影剂0.3 mL,术中通过C型臂确认球囊位于Meckel腔中。继续充盈球囊至出现理想的倒梨形,最终充盈量0.5~0.8 mL。<40岁、40~60岁、>60~80岁、>80岁球囊压迫时间分别为2 min、3 min、3.5 min、4 min。逐渐唤醒患者后将其喉罩拔除,刺激其术前疼痛位置与“扳机点”,询问患者感受,并观察患侧眼球是否存在运动障碍及结膜充血,如患者主诉患侧有麻木感或者无疼痛时结束手术。如效果不佳,重新调整球囊套管,重新压迫30~120 s,患者主诉达到预期后将穿刺针撤出。
1.2.3 预后判断患者出院后开始随访,以《三叉神经痛》及美国巴罗神经学研究所(Barrow Neurological Institute,BNI)疼痛评分量表对术后疼痛缓解程度进行评估[6-7],评分I为治愈,II~III为有效,IV~V为无效。疼痛未缓解或任何形式的复发为随访终点事件,随访至2021年1月。
1.2.4 收集临床资料并赋值收集患者术前及术中临床资料,包括年龄(<60岁=0,≥60岁=1)、性别(女=0,男=1)、高血压(无=0,有=1)、家族史(无=0,有=1)、患侧(左=0,右=1)、症状类型(典型性=0,非典型性=1)、疼痛累及位置(V1支=0,V2支=1,V3支=2,V1+V2支=3,V2+V3支=4,V1+V2+V3支=5)、蛛网膜粘连(无=0,有=1)、后颅窝容积狭窄(无=0,有=1)、岩静脉遮挡(无=0,有=1)、神经血管压迫位置(出脑干区=0,非出脑干区=1),责任血管压迫形式(动脉压迫=0,静脉压迫=1,动、静脉联合压迫=2),责任血管压迫程度(单纯接触型=0,单纯粘连型=1,接触伴移位型=2,粘连伴移位型=3,萎缩型=4),体质指数(body mass index,BMI)、病程、球囊压迫时间、球囊造影剂充盈量、AchE、NT-3为连续变量,以上述因素为自变量,以是否发生预后不良(否=0,是=1)为因变量行Logistic回归分析。
1.3 统计学处理经统计学软件SPSS 19.0对数据进行分析与处理,计量资料以均数±标准差(±s)描述,两两样本比较采用t检验;计数资料以[n(%)]描述,采用χ2检验;采用Logistic回归分析法计算导致PMC预后不良的危险因素比值比(odds ratio,OR)、95%可信区间(confidence interval,CI)。P<0.05为差异有统计学意义。通过建立受试者工作特征曲线(receiver op⁃erating curve,ROC)分析AchE、NT-3对PMC预后不良的预测价值。
2 结果
2.1 随访结果随访至2021年1月,平均随访时间(28.54±6.13)个月,100例患者中15例脱落(因患者个人原因导致脱落12例,因研究人员未及时记录数据导致脱落3例),最终纳入85例,其中9例疼痛未缓解,21例疼痛复发,最早复发于术后3个月,最晚复发于术后32个月,平均复发时间(23.46±3.95)个月。PMC预后不良30例(35.29%),设为不良组,其余55例(64.71%)设为良好组。
2.2 不良组、良好组血清AchE、NT-3及其他可能影响因素的差异比较与良好组比较,不良组责任血管萎缩型压迫构成比及血清AchE、NT-3水平较高,责任血管动脉压迫构成比较低,病程较长(P<0.05);两组年龄、性别、高血压、家族史、患侧、症状类型、疼痛累及位置、蛛网膜粘连、后颅窝容积狭窄、岩静脉遮挡、神经血管压迫位置、BMI、病程、球囊压迫时间、球囊造影剂充盈量临床资料比较,差异无统计学意义(P>0.05)。见表1。

表1 两组可能影响因素差异比较
2.3Logistic回归分析法分析PMC预后不良的危险因素Logistic回归分析显示,病程长、责任血管萎缩型压迫及血清AchE、NT-3水平高是PMC预后不良的危险因素,责任血管动脉压迫是PMC预后的保护性因素(P<0.05)。见表2。
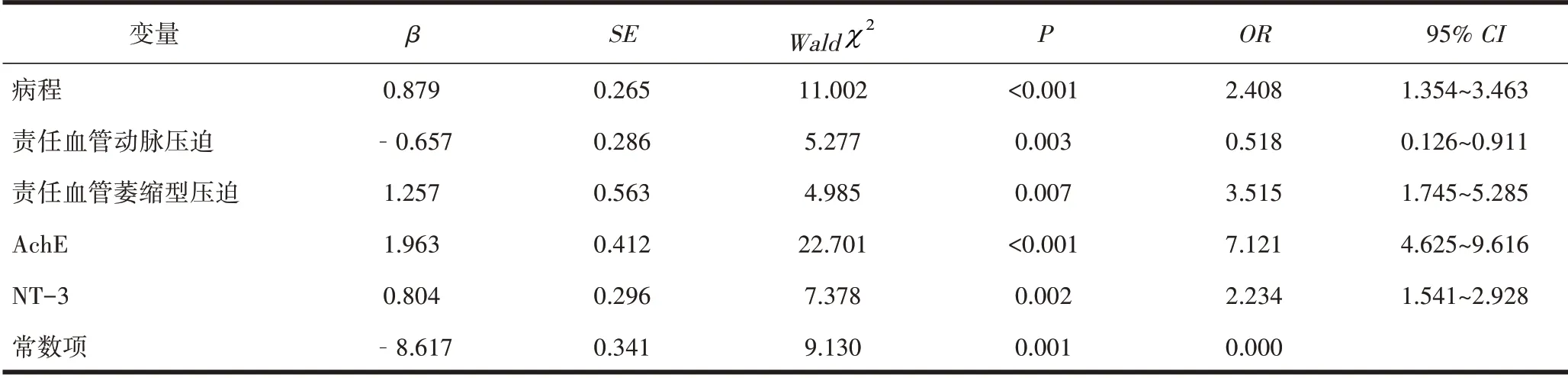
表2 Logistic回归分析法分析PMC预后不良的危险因素
2.4 AchE、NT-3对PMC预后不良的预测价值AchE、NT-3联合预测时以串联方式进行。AchE、NT-3预测PMC预后不良的最佳截断点分别为2.67 U/mL、135.40 ng/L,单独及联合预测PMC预后不良的AUC分别为0.665、0.701、0.795。两者联合的预测 价 值高 于 单独AchE、NT-3检 测(Z=3.154,P=0.042;Z=2.421,P=0.016)。见表3、图1。

图1 AchE、NT-3单独及联合预测PMC预后的ROC曲线图
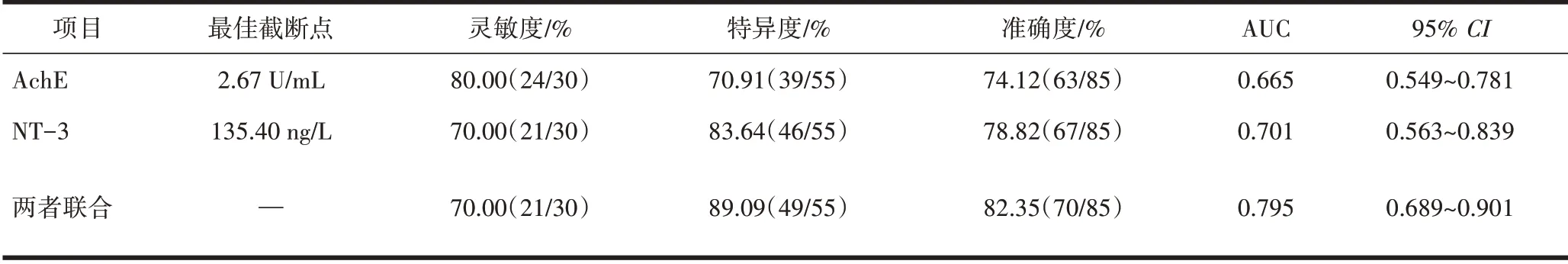
表3 AchE、NT-3单独及联合对PMC预后不良的预测价值
3 讨论
目前关于TN的发病机制尚未被完全阐明,多认为是三叉神经半月结中感觉根及(或)其周围支长期被血管压迫,导致脱髓鞘改变,神经束原本的痛觉传导抑制作用被削弱甚至消失,激活并反复激发三叉神经背核的自我反馈性,增加受损神经痛觉敏感性,痛觉阈值降低,从而引发疼痛[8-9]。目前TN治疗首选方式仍为药物治疗,其中卡马西平因疼痛控制率较高而有着广泛的应用。但随着用药周期的延长,超过30%的患者因药效减退需持续增加剂量以维持效果,最终导致无法继续用药,不得不寻求手术治疗[10]。PMC的原理为通过制造三叉神经半月节组织机械性损伤,降低三叉神经兴奋性,阻断神经中枢接收三叉神经传入冲动信号,从而起到确切治疗效果,但其远期预后仍受到多种因素影响,且尚未完全明确[11]。
本研究Logistic回归分析显示,病程长、责任血管萎缩型压迫及血清AchE、NT-3水平高是PMC预后不良的危险因素,责任血管动脉压迫是PMC预后的保护性因素。(1)推测病程长增加PMC预后不良风险的原因为:血管被长期压迫导致神经根损伤,长时间的神经脱髓鞘造成的中枢超敏化具有不可逆性,即便在PMC后也无法得以有效缓解,但确切机制仍有待深入研究。(2)动脉压迫是PMC预后的保护性因素,相较于单纯静脉压迫及动、静脉联合压迫,动脉压迫在PMC球囊压迫后可获取更好的效果。此外有研究指出[12],典型性TN患者不仅存在发病初期典型的间隙性发作及“扳机点”,且在术后多发现有显著及明确的动脉性压迫,该类型患者预后可能与其存在一定关联。(3)秦磊等[13]研究显示,责任血管对三叉神经根的压迫程度是影响该病预后的重要因素之一。压迫程度不仅与病程长短关系密切,且对神经受损程度具有决定性影响。对于病程较短的TN患者而言,血管和神经的关系多为单纯接触,随着病程的推移,逐渐向粘连、移位、萎缩转变,神经受压迫的程度随之加重,导致PMC预后不良。(4)AchE同时具有氨肽酶与羧肽酶活性,其通过降解乙酰胆碱,阻断神经递质对突触后膜的兴奋作用,维持乙酰胆碱正常浓度[14]。AchE水平变化是神经突触及神经细胞生理功能与病理状态的反映,其水平异常升高时表明突触间隙中乙酰胆碱升高,神经兴奋性增强,TN痛觉阈值降低,加重病情,影响PMC预后。且有学者指出,AchE水平与脑组织氧化应激程度表现为正相关,可能是其影响TN预后的原因之一[15]。(5)NT-3是神经营养因子家族的重要成员之一,可通过介导蛋白激酶B(protein kinase B,AKT)/丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路保护神经元功能,保障其营养供应并诱导其增殖、分化,并支持雪旺细胞存活和分化,刺激轴突再生和髓鞘形成。TN患者发生神经损伤后,伤害性感受神经元与交感神经系统发生偶联,形成并维持神经痛。Xun等[16]研究表明,下调神经病理性疼痛大鼠NT-3表达可明显减轻痛觉超敏,减少背根神经节发生交感纤维出芽,提示内源性NT-3异常高表达与神经痛及交感神经出芽有关,可能也是NT-3参与TN神经损伤后修复的机制。DOS REIS等[17]发现,采用NT-3反义寡核苷酸或NT-3抗体干预对神经损伤诱导的Aβ纤维发芽具有抑制作用,且在神经痛发展至晚期阶段,NT-3抗体可明显减轻痛觉超敏,推测其高水平是导致TN疼痛的重要原因,降低对PMC中所致机械性损伤的敏感性,从而导致预后不良。
本研究ROC曲线显示,AchE、NT-3预测PMC预后不良的最佳截断点分别为2.67 U/mL、135.40 ng/L,单独及联合预测PMC预后不良的AUC分别为0.665、0.701、0.795,提示两者联合预测PMC预后不良的价值高于单独检测。因此,临床在PMC前需加强对血清AchE、NT-3水平的监测,积极控制两者水平,提高术后疼痛控制率,避免或减少复发。
综上所述,AchE、NT-3水平高是唤醒麻醉下PMC预后不良的危险因素,两者联合对其预后不良的预测价值较高。然而,在客观条件的限制下,本研究纳入样本量减少,在今后研究中需持续改进,对唤醒麻醉下PMC血清指标的预后预测价值进行更为深入的研究。

