红缘拟层孔菌子实体和发酵菌丝体营养成分比较分析
周鹏程,张黎明,崔 燕,宋景新,聂琳然,郑志强,鲁吉珂,康彩彩,韩培培,贾士儒,,郝利民,
(1.天津科技大学 工业发酵微生物教育部重点实验室,天津 300457;2.军事科学院军需工程技术研究所,北京 100010;3.郑州大学生命科学学院,河南 郑州 450001)
红缘拟层孔菌(Fomitopsis pinicola)又名松生拟层孔菌、红缘树舌、红缘层孔菌、红缘多孔菌等,是担子菌纲、非褶菌目、多孔菌科、拟层孔菌属的一种药食两用真菌,红缘拟层孔菌主要寄生于松属树木,在我国以东北地区最为常见,其味微苦、性平,具安神定志、补肺益肾、扶正培本、滋补强壮和祛风除湿的作用[1-2]。现代药理学研究表明,红缘拟层孔菌具有抗肿瘤、抗氧化、抑菌抗炎、调节免疫力等功效,对肾炎、支气管炎、癌症、心脏病、糖尿病等有特效,民间常用于治疗“寒腿”病[3-4]。
目前,食用菌在中国农业经济中仅次于粮、棉、油、菜、果,居第6位,具有低脂肪高蛋白的特点,在发挥绿色生态循环农业中起到非常重要的作用[5],而红缘拟层孔菌因其丰富的营养和保健功效成分而引起国内外专家学者的广泛关注。张丽萍等[6]研究发现,红缘拟层孔菌胞内多糖对CCl4法形成的小鼠肝脏损伤有保护作用;Hao Limin等[7]研究红缘拟层孔菌液态培养胞内外多糖对比发现胞外多糖抗氧化能力更高;聂林然等[8]将不同产地(吉林、黑龙江、云南)红缘拟层孔菌子实体和发酵菌丝体多糖的抗氧化活性进行对比发现,云南产地的红缘拟层孔菌多糖抗氧化活性最高,而液态培养胞外多糖对酵母氧化损伤的保护能力最强;孙琦等[9]发现红缘拟层孔菌固态发酵产物对H22荷瘤小鼠肿瘤具有较好的抑制率;Kuo等[10]利用中性粒细胞评估从红缘拟层孔菌中分离的32种三萜化合物,发现Pinicolasin J化合物对超氧阴离子自由基抑制效果最好;Cheng[11]和赵秀红[12]等分别发现红缘拟层孔菌的醇提取物和水提取物具有抗炎作用。此外,孙雪等[13]研究发现,从红缘拟层孔菌子实体中分离得到的3-乙酰氧基-8,24-羊毛甾二烯-21-酸能有效改善荷瘤小鼠的免疫系统功能。
虽然红缘拟层孔菌具有良好的生物活性,然而其药理作用的发挥需要一定的物质基础,除活性成分外,营养物质的含量与组成也与其药理作用密切相关[14]。近年来,许多报道揭示了其他食用菌不同产地子实体在营养成分组成和含量上有显著差异[15-19],但鲜有将液态培养红缘拟层孔菌营养成分一同进行全面对比分析[20-22]。因此,本研究以不同产地红缘拟层孔菌子实体和液体培养菌丝体为原料,对其主要营养成分(碳水化合物、蛋白质、氨基酸、脂肪酸和矿物质元素)进行对比分析和评价,以期为红缘拟层孔菌子实体和发酵培养菌丝体及其活性产物的综合开发提供理论依据。
1 材料与方法
1.1 材料与试剂
红缘拟层孔菌菌种由军事科学院系统工程研究院军需工程技术研究所提供。红缘拟层孔菌子实体分别购自吉林、黑龙江、云南,经军需工程技术研究所鉴定,将样品烘干,粉碎备用。红缘拟层孔菌发酵菌丝体由上述菌种液体培养4.5 d(28 ℃、180 r/min)后,过滤、洗涤、冷冻干燥获得,然后粉碎备用。
培养基:蔗糖50.0 g/L、酵母粉10.0 g/L、KH2PO42.0 g/L、MgSO4·7H2O 10.0 g/L,pH 5.0。甲醇和乙腈均为色谱纯,购自美国Thermo Fisher Scientific公司;其余试剂均为分析纯。
1.2 仪器与设备
DGG电热鼓风干燥箱 天津天宇机电有限公司;K9840自动凯氏定氮仪 济南海能仪器股份有限公司;SX2-12-10马弗炉 北京永光明医疗仪器厂;JA12002电子天平 上海精科天平仪器厂;DZKW-4电子恒温水浴锅南昌恒顺化验设备制造有限公司;L-8800氨基酸全自动分析仪 日本日立公司;6890-5975C气相色谱-质谱联用仪 美国安捷伦公司;AA-6800原子吸收光谱仪日本岛津仪器制造有限公司。
1.3 方法
1.3.1 常规营养成分的测定
水分含量测定:参照GB 5009.3—2016《食品中水分的测定》直接干燥法;粗蛋白含量测定:参照GB 5009.5—2016《食品中蛋白质的测定》凯氏定氮法(粗蛋白质含量=总氮含量/16%);粗脂肪含量测定:参照GB 5009.6—2016《食品中脂肪的测定》索氏脂肪抽提法;碳水化合物含量测定:参照GB/Z 21922—2008《食品营养成分基本术语》;灰分含量测定:参照GB 5009.4—2016《食品中灰分的测定》灼烧重量法。
1.3.2 氨基酸的测定
1.3.2.1 氨基酸检测
参照GB 5009.124—2016《食品中氨基酸的测定》,采用酸水解法处理样品,不考虑色氨酸的检测。
试样水解:精确称取一定量样品于水解管中,加入10 mL 6.0 mol/L HCl溶液,抽真空至真空度接近0 Pa,维持10 min,封口、水解(110 ℃,22 h)、冷却、过滤,取滤液2 mL于比色管中,水浴(60 ℃,10 min),真空干燥器蒸干,加入适量HCl溶液(0.02 mol/L),静置30 min,得待测液。
试样测定:使用混合氨基酸标准工作液注入氨基酸自动分析仪,参照JJG 1064—2011《氨基酸分析仪检定规程》及仪器说明书进行试样的测定,以外标法通过峰面积计算样品测定液中氨基酸含量,色谱柱为磺酸型阳离子树脂,检测波长为570 nm和440 nm。
1.3.2.2 氨基酸评价
根据1973年联合国粮食与农业组织(Food and Agriculture Organization,FAO)/世界卫生组织(World Health Organization,WHO)建议的氨基酸评分标准模式和全鸡蛋蛋白质的氨基酸模式[23]基准,按式(1)、(2)计算红缘拟层孔菌子实体和菌丝体中蛋白质的氨基酸评分(amino acid score,AAS)和化学评分(chemical score,CS)。

1.3.3 脂肪酸含量测定
参照GB 5009.6—2016《食品中脂肪的测定》,以石油醚(60~90 ℃)为提取剂,采用索氏抽提法提取粗脂肪,然后进行脂肪酸甲酯化处理,最后用气相色谱-质谱分析预处理样品。
脂肪酸甲酯化:将索氏抽提所得粗脂肪样品(100.0 mg)置于比色管,依次加入正己烷-乙醚(2∶1,V/V;5 mL)和KOH-甲醇溶液(0.5 mol/L,3 mL)混匀,超声10 min,加5 mL纯水混匀,4 000 r/min离心2 min,取上层脂肪酸甲酯备用。
色谱条件:VF-5MS型毛细管色谱柱(30 m×0.25 mm,0.25 μm);载气高纯氦气(纯度为99.999%),柱流速1 mL/min,分流比5∶1;升温程序:柱初温80 ℃,保温2 min,以10 ℃/min速率升温至200 ℃,再以5 ℃/min速率升温至290 ℃,保温5 min;进样口温度280 ℃;进样量0.5 μL;
质谱条件:电子电离源;传输线温度280 ℃;离子源温度220 ℃;扫描方式全扫描,质量扫描范围m/z50~500,溶剂峰切除时间6 min。
1.3.4 矿物质元素含量测定
将样品(0.500 0 g)置于凯氏瓶并加入HNO3-HClO4(4∶1,V/V;15 mL)消化液,混合均匀,静置过夜,缓慢加热至微沸,待溶液变为淡黄绿色或无色,且出现高氯酸白色烟雾后,冷却至室温,加少量水继续加热(去除溶液中残留的酸),重复3 次,用蒸馏水定容至50 mL得待测样,空白样处理如上[17]。采用火焰原子吸收光谱仪对待测样品进行测定。
1.4 数据处理
采用Microsoft Office Excel数据分析工具对实验数据进行分析处理,并用Origin软件进行作图。
2 结果与分析
2.1 常规营养成分含量对比分析
由表1可知,3种红缘拟层孔菌子实体的能量、脂肪、碳水化合物含量均高于发酵菌丝体。吉林1号红缘拟层孔菌子实体的能量和脂肪含量最高,云南1号的碳水化合物含量最高。红缘拟层孔菌发酵菌丝体的蛋白质含量非常丰富,达到其他子实体蛋白含量加和的2.7 倍,高于通常食用的谷物类和食用菌类作物的蛋白含量,与大豆的蛋白含量接近[24]。黑龙江1号和云南1号样品的水分含量相近,均高于吉林1号,3种子实体中的粗纤维含量相近(均在1%左右)。通常灰分中含有的各种矿物质元素能够在生物体内发挥重要作用[25],由表1可知,发酵菌丝体的灰分含量最高,这可能与发酵过程中培养基添加微量元素有关。3种子实体样品中的灰分含量差异较大,由高到低依次为黑龙江1号>吉林1号>云南1号。通过对比3种子实体的常规营养成分可知,不同地区子实体的营养成分含量差异较大,产地应是影响红缘拟层孔菌子实体营养成分组成和含量的重要因素之一,即使是毗邻产地的红缘拟层孔菌子实体其营养成分也存在一定的差异[15-19]。发酵菌丝体的营养成分与子实体相比差异也同样很大,其中蛋白质含量显著高于子实体,其低糖低脂高蛋白的营养特性预示红缘拟层孔菌发酵菌丝体可能是一种优良的食用蛋白资源。
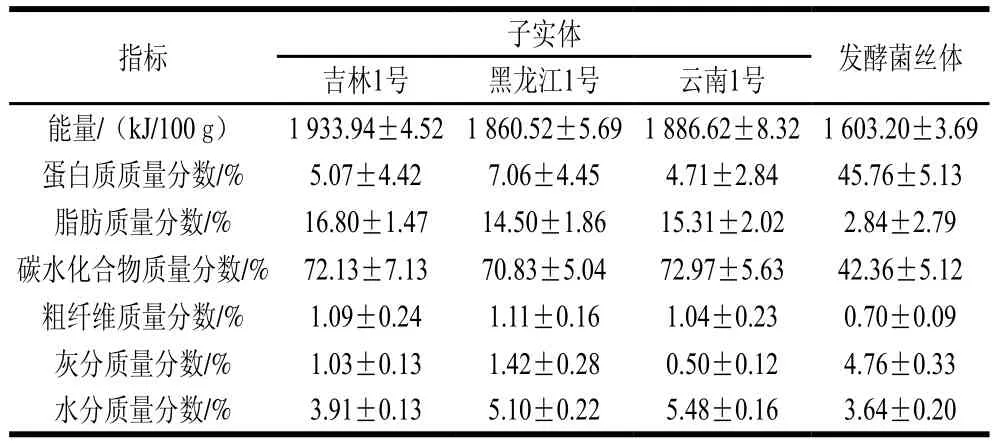
表1 红缘拟层孔菌子实体与发酵菌丝体的常规营养成分含量Table 1 Nutrient contents in fruit bodies and cultured mycelia of F.pinicola
2.2 氨基酸组成分析及评价
2.2.1 氨基酸组成分析
由表2可知,3种红缘拟层孔菌子实体中均检测出15种氨基酸,不含蛋氨酸和胱氨酸;发酵菌丝体中共检测出16种氨基酸,其中必需氨基酸(essential amino acid,EAA)7种,非必需氨基酸(non-essential amino acid,NEAA)9种,不含胱氨酸。4种样品氨基酸总量(total amount of amino acids,TAA)由高到低依次为发酵菌丝体(438.90 g/kg)>黑龙江1号(38.09 g/kg)>云南1号(21.87 g/kg)>吉林1号(15.27 g/kg),这与红缘拟层孔菌子实体和发酵菌丝体蛋白质含量(表1)检测结果顺序基本一致。子实体中黑龙江1号的TAA最高,云南1号次之,而吉林1号的含量较低,这可能是由于菌种、产地气候、土壤环境和采收时间等因素导致红缘拟层孔菌子实体中氨基酸组成和含量的差异。另外,在3种红缘拟层孔菌子实体和发酵菌丝体中,EAA总量均占其TAA的35%~45%,EAA与NEAA的比值均在60%~80%,符合FAO/WHO推荐的模式值,即EAA/TAA在40%左右,EAA/NEAA在60%以上[26],表明各样品的蛋白质属于优质蛋白质,符合人体所需即EAA比例,具有较高营养价值。

表2 红缘拟层孔菌子实体与发酵菌丝体的氨基酸含量Table 2 Amino acid contents in fruit bodies and cultured mycelia of F.pinicola g/kg
从氨基酸的组成看,红缘拟层孔菌子实体和发酵菌丝体中以谷氨酸和天冬氨酸居多。谷氨酸、天冬氨酸、蛋氨酸和丝氨酸为4种鲜味氨基酸[27],均占其TAA的30%左右。3种红缘拟层孔菌子实体和发酵菌丝体中,谷氨酸含量均最高,天冬氨酸含量次之。在3种红缘拟层孔菌子实体和菌丝体中,亮氨酸、缬氨酸和异亮氨酸3种支链氨基酸含量也较高,支链氨基酸不仅具有抗疲劳和提高运动耐力的功能,在缓解运动性肌肉损伤和抑制延迟性肌肉酸痛发生等方面也有显著作用[28]。4种样品中,谷氨酸、天冬氨酸、精氨酸、甘氨酸、苯丙氨酸、酪氨酸、蛋氨酸、亮氨酸、赖氨酸9种药用氨基酸[29],整体占TAA的60%左右,由高到低依次为发酵菌丝体>黑龙江1号>云南1号>吉林1号,其中均以谷氨酸、天冬氨酸、亮氨酸、甘氨酸和苯丙氨酸居多,占其TAA的45%左右,药用氨基酸占总氨基酸的比例高。
2.2.2 氨基酸评价结果
氨基酸平衡理论认为,氨基酸组成比例越接近WHO/FAO模式或全蛋白模式比例,其蛋白质量越优。据此对红缘拟层孔菌子实体和发酵菌丝体中EAA含量进行分析。由表3可知,红缘拟层孔菌发酵菌丝体中EAA的总含量为437.74 mg/g,明显优于WHO/FAO模式(350 mg/g)及常见粮食作物如花生(315 mg/g)、小麦(299 mg/g)和大豆(367 mg/g),与全蛋白模式(473 mg/g)接近[30],说明红缘拟层孔菌发酵菌丝体的蛋白中EAA含量丰富,而红缘拟层孔菌子实体的EAA含量较WHO/FAO模式和全蛋白模式仍有一定差距。

表3 红缘拟层孔菌子实体与发酵菌丝体EAA组成Table 3 Essential amino acid composition in fruit bodies and cultured mycelia of F.pinicola mg/g
另一方面,从单种氨基酸含量来说,红缘拟层孔菌发酵菌丝体每种EAA含量除蛋氨酸+半胱氨酸之外均高于WHO/FAO模式值,其中苯丙氨酸+酪氨酸含量最高(106.25 mg/g),除吉林1号外,所有样品的相应检测值均高于WHO/FAO模式值(60 mg/g)。
根据测定的氨基酸百分比与FAO/WHO建议的氨基酸评分标准模式和全蛋白模式进行比较,计算出红缘拟层孔菌子实体和发酵菌丝体的AAS和CS。由表4可知,红缘拟层孔菌子实体和发酵菌丝体中含硫氨基酸(蛋氨酸+半胱氨酸)的ASS均最低,为第1限制氨基酸。对于3种子实体,其第2限制性氨基酸均为赖氨酸;菌丝体只存在1种限制性氨基酸且其余氨基酸AAS均大于100%,高于子实体。

表4 红缘拟层孔菌子实体与发酵菌丝体EAA AAS评价结果Table 4 AAS of essential amino acids in fruit bodies and cultured mycelia of F.pinicola%
由表5可知,基于CS,红缘拟层孔菌子实体和发酵菌丝体的第1限制性氨基酸均为含硫氨基酸(蛋氨酸+半胱氨酸),与AAS结果相似。对于3种子实体,其第2限制性氨基酸为赖氨酸;菌丝体的第2限制性氨基酸为异亮氨酸。红缘拟层孔菌发酵菌丝体CS普遍高于子实体,除含硫氨基酸外均大于90%。

表5 红缘拟层孔菌子实体与发酵菌丝体EAA CS评价结果Table 5 CS of essential amino acids in fruit bodies and cultured mycelia of F.pinicola%
红缘拟层孔菌子实体和发酵菌丝体的氨基酸评价,从以上2种氨基酸评价模式看,第1限制性氨基酸都为含硫氨基酸(蛋氨酸+半胱氨酸),第2限制性氨基酸存在差异,是由于参考模式的氨基酸含量有差异。3种子实体中,苯丙氨酸+酪氨酸的AAS和CS都是最高的;菌丝体中,苯丙氨酸+酪氨酸的AAS最高,赖氨酸的CS最高。综合氨基酸含量与EAA评价结果,红缘拟层孔菌发酵菌丝体氨基酸营养价值高于其子实体,冮洁等[22]对美味牛肝菌的研究中同样指出发酵菌丝体相对子实体具有更高的蛋白和氨基酸含量,这可能与菌丝体液态培养时氮源中含有丰富的氨基酸有关,而发酵菌丝体中评分最高的赖氨酸是人乳中的第1限制性氨基酸[31]。
2.3 脂肪酸组成分析
不饱和脂肪酸与人体生理机能相关,是目前脂肪酸代谢研究的一个重点[32]。由表6可知,红缘拟层孔菌子实体和发酵菌丝体中均检出油酸、亚油酸、亚麻酸、棕榈酸等10种主要的脂肪酸成分,其中饱和脂肪酸5种,不饱和脂肪酸5种(包括单不饱和脂肪酸3种,多不饱和脂肪酸2种)。油酸和亚油酸是2种对人体非常有益的长链不饱和脂肪酸[17]。3种子实体和发酵菌丝体中不饱和脂肪酸占总脂肪酸的比例均超过了70%,由高到低依次为黑龙江1号>发酵菌丝体>吉林1号>云南1号。各样品中,均以油酸、亚油酸、亚麻酸3种不饱和脂肪酸所占比例最高,其次是棕榈油酸,这与已有研究结果[33]基本一致,其中发酵菌丝体的油酸和亚油酸含量最高,黑龙江1号的亚油酸含量最高,而云南1号的亚麻酸含量最高。以往研究显示,在食用菌中,不饱和脂肪酸占总脂肪酸的主导地位[34-35]。由表6可知,红缘拟层孔菌子实体和发酵菌丝体中的脂肪酸都以不饱和脂肪酸为主,且主要为多不饱和脂肪酸,其中3种子实体的多不饱和脂肪酸含量高于菌丝体,而菌丝体的单不饱和脂肪酸含量高于3种子实体。红缘拟层孔菌子实体和发酵菌丝体中高比例的不饱和脂肪酸对维持机体健康具有重要作用。

表6 红缘拟层孔菌子实体与菌丝体的脂肪酸含量Table 6 Fatty acid contents in fruit bodies and cultured mycelia of F.pinicola%
2.4 矿物质元素组成分析
食用菌具有很强富集金属的特性,在生长过程中受到当地空气、水质、土壤等影响,导致其吸收并积累这些矿物质元素含量不同[33],所以3种子实体的矿物质组成差异较大,但如果受到当地水质和土壤污染,As、Cd、Pb和Hg超标,就会造成人体重金属中毒[37-38]。由表7可知,红缘拟层孔菌子实体与发酵菌丝体中的矿物质元素含量较为丰富,含对人体有益的K、Ca、Na、Mg等常量元素以及人体必需的Zn、Fe、Mn、Cu、Se、Cr等微量元素,但不同样品的矿物质元素含量相差较大。总体而言,黑龙江1号的微量元素含量最丰富,其次为吉林1号,而菌丝体的常量元素含量最丰富,除Mg的含量较低外,其他常量元素含量均高于3种子实体。发酵菌丝体的矿物质含量丰富,可能是菌丝体液态培养过程中吸收培养基中含有的矿物质元素,故在食品安全方面体现出一定的可控性。

表7 红缘拟层孔菌子实体与发酵菌丝体的矿物质元素含量Table 7 Mineral composition in fruit bodies and cultured mycelia of F.pinicola
由表7可知,3种红缘拟层孔菌子实体及发酵菌丝体中Zn、Fe、Mn、Cu这4种元素含量均较高,各样品中微量元素Zn、Fe、Mn、Cu的含量总和由高到低依次为黑龙江1号>吉林1号>菌丝体>云南1号;发酵菌丝体中K含量明显高于子实体,应当是培养基中添加了含K的无机盐;红缘拟层孔菌子实体和发酵菌丝体中Ca、Mg两种元素的含量也较高,其中菌丝体的Ca含量最高,而Mg元素含量则以黑龙江1号最高,约为菌丝体的2 倍;红缘拟层孔菌子实体中Se和Cr检出含量均高于菌丝体,其中黑龙江1号最高。此外,红缘拟层孔菌子实体与发酵菌丝体中含痕量元素Cd、Pb、Hg,不含As,且其含量参照GB 2762—2012《食品中污染物限量》均在国家标准限制以内,即使大量食用也不会对人体健康产生不利影响,这为红缘拟层孔菌的安全应用提供了依据。
3 结 论
对不同产地红缘拟层孔菌子实体(吉林1号、黑龙江1号和云南1号)、红缘拟层孔菌发酵菌丝体的营养成分进行分析,结果表明:3种子实体的脂肪、碳水化合物和粗纤维含量较发酵菌丝体高,其中,吉林1号的脂肪含量最高,云南1号的碳水化合物含量最高,3种子实体中的粗纤维含量相近。发酵菌丝体的蛋白质含量远高于子实体;红缘拟层孔菌子实体检测出15种氨基酸,而发酵菌丝体中检测出16种,EAA总量均占其TAA的35%~45%;3种红缘拟层孔菌子实体和发酵菌丝体均以不饱和脂肪酸为主,黑龙江1号的含量最高;3种红缘拟层孔菌子实体和发酵菌丝体中的矿物质元素丰富,含人体必需的Zn、Fe、Mn、Cu等微量元素及对人体有益的K、Ca、Na、Mg等常量元素,但不同样品的矿物质元素含量相差较大,其中,黑龙江1号的微量元素含量最丰富,菌丝体的常量元素含量最丰富。这些测试分析结果为红缘拟层孔菌健康食品的开发提供了参考依据。

