甲状腺自身抗体对甲状腺功能正常女性体外受精-胚胎移植结局的影响
杨园,王治鸿,梁慧枝,康宜凡,段霞,杨盼
甲状腺自身性免疫(thyroid autoimmunity,TAI)指单纯甲状腺自身抗体(antithyroid antibody,ATA)阳性,不伴有血清促甲状腺激素(thyroid stimulating hormone,TSH)升高和游离甲状腺素(free thyroxine,FT4)降低。TAI是育龄期妇女甲状腺功能减退最常见的原因,发病率为8%~14%,而不孕女性TAI患病率升高可达20%[1]。ATA可能对卵泡发生、精子发生、受精、胚胎质量和妊娠产生负面影响,但机制尚不清楚。2017年美国甲状腺协会颁布《妊娠和产后甲状腺疾病诊断和管理指南》,指出考虑到左旋甲状腺素(levothyroxine,LT4)对接受辅助生殖的TAI妇女可能会带来潜在的获益和微小的治疗风险,可以给予低剂量LT4治疗[2]。2019年我国发布的《妊娠和产后甲状腺疾病诊治指南》(第二版)则指出现有研究证据不足,对TAI妇女予LT4干预的观点持不推荐不反对态度[3]。同时有研究发现LT4治疗可能会增加早产、子痫前期、妊娠期糖尿病风险,影响子代大脑发育[4-5]。就现有的研究结果来看,ATA对甲状腺功能正常女性辅助生殖结局的影响及治疗与否仍存争议。因此,本文对本中心首次行体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)妇女的临床资料进行分析讨论,为临床诊疗提供参考。
1 资料与方法
1.1 研究对象
选取2019年1月至2020年1月在山西医科大学第一医院生殖医学中心首次行IVF-ET的妇女共630例。
纳入标准:诊断为不孕症,首次行IVF助孕;TSH、FT4、游离三碘甲状原氨酸(free triiodothyronine,FT3)水平在正常范围内;年龄≤40岁;体质量指数(body mass index,BMI)18~23.9 kg/m2;基础卵泡刺激素(basal follicle-stimulating hormone,bFSH)≤10 mIU/mL;夫妻双方术前常规化验检查未见明显异常;控制性超促排卵(controlled ovarian hyperstimulation,COH)方案为激动剂长方案;授精方式为常规IVF;可行鲜胚移植,有明确妊娠结局数据。
排除标准:诊断为多囊卵巢综合征、子宫内膜异位症、子宫内膜息肉、子宫肌瘤、子宫畸形;既往复发性流产病史;既往有内分泌性疾病、代谢性疾病、结缔组织病、甲状腺外免疫性疾病病史;男女任意一方染色体异常。
本中心甲状腺功能参考范围:TSH 0.27~4.2 uIU/mL,FT410~23 pmol/L,FT33.1~6.8 pmol/L,甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)0~34 IU/mL,甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)0~115 IU/mL。本文中ATA阳性指TPOAb和TGAb中的一项或两项超过参考值范围。
依据ATA及TSH水平进行分组:ATA阴性、TSH<2.5 uIU/mL组(A1组,271例),ATA阴性、TSH≥2.5 uIU/mL组(A2组,233例),ATA阳性、TSH<2.5 uIU/mL组(B1组,79例),ATA阳性、TSH≥2.5 uIU/mL组(B2组,47例)。
1.2 研究方法
所有纳入患者均采用激动剂长方案促排卵,对于月经不规律、排卵障碍或无排卵者于月经第4~5天开始口服避孕药(炔雌醇环丙孕酮片,达英-35)2周后给予皮下注射促性腺激素释放激素激动剂(gonadotropin releasing hormone agonists,GnRH-a)1.88 mg;对于月经规律者,B超检测排卵后1周(黄体中期)给予皮下注射GnRH-a 1.88mg降调节。下次月经来潮第2~4天(或无月经来潮,降调节后半月)化验血卵泡刺激素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌二醇(estradiol,E2)水平。当达到垂体降调节要求后(FSH<5 mIU/mL,LH<5 mIU/mL,E2<50 pg/mL且子宫内膜厚度<5.0 mm),启动促排卵。给予肌注重组卵泡刺激素或尿促性素,并根据阴道B超监测卵泡情况及外周血激素检测结果调整药物用量。当有2个卵泡平均直径≥18 mm或3个卵泡平均直径≥17 mm 时停用促性腺激素(gonadotropin,Gn),并化验血LH、E2、孕酮(progesterone,P)水平,于当晚肌注绒毛膜促性腺激素(human chorionic gonadotropin,hCG)6 000~10 000 U,34~36 h后取卵。卵母细胞在培养液中培养4~6 h行常规IVF,在受精后16~20 h观察受精情况,检查是否存在原核(pronuclear,PN),以原核的有无及数目分为0PN、1PN、2PN、多PN,而出现2PN且卵周隙内有2个极体的受精被认为是正常受精,将正常受精胚胎移入卵裂期培养基培养,按Edwards[6]标准对卵裂期胚胎进行形态学评分:Ⅰ级胚胎,卵裂球大小均匀,无细胞死亡,碎片<10%;Ⅱ级胚胎,卵裂球大小比较均匀,碎片或死亡卵裂球在10%~<20%之间;Ⅲ级胚胎,碎片或死亡卵裂球在20%~50%之间;Ⅳ级胚胎,碎片或死亡卵裂球>50%。Ⅰ~Ⅲ级胚胎为可移植胚胎,Ⅰ~Ⅱ级胚胎为优质胚胎。取卵后第3天(D3)选择1~2个胚胎移植,剩余的胚胎经患者知情同意后,冷冻保存或继续培养至D5/D6形成囊胚后冷冻保存。于取卵当日给予肌注黄体酮注射液(60 mg Qd)或阴道内使用雪诺酮凝胶(90 mg Qd)或口服黄体酮胶囊(150 mg Bid)、地屈孕酮片(10 mg Bid)进行黄体支持,于移植后8~10周开始逐渐减量至停用。胚胎移植术后2周化验血hCG≥10 mIU/mL为生化妊娠,移植后4周以上B超见宫腔内孕囊及原始心管搏动为临床妊娠。对每例患者的妊娠结局进行随访,所有入选患者均随访至未妊娠、流产或分娩。
1.3 观察指标
一般资料:患者的年龄、BMI、bFSH、窦卵泡数(antral follicle count,AFC)、FT4、FT3、Gn总天数、Gn总量、hCG日E2、hCG日P、移植日内膜厚度。
实验室指标:获卵数、正常受精率(即2PN胚胎数/受精卵总数×100%)、可移植胚胎数、优胚率(优质胚胎数/2PN胚胎数×100%)。
临床指标:生化妊娠率(生化周期数/移植周期数×100%)、临床妊娠率(临床妊娠周期数/移植周期数×100%)、流产率(流产周期数/临床妊娠周期数×100%)、活产率(活产周期数/临床妊娠周期数×100%)、平均单胎分娩体重、平均双胎分娩体重。
1.4 统计学方法
2 结果
2.1 各组患者一般资料比较
各组年龄、BMI、bFSH、AFC、FT4、FT3、Gn总天数、Gn总量、hCG日E2、hCG日P、移植日内膜厚度比较,差异均无统计学意义(P>0.05),详见表1。
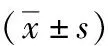
表1 各组患者一般资料比较
2.2 各组患者实验室指标比较
各组获卵数、可移植胚胎数、正常受精率、优胚率比较,差异均无统计学意义(P>0.05),详见表2。
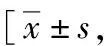
表2 各组患者实验室指标比较例(%)]
2.3 各组患者临床指标比较
B2组较其他三组生化妊娠率明显升高,差异有统计学意义(P<0.05)。各组临床妊娠率、流产率、活产率、平均单胎分娩体重及平均双胎分娩体重比较,差异无统计学意义(P>0.05),详见表3。
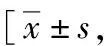
表3 各组患者临床指标比较例(%)]
2.4 生化妊娠的多因素分析
对年龄、BMI、bFSH、AFC、FT4、FT3、Gn总天数、Gn总量、hCG日E2、hCG日P、移植日内膜厚度、TSH水平、TPOAb滴度、TGAb滴度先进行单因素Logistic回归,再将P<0.1的因素纳入最后的回归方程(TPOAb滴度、TGAb滴度、hCG日E2、移植日内膜厚度)。结果提示TPOAb滴度(OR1.003,P=0.034)、移植日内膜厚度(OR0.796,P=0.014)是影响生化妊娠的独立因素,而TGAb滴度(OR1.001,P=0.129)、hCG日E2(OR1.000,P=0.059)对生化妊娠无显著影响,详见下页表4。
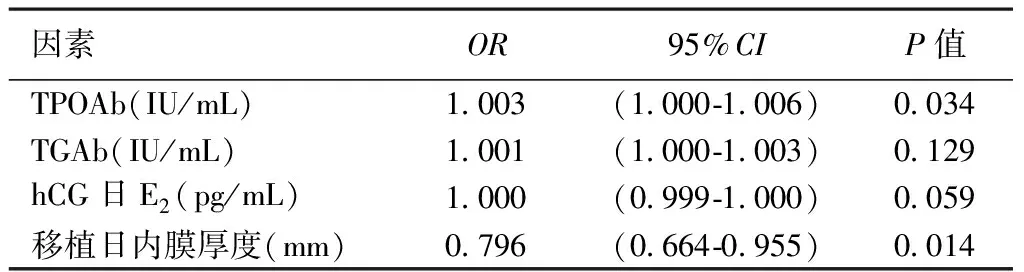
表4 生化妊娠的多因素分析
3 讨论
甲状腺是重要的内分泌器官,参与机体内各种物质的新陈代谢,对生长发育、性腺成熟、生殖功能都有一定的作用。甲状腺功能异常会导致月经失调、不孕、流产、早产、子代神经认知功能障碍等不良结局。血清TSH在自然妊娠早期短暂降低,孕早期末回升至孕前水平,并在妊娠晚期逐渐升高。对接受辅助生殖的女性,COH诱导E2迅速增加超过生理水平,达到与妊娠晚期相似的水平。高雌激素刺激肝脏甲状腺激素结合球蛋白生成增加,随着甲状腺激素结合位点的增加,FT4减少,负反馈引起TSH产生增加。此外,扳机时使用的hCG与TSH具有结构同源性,有促甲状腺作用,可直接刺激甲状腺TSH受体,引起甲状腺激素升高、TSH降低。有学者指出COH对甲状腺功能正常、ATA阴性患者甲状腺功能参数无明显影响,而TAI患者甲状腺储备功能受损,更易受到COH的影响而发生甲状腺功能不全,可表现为TSH值升高甚至超过参考值上限,这种变化持续约一月[7]。TSH短暂增高及ATA阳性是否会影响辅助生殖的结局,目前仍存在争议。
路鸿艳等[8]研究发现TAI妇女IVF优胚率、卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)优胚数显著下降,IVF受精率与血清TPOAb、TgAb水平呈负相关性。另一研究显示在TAI妇女的卵泡液中可检测到TPOAb,并与血清抗体水平相关,TAI妇女IVF后卵母细胞受精率和A级胚胎百分比显著降低[9]。彭超男等[10]发现TSH<2.5 mU/L 的患者可获得更高的正常受精率和优质胚胎率,但该研究病例数较少且未说明入选患者甲状腺自身抗体的情况。这些研究可能表明ATA阳性、高TSH水平对卵母细胞受精和胚胎发育产生一定负面影响。但也有研究得到不同结论,2016年的一项Meta分析则显示TAI对获卵数、受精率无明显影响,未提及对胚胎质量的影响[11]。一项纳入了1 185例甲状腺功能正常、ATA阴性患者的研究发现,TSH>2.5 uIU/mL对获卵数、2PN胚胎数无显著影响[12]。本研究限定促排卵方案为长方案、授精方式为IVF,结果发现无论TSH在2.5 uIU/mL上或下、ATA阳性或阴性,各组的获卵数、可移植胚胎数、正常受精率、优胚率差异均无统计学意义。
2016年的Meta分析同时发现TAI患者IVF/ICSI后流产率高(OR1.44,P=0.02)、活产率低(OR0.73,P=0.04),而着床率和临床妊娠率无明显差异,认为ATA的存在可能对妊娠过程产生不利影响,同时指出年龄和TSH水平在两组之间没有可比性[11]。而2020年最新的一项Meta分析则显示TAI妇女接受IVF/ICSI治疗后,其临床妊娠率、生化妊娠率、流产率、活产率、平均母体年龄及TSH水平与非TAI妇女相比差异无统计学意义[1]。近期一项前瞻性研究报告,接受人工授精和IVF治疗后,流产妇女的TPOAb滴度显著高于分娩者,而在接受ICSI治疗的妇女中,TPOAb滴度与妊娠结局之间没有明显关联[13]。这可能与ICSI技术克服卵泡液中ATA对透明带的影响有关,也提示我们在进行研究时应考虑到IVF和ICSI两种不同授精方式的影响。因此,本研究仅纳入了授精方式为IVF的患者,发现当甲状腺功能正常时,无论TSH水平在2.5 uIU/mL上或下、ATA阳性或阴性,IVF-ET后的临床妊娠率、流产率、活产率、平均单胎分娩体重及平均双胎分娩体重差异均无统计学意义。本研究还发现TSH≥2.5 uIU/mL、ATA阳性组的生化妊娠率较其他组明显升高,可能与TPOAb滴度升高(OR1.003,P=0.034)、移植日内膜厚度偏薄(OR0.796,P=0.014)有关,但临床妊娠率差异无统计学意义,也不除外该组样本量较少引起的误差。从本研究结果来看,尚不支持对TSH≥2.5 uIU/mL、ATA阳性患者在IVF前进行常规干预。
本文为回顾性研究,测定的甲状腺功能为卵巢刺激前的水平,因妊娠患者转诊产科,随访时未对妊娠期甲状腺功能变化及妊娠并发症进行追踪,存在一定的偏倚。尚需进行更多大规模、设计良好的前瞻性随机对照试验来进一步明确在行辅助生殖助孕前是否需将TAI患者的TSH水平降至2.5 uIU/mL以下,在研究设计时需考虑到不同促排卵药物、不同授精方式、ATA类型及滴度的影响,除了对主要结果如妊娠率、流产率、活产率等进行研究,还需将次要结果如获卵数、受精率、胚胎质量、妊娠并发症、新生儿分娩情况等纳入研究。

