无花果多糖的微波提取工艺优化
李乐,陈本寿,袁莹
(重庆化工职业学院环境与质量检测学院,重庆 401228)
无花果(Ficus carica)又名秘果、牛奶仔、无花果、天仙子,是桑科榕属植物,原分布于地中海沿岸,唐代传入我国,今南北方均有种植,尤以新疆最多。无花果果实皮薄无核、香甜可口,其果实、根和叶均具有极高的药用价值和营养价值。无花果具有健胃清肠、消肿解毒、润肺止咳、清热生津、健脾轻泻等功效[1]。现代药理研究表明,无花果富含多种生物活性成分,如无花果多糖、黄酮类化合物、多酚类化合物、花青素、补骨脂素和微量元素维生素C、维生素E、硒等,同时还具有抗肿瘤[2]、抗氧化[3]、抑菌作用[4]调节免疫等功能[5-6]。
多糖是由许多相同或不同的单糖以α或β糖苷键所组成的大分子化合物,广泛存在于动物细胞膜和植物细胞壁中,具有多种生物活性。如菌类多糖具有促进胰岛素分泌从而降血糖的作用;部分中草药多糖具有调节巨噬细胞体积从而增强机体免疫力的功能;有些多糖可以诱导肿瘤细胞分化凋亡从而起到抗肿瘤作用[7-8]。
由于植物细胞壁比较牢固,需进行破壁处理,且植物种子常含有较多的脂质或蛋白,需去除杂质。植物多糖的提取方法有多种,如热水浸提法、酶解提取法、有机溶剂浸提法、微波-超声波辅助法和超临界萃取法等。其中微波辅助提取法的原理是频率为300~300000 MHz 电磁波具有超强的穿透能力,微波进入细胞后将能量迅速传递给溶剂分子和细胞内部,使细胞内部温度上升、压力变大,当压力超过细胞壁最大承受能力时,细胞壁发生破裂,从而释放出细胞内的有效成分,溶解到溶剂里[9-10]。微波辅助提取法相比于传统的溶剂提取法具有提取效率高、溶剂用量少、提取速度快、无污染等优点,因而被称为“绿色提取工艺”[11]。在无花果多糖提取工艺的相关研究中,微波辅助法研究相对较少。
本文研究了无花果多糖微波辅助提取的最佳工艺,在单因素的基础上进行正交试验设计,优化得到无花果多糖的最佳提取条件,进而为相关研究提供参考。
1 材料与方法
1.1 原料
无花果果实,市售,来自新疆阿图什。选择适当成熟,新鲜无损坏的果实。洗净在70~80 ℃的烘箱中干燥3 d,用磨机研磨并过60 目筛,装入密封袋中,储存在干燥和避光处,备用。
1.2 主要仪器设备
H8048 型微波萃取仪,邢台智冠机械科技有限公司;FW-80 型研磨机,北京兴时利和科技发展有限公司;DHG-9053A 型台式鼓风干燥箱,无锡玛瑞特科技有限公司;PSB200 型试验室离心机,苏州优格曼机械有限公司;HH-4 型数显恒温水浴锅,常州国华电器有限公司;UV-2102C 型紫外可见分光光度计,上海仪天科学仪器有限公司。
1.3 试验方法
1.3.1 多糖的提取及测定
取适量干燥的无花果粉末,用蒸馏水浸泡1 h,采用试验设定的不同微波功率、水料比、温度和时间进行多糖提取。提取液过滤除去碎屑,离心处理15 min,转速为4500 r/min,将得到的上清液进行真空浓缩至原体积的1/4 左右,然后在浓缩液中加入3 倍浓缩液体积的60%乙醇,4 ℃冷藏放置10 h,再次离心处理15 min,转速为4500 r/min,得到的沉淀即为粗多糖。然后,使用Sevage 法[12]去除粗多糖中的蛋白质,得到无花果多糖。
采用苯酚-硫酸法[13]进行多糖提取率的测定,以葡萄糖为标准品绘制标准曲线,测定无花果多糖含量,并按照以下公式计算:

1.3.2 单因素试验设计
1.3.2.1 微波功率对无花果多糖提取率的影响
称取适量无花果多糖干粉,按水料比40 mL/g 加入蒸馏水,搅拌均匀,在温度70 ℃条件下处理40 min,微波功率分别为300 W、400 W、500 W、600 W 和700 W,试验结束后测定无花果多糖含量。
1.3.2.2 水料比对无花果多糖提取率的影响
称取适量无花果多糖干粉,分别按水料比10 mL/g、20 mL/g、30 mL/g、40 mL/g 和50 mL/g 加入蒸馏水,搅拌均匀,在温度70 ℃、微波功率600 W条件下分别处理40 min,试验结束后测定无花果多糖含量。
1.3.2.3 温度对无花果多糖提取率的影响
称取适量无花果多糖干粉,按水料比40 mL/g 加入蒸馏水,搅拌均匀,在微波功率600 W 条件下处理40 min,温度分别为50 ℃、55 ℃、60 ℃、65 ℃和70 ℃,试验结束后测定无花果多糖含量。
1.3.2.4 时间对无花果多糖提取率的影响
称取适量无花果多糖干粉,按水料比40 mL/g 加入蒸馏水,搅拌均匀,在温度70 ℃、微波功率600 W条件下分别处理20 min、30 min、40 min。
1.3.3 正交试验设计
根据单因素试验结果,以微波功率(W)、水料比(mL/g)、温度(℃)和时间(min)4 个因素为研究对象,以无花果多糖提取率为评价指标,设计四因素三水平正交试验,确定无花果多糖最佳提取条件。
1.3.4 数据处理
采用Microsoft Office Excel和SPSS 20.0进行数据处理。
2 结果与讨论
2.1 单因素试验
2.1.1 微波功率对无花果多糖提取率的影响
微波功率有助于植物细胞壁破碎,有助于多糖溶出,提高多糖的提取率。但是,当微波功率过大时,会引起部分多糖的降解,从而降低多糖的提取率。由图1 可知,无花果多糖提取率随微波功率变化而变化,当微波功率为600 W 时,多糖提取率达到最高值;当微波功率为700 W 时,多糖提取率略有下降。因此,选择微波功率500 W、600 W 和700 W 作为正交试验设计的因素水平。
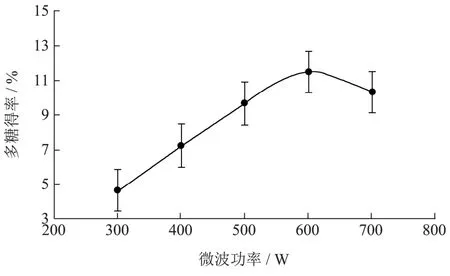
图1 微波功率对无花果多糖提取率的影响Fig.1 Effects of microwave power on the yield of Ficus carica polysaccharides
2.1.2 水料比对无花果多糖提取率的影响
水料比是提取过程中一个重要影响因素。当溶质与溶剂的浓度差越大,则传输动力越大,扩散到溶剂中溶质越多,但水料比过大后对多糖提取率无显著影响[14-15]。由图2 可知,无花果多糖提取率随水料比的增加而上升。当水料比从10 mL/g 增加到50 mL/g 时,多糖提取率呈不断上升趋势;当水料比为50 mL/g 时,多糖提取率增加不明显。因此,选择水料比30 mL/g、40 mL/g 和50 mL/g 作为正交试验设计的因素水平。

图2 水料比对无花果多糖提取率的影响Fig.2 Effect of water to material ratio on the extraction rate of Ficus carica polysaccharides
2.1.3 温度对无花果多糖提取率的影响
提取温度对多糖提取率具有较大影响。随着温度的升高,多糖溶解性和扩散性增强,有利于多糖的溶出,但温度过高会使多糖降低部分活性,从而降低多糖提取率[16]。由图3 可知,无花果多糖提取率随温度升高而变化。当温度为65 ℃时,多糖提取率达到最高值;当温度为75 ℃时,多糖提取率略有下降。因此,选取60、65 和70 ℃作为正交试验设计的因素水平。

图3 温度对无花果多糖提取率的影响Fig.3 Effects of temperature on the yield of Ficus carica polysaccharides
2.1.4 微波时间对无花果多糖提取率的影响
在相同的微波功率下,时间延长有助于植物细胞破碎,亦有助于植物多糖溶出。同时,处理时间过长会使多种成分溶出,降低多糖的溶出率[17]。由图4 可知,无花果多糖提取率随微波时间的延长而变化。当微波时间为50 min 时,多糖提取率达到最高值;当微波时间为60 min 时,多糖提取率略有下降。因此,选择微波时间为40 min、50 min 和60 min 作为正交试验设计的因素水平。

图4 时间对无花果多糖提取率的影响Fig.4 Effects of microwave time on the extraction rate of Ficus carica polysaccharides
2.2 正交试验
根据单因素试验结果,设计四因素三水平正交试验,优化无花果多糖最佳提取条件。正交试验因素水平如表1 所示。正交试验结果见表2。
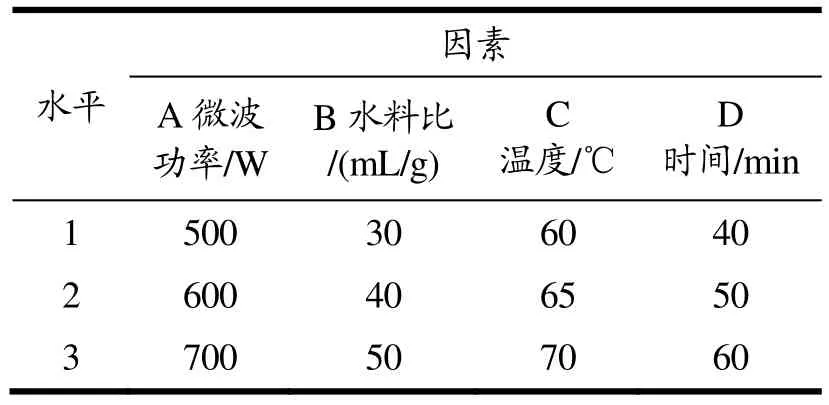
表1 正交试验因素水平表Table 1 Factors and levels in orthogonal test

表2 正交试验结果Table 2 Orthogonal test results
由表2 可知,R 值越大,表示因素对评价指标的影响越大。各因素对多糖得率影响的主次顺序为A>D>B>C,即微波功率>时间>水料比>温度。最佳提取条件组合为A2B2C3D1,即微波功率600 W、水料比40 mL/g、温度70 ℃和时间40 min,该条件下多糖得率为12.17%。采用最佳提取条件进一步验证正交试验结果,重复测定3 次,实际测得多糖得率为12.05%,与预测值误差较小。因此,此正交设计能够预测试验的最佳条件。
目前,无花果多糖的提取方法有多种,如水提法、酶提法、微波辅助法、超声波辅助法、微波-超声波联合法、超临界萃取和亚临界水法提取等,其中无花果多糖的微波辅助提取方法相关研究较少。
王振斌等[18]研究了水提法提取无花果多糖,通过单因素和正交试验设计,得到无花果多糖提取的最优条件为提取温度100 ℃,料液比1:12(g/mL),浸提2 次,每次浸提3 h,其水溶性多糖提取率达8.52%。叶文斌[19]采用响应面试验设计对酶法提取无花果多糖提取工艺进行优化,得到最佳工艺条件为酶解温度50.36 ℃,酶用量0.06 g 和pH 4.73,多糖得率为34.13%。
余希成等[20]利用超声波辅助法提取无花果多糖,通过单因素和正交试验设计,得到最佳提取参数为浸提温度55 ℃、浸提时间20 min、料液比1:20(g/mL),提取率为4.82%。赵群等[21]探讨了响应面法优化超临界CO2提取无花果多糖的条件,得到最优条件组合为温度78.5 ℃,压力33.4 MPa,时间96.2 min,重复测定三次多糖的平均得率为17.31%,与预测值17.36%无显著差异。沙坤等[22]使用响应面分析法优化亚临界水法提取无花果多糖的工艺条件,得到最佳工艺条件为提取时间为17 min,提取温度为150 ℃,液料比为30 mL/g,提取压力为1.5 MPa,并在该工艺条件下对模型参数进行验证,多糖提取率达56.48%。
刘娅等[23]采用二次回归正交旋转组合试验对微波辅助提取无花果多糖的工艺条件进行优化,得到最优条件组合为pH 8.2,时间20.1 min,微波功率556 W,料液比为1:10.2(g/mL),多糖得率为27.6%。赵丛枝等[24]通过单因素和正交试验研究了微波辅助提取无花果干多糖的方法,得出最佳提取条件为料液比1:50(g/mL),浸泡时间60 min,微波功率640 W,微波时间3 min,在该条件下,无花果多糖得率为4.65%。刘焕燕等[25]通过单因素试验和正交试验优化了微波辅助法提取无花果叶中补骨脂素的工艺,得到最佳工艺条件为乙醇浓度20%、提取时间6 min、微波功率420 W、料液比1:20(g/mL),补骨脂素的得率为3.69%。结果表明,微波辅助提取工艺合理、提取率高,应用前景广阔。
本文采用单因素和正交试验设计,优化了微波辅助提取无花果多糖工艺相关参数,得到了无花果多糖微波辅助法的最佳提取条件为微波功率600 W,水料比40 mL/g,温度70 ℃和时间40 min,该条件下多糖得率为12.17%,验证试验实际测得多糖得率为12.05%。
与传统的水提法相比,微波辅助法有助于提高无花果多糖的提取率;与酶解法相比,微波辅助法多糖提取率较低,生物酶活性受多种因素影响,需严格控制条件方能提高多糖提取率;与超声波辅助法相比,微波辅助法有助于提高无花果多糖的提取率,超声波辅助法常常与化学溶剂提取法联用,进而提高植物多糖的提取率;与新型植物多糖提取法,如超临界萃取和亚临界水相比,微波辅助法多糖提取率较低,但新型提取技术成本高耗能大,还需要更多的研究,目前不能工业应用。与刘娅[23]和赵丛枝[24]等微波辅助提取法研究相比,多糖得率具有差异性。由于无花果品种、提取条件及考察因素的不同,如pH、温度和浸泡时间,对无花果多糖的溶出均产生不同影响。所以,还需进一步增加考察因素研究其更优的提取条件。因此,微波辅助法有助于提高无花果多糖的提取率,正交设计试验能够预测无花果多糖提取的最佳条件。
3 结论
本研究采用单因素试验和正交试验设计,考察了微波功率、水料比、温度和时间对无花果多糖提取率的影响,得到了无花果多糖微波辅助法的最佳提取条件为微波功率600 W、水料比40 mL/g、温度70 ℃和时间40 min,实际测得该条件下多糖得率为12.05%。其中微波功率是影响多糖得率的主要因素,其次为时间、水料比和温度。结果表明,微波辅助法和正交试验设计可以应用于无花果多糖提取,进而为相关研究提供参考。

