不同水分稻谷中真菌群落结构及多样性的差异分析
李欣蔚
(辽宁省粮食科学研究所,辽宁沈阳 110032)
稻谷是我国主要粮食作物。在我国每年都会有大量的稻谷进入仓库储藏[1]。稻谷一般储备轮换年限是3年[2],稻谷在收获后,经过预处理后转入粮库储藏,其本身会伴有杂质、田间菌和霉菌孢子。目前,受新冠肺炎疫情的影响,已有多个国家宣布限制粮食出口,使全球粮食供应遭遇挑战,粮食安全储藏的重要性更加突出[3]。在储藏环节,稻谷的储存环境并非孤立不动的而是在不断变化的,真菌菌群结构会随环境变化而改变。霉菌在环境条件适宜时会大量生长、繁殖,产生毒素,残留在稻谷中对人体危害极大[4-5]。
水分和温度是霉变过程中的重要制约因素。此前关于霉菌对稻谷储藏的危害已被广泛报道,但是水分和温度如何影响稻谷的真菌群落结构进而影响霉变进程还尚未得到确认。传统的平板分离法需要对样品进行微生物的分离、纯化、接种再培养分析,其中可培养的微生物只占总微生物的不到10%。因此对于稻谷中的真菌群落结构及多样性的探究,传统的平板分离法不能够实现[6-7]。而以样品中提取的全部微生物DNA 为研究对象的高通量测序技术可以提供更加可靠的技术支持[8]。高通量测序技术采用大量构建宏基因文库,利用分子生物学信息比对手段,研究样品中宏基因组中所包含的全部微生物信息,如微生物的遗传组成以及微生物的菌群结构、群落功能等,因此可以全面反映微生物群落组成情况及多样性。目前已广泛应用于海洋[9-10]、肠道[11-12]、土壤[13-14]、粮食作物[15]、食品饮料[16-17],甚至动物表皮[18]等不同生态类型的微生物群落结构剖析,在农业、食品、医疗等领域发挥着重要作用[19]。因此,本研究以不同水分含量的新收获东北早粳稻稻谷作为研究对象,探究入仓储藏前不同水分稻谷真菌群落的原始状态,确定两种水分稻谷中的特征菌属以便更有针对性的控制储藏条件,为探寻稻谷储藏过程中的霉变机制提供基础依据。
1 材料与方法
1.1 材料与试剂
以东北早粳稻稻谷作为研究对象,对新收获的高水分早粳稻进行自然晾干,通过水分测定仪测定选取稻谷水分在14.5%~15.5%的稻谷HW 和水分含量在13.5%~14.5%稻谷样品LW。两种水分稻谷各取样150 g,各自称取50 g 于无菌均质袋中作为3 个平行样品,分别记为HW1、HW2、HW3、LW1、LW2、LW3,于实验室中4 ℃保存。
1.2 试验方法
1.2.1 样品基因组DNA 提取及PCR 扩增
取样品25 g 于225 mL 无菌水的锥形瓶振荡30 min→10-1稀释液→提取菌液的总DNA→纯化→符合测序要求的总DNA
采用50 μL 反应体系中进行扩增,反应完成后利用琼脂糖电泳进行检测,并均一化处理。标准真菌ITS1 区片断长度250 bp,上游引物名称:ITS5F;上游引物序列:GGAAGTAAAAGTCGTAACAAGG;下游引物名称:ITS1R ;下游引物序列:GCTGCGTTCTTCATCGATGC。
1.2.2 ITS 1 区高通量测序
采用Miseq-PE250 测序平台,利用Illumina 公司的TruSeq Nano DNA LT Library Prep Kit 制备测序文库。将合格的各上机测序文库梯度稀释后,根据所需测序量按相应比例混合,并经NaOH 变性为单链进行上机测序。
1.2.3 数据分析
使用MiSeq 测序仪进行双端测序,利用QIIME2 dada2 分析软件、Vsearch 软件进行序列去噪和OTU聚类,利用QIIME2、R 语言ggplot2 包进行Alpha 多样性、Beta 多样性分析以及分类学组成分析,利用R脚本、VennDiagram 包、plotrix 包制作OTU 韦恩图和PCA 主成分分析,利用R 脚本、pheatmap 包绘制聚类热图。
2 结果与分析
2.1 样本数据统计
首先对原始数据进行筛选得出优化序列,以保证分析结果的质量。使用R 语言脚本,对全部样本中所包含的高质量序列的长度分布进行统计。6 份稻谷样品所产生的有效序列数量如表1 所示,其中有154850条有效序列长度为226,有194369 条有效序列长度为259,如图1。

图1 稻谷序列长度分布图Fig.1 The length distribution chart of the optimized sequence

表1 稻谷的测序数据Table 1 High-throughput sequencing data of paddyrice
样品的丰度等级曲线是将样本中的OTU 按其丰度大小沿横坐标依次排列,并以各自的丰度值为纵坐标,从而反映各样本中OTU 丰度的分布规律。如图2,每条折线代表一个样本,折线在横轴上的长度反映了该样本在该丰度中OTU 数。折线的平缓程度,反映了群落组成的均匀度:折线越平缓,则群落中各OTU 间的丰度差异越小,群落组成的均匀度越高;折线越陡峭,则均匀度越低。与低水分稻谷样品LW相比,高水分稻谷样品HW 曲线水平跨度大,真菌菌群的丰度较高,折线较平缓,真菌菌群组成的均匀度较高。

图2 稻谷的丰度等级曲线Fig.2 Rank abundance curve of the rice
2.2 不同水分稻谷样品的分类学注释分析
利用分析软件QIME2,选用UNITE 数据库(Release 8.0,https://unite.ut.ee/)[20],将两种水分的稻谷样品在各分类学水平的鉴定结果绘制成柱状图,可以直观的比较出高水分稻谷和低水分稻谷样品中OTU 数和分类地位鉴定结果的差异,如图3。6 份样品在门水平注释的柱型越短,而在属、种水平注释的柱型越长,表明所有样品注释的分辨率越高,可以在各分类学水平进行横向对比和分析。由图中可知,不同水分稻谷中的真菌群落共计属于2 个门、26 个纲、51 个目、85 个科、112 个属、188 个种。

图3 稻谷的分类学注释结果统计图Fig.3 Statistical chart of rice in annotation taxonomy
2.3 不同水份稻谷中丰富度和多样性指数性分析
为了能够较为全面的评估样品中真菌菌群的Alpha 多样性,本实验以Chao1[21]和Observed species指数表征样品真菌菌群丰富度,以Shannon[22]和Simpson[23]指数表征多样性,以Pielou’s evenness[24]指数表征均匀度,以Good’s coverage[25]指数表征覆盖度,详见表2。6 份稻谷样本的Coverage 指数均达到0.99,说明测序结果的覆盖度符合要求。高水分组的三份稻谷样品(HW1-HW3)的Chao1 指数和Simpson 指数均高于低水分组(LW1-LW3),说明在高水分稻谷样品中具有较高的真菌菌群物种多样性。高水分组的稻谷样品的Observed species 指数也均高于低水分组,说明在高水分组的稻谷中真菌菌群的丰富度高于低水分组,高水分稻谷更适宜真菌菌群的生长繁殖。

表2 Alpha 多样性指数表Table 2 The table of Alpha diversity indexes
2.4 不同水份稻谷中真菌在不同分类水平下的组成差异分析
如图4 两种水分稻谷中真菌群落在门的水平上分类为子囊菌门Ascomycota 和担子菌门Basidiomycota。在高水分稻谷中,子囊菌门Ascomycota 丰度为56.96%,担子菌门Basidiomycota 的丰度为7.41%。在低水分稻谷中分别为51.37%和2.898%。

图4 在门的水平下的组成差异Fig.4 Composition differences at the level of the phylum
两种水份稻谷中真菌在属的水平上的组成和数量差异统计结果如图5。由图中可知,在属的水平上两种水分稻谷中丰度水平较高的20 个菌属分别为:隐球菌属Cryptococcus、雪霉叶枯菌属Microdochium、镰刀菌属Fusarium、红冬孢锁掷孢酵母菌属Rhodosporidiobolus、Bulleromyce、帚枝霉属Sarocladium、Symmetrospora、Dioszegia、红色掷孢酵母菌属Sporobolomyces、Kondoa、Setophoma、盾壳霉属Coniothyrium、亚隔孢壳属Didymella、线黑粉酵母属Filobasidium、莫氏黑粉菌属Moesziomyces、弯孢属Curvularia、球腔菌属Mycosphaerella、Papiliotrema、Neosetophoma、链格孢属Alternaria。其中链格孢属Alternaria真菌在两种水分稻谷的样品中丰度最高,但是高水分稻谷中的链格孢属Alternaria真菌含量为45.11%高于低水分稻谷组中含量24.18%。链格孢属Alternaria真菌属有丝分裂孢子真菌类群丝孢纲丝孢目,是引起植物病害的重要真菌类群之一[26]。结果表明,两种水份的稻谷在田间已受到链格孢属Alternaria真菌的侵害。而弯孢属Curvularia病原菌会引起谷物类作物斑点性、叶枯性病害,属田间有害真菌。

图5 在属的水平下的组成差异Fig.5 Composition differences at the genus level
此外,在高水份稻谷中含量较高的真菌为隐球菌属Cryptococcus0.07%,球腔菌属Mycosphaerella2.21%,Papiliotrema3.81%,Filobasidium1.17%。其中球腔菌属Mycosphaerella属球腔纲、座囊菌目,是多种农林植物的病原菌,可引起植物组织坏死,产生病斑[27]。Papiliotrema为新型担子菌类的酵母菌,银耳亚纲。这类酵母菌的生理特性表现出很高的变异性,因此,应用传统的纯化分离实验很难区分与之亲缘关系相近的物种。Yurkov Andrey M 等人在美国明尼苏达州的野生玉米、稻谷及其所生长的土壤中进行采样,并对其中的酵母菌进行鉴定,对其中的Papiliotrema菌株在GeneBank 中进行了序列注释和命名[28]。本研究也进一步证实了该种酵母菌在新收获的稻谷中可以大量存在。线黑粉酵母属Filobasidium为丝状黑粉菌属,属担子菌门,大部分为有分隔的丝状菌体。
2.5 不同水分稻谷中真菌的物种组成及丰度热图
为了进一步比较不同水分稻谷的物种组成差异,实现对各样本的物种丰度分布趋势的展示,可以使用热图进行物种组成分析。研究中,一般常使用属水平的分类单元组成作为分析对象,因此我们默认使用平均丰度前50 位的属的丰度数据绘制热图。热图的横、纵坐标可以按照特定的顺序进行的排列,如按照分类群的平均丰度、样本的采集时间等进行排序;也可根据类群间或者样本间的相关性绘制聚类树排序,即绘制聚类热图,如图6。可以看出,不同水分稻谷中真菌的物种组成及其丰度差异较大,高水分稻谷和低水分稻谷的真菌群落组成和优势菌属具有显著差异。在高水分稻谷中优势菌属为Papiliotrema34.56%、Sporobolomyces2.12%、Dioszegia0.47%、Rhodosporidiobolus0.83%、Kondoa0.22%、Symmetrospora0.14%、Mycosphaerella2.24%、Fusarium0.86%、Filobasidium1.17%、Bulleromyce0.15%、Coniothyrium0.38%、Curvularia2.38%、Cryptococcus0.49%。而低水分稻谷中优势菌属为Neosetophoma0.14%、Moesziomyces1.03%、Microdochium0.07%、Didymella0.06%、Setophoma0.03%。高水分稻谷的优势菌属在物种分布和物种丰度上都高于低水分稻谷,真菌群落结构更加丰富且存在较多优势菌群。这表明在稻谷的生长及收获过程中,稻谷的水分含量直接决定了其产后过程中所携带的真菌群落组成。

图6 不同水分稻谷中真菌物种组成热图Fig.6 The heatmap of the fungi communities in rice with different moisture content
2.6 不同水分稻谷真菌群落差异分析
通过Ven 图进行群落分析,可以探究不同样本间共有物种和独有物种。通过ASV/OTU 丰度表制作韦恩图,并根据其在各样本间的有无情况分别统计各个集合的成员数,即ASV/OTU 的个数。如图7 所示,将高水分组(HW1、HW2、HW3)和低水分组(LW1、LW2、LW3)分别混合成高水分HW 和低水分LW 进行群落分析,可以发现低水分稻谷LW 具有的特性OTU 数量最多,为96 个;而高水分HW 中具有的特性OTU 数量为64 个。两个样本间共同具有的OTU数量较多,为72 个。由此可见,两种水分的稻谷真菌群落存在很多相同物种,而群落间物种丰富度存在差异。

图7 不同水分稻谷样品比较Ven 图Fig.7 The Ven plot of the samples
为了进一步探究Ven 图中各个区域的物种丰度,在门和属的水平上统计每个区域相应的OTU 丰度,并以柱状图进行展示,如图8。横坐标为对应于韦恩图不同区域的OTU 集合,LW-HW 为两组样本间的共有OUT,纵坐标为属于不同门(左图)和属(右图)的OTU 丰度的百分比例,不同的分类单元以不同颜色标识。可以看出,在门的水平上,Basidiomycota 门在高水分稻谷中存在数量较高,OTU 丰度为54.3%,是高水分稻谷中真菌群落的优势菌门。Ascomycota 门在低水分稻谷中存在数量较高,OTU 丰度为63.2%,为低水分稻谷中真菌群落的优势菌门。在属的水平上默认取样本平均序列丰度最高的前10 个属进行展示,分别为Sarocladium3.38%、Filobasidium4.53%、Curvularia2.12%、Mycosphaerella7.63%、Vishniacozyma5.24%、Aspergillus3.12%、Alternaria3.07%、Kondoa8.81%、Papiliotremam 6.67%、Neosetophoma7.34%。高水分稻谷中的特定菌属为Filobasidium、Sarocladium、Mycosphaerella。由此可见,不同水分稻谷中尽管存在大量相同物种,但物种间丰富度存在差异,且高水分稻谷中存在的真菌菌种在种类和数量上要高于低水分稻谷。而由于高水分稻谷中存在大量特定菌属是低水分稻谷中不存在的,因此可以认为,在一定范围内降低稻谷水分可以抑制Filobasidium、Sarocladium、Mycosphaerella的生长。
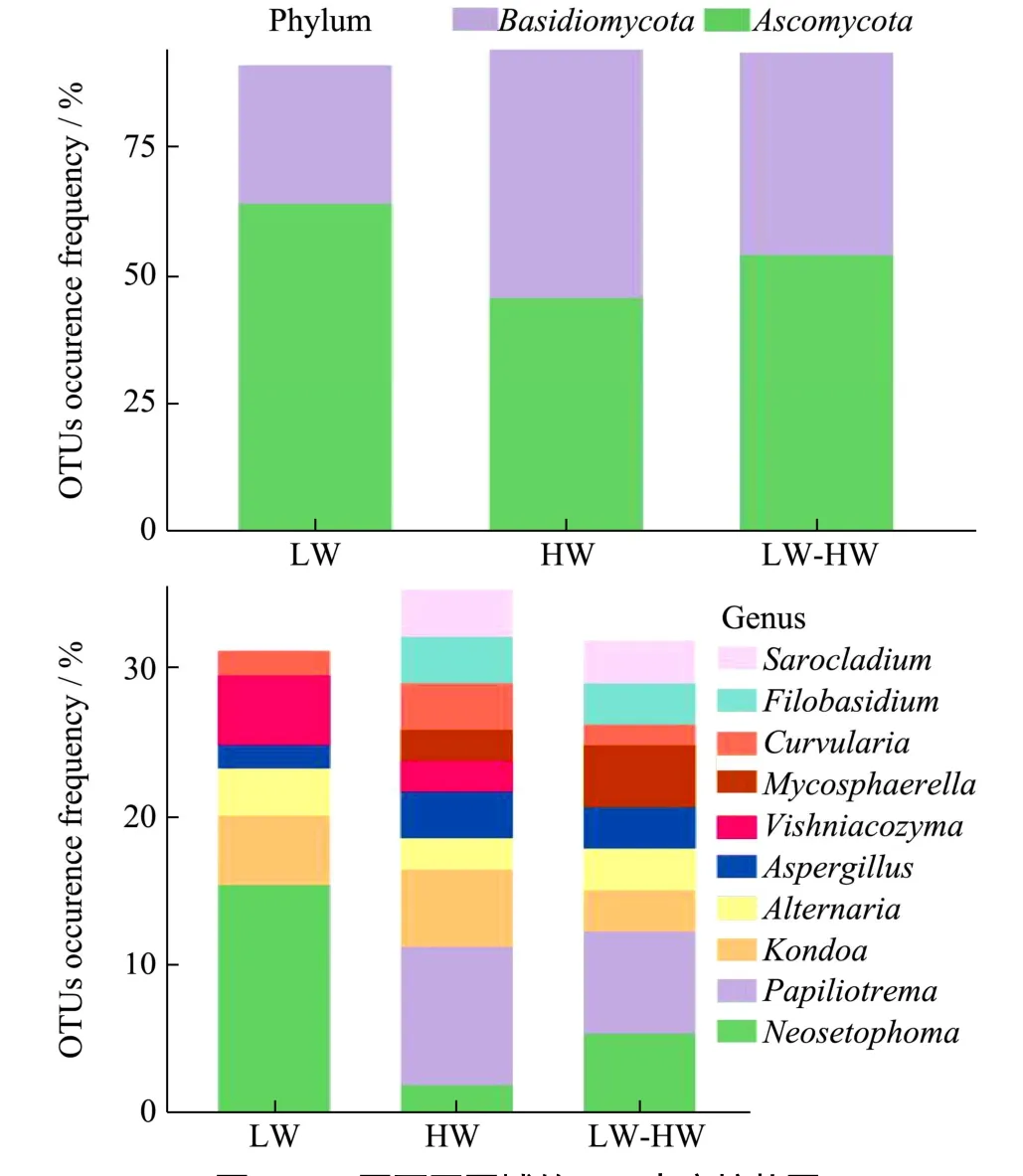
图8 Ven 图不同区域的OTU 丰度柱状图Fig.8 The histogram of the Ven plot of OTU abundance in different regions
2.7 Beta 多样性分析
依据Ramette[29]的方法对两种水分的稻谷进行PCA 分析(Principal Component Analysis)。PCA 分析是基于物种丰度矩阵做降维处理,因此物种数越多即维度越高,其损失的信息就越多,特别是那些低丰度物种的差异信息。因此,相比于样本中的ASV/OTU数目,由于损失的信息较多,在特定分类水平下(如属)的物种数就会减少很多。依据各样本在主成分指标上的得分对其进行排序,便可以量化展示样本间物种组成的差异程度,所以应用PCA 分析可以对物种组成相对简单的研究样本进行样本间的物种丰度组成差异分析。如图9,由右侧图中可以发现高水分稻谷和低水分稻谷中真菌群落有一定的重叠,主要集中在弯孢霉属Curvularia、链格孢属Alternaria,其余部分位置相对分散,高水分稻谷中真菌群落集中在Curvularia、Alternaria,低水分稻谷中真菌群落主要集中在Neosetophoma、Curvularia。我们将两种水分稻谷中真菌的物种丰度组成以主成分为Neosetophoma和链格孢属Alternaria为横纵坐标作降维处理,可以看出两种水分稻谷中真菌物种的丰度组成在Neosetophoma维度差异为12.6%,而在链格孢属Alternaria维度的差异为84.4%。说明两种水分的稻谷中Neosetophoma菌属的物种组成差异较小,而两者在链格孢属Alternaria的物种组成差异较大。因此,链格孢属Alternaria及其分支是两种水分稻谷中显著差异的生物标识。

图9 不同水分稻谷中真菌的主成分分析图Fig.9 Principal component analysis of mould in rice with different moisture content
3 讨论
3.1 水分对稻谷真菌群落多样性的影响
采用从 Chao、Shannon、Simpson、Observed species、Pielou’s evenness、Good’s coverage(表)6 个多样性指标变化可知,在高水分稻谷中真菌菌群的物种多样性更高,而低水分稻谷中的真菌多样性较差。这表明水分在真菌菌群生长繁殖过程中发挥着重要作用,影响了真菌菌群的丰富度及多样性。有研究表明在不同的储粮生态区,东部、中部和西部市县的储粮带菌量呈现逐渐降低的关系,菌量与含水量呈正相关关系[30],与本实验相比,所得研究结果一致。
3.2 水分对稻谷中真菌群落结构及组成的影响
在我国,稻谷收获后进入储藏和运输前通常会采用自然晾晒或干燥等手段来降低其含水量,《中国人民共和国国家标准-稻谷GB 1350(安全储藏和品质)》中对粳稻稻谷进入储藏前的水分及品质进行了分级,规定稻谷水分≤14.5%为安全水分。而通过本实验研究表明,降低了粳稻的水分含量,不仅降低了真菌菌落的多样性,而且在属的水平上降低了隐球菌属Cryptococcus、Papiliotrema的含量。而Filobasidium、Sarocladium、球腔菌属Mycosphaerella在低水分稻谷中不存在则表明这几类菌属对水分变化的敏感性较高。其中Papiliotrema是一种金黄色蝶形担孢酵母,可以利用不同碳源进行发酵[31]。而隐球菌属Cryptococcus属于油脂微生物,在培养条件中碳源充足而氮源缺乏时,代谢活动转为以消耗碳源并合成和积累油脂为主,将过量的碳水化合物转化为油脂[32]。由于在高水分稻谷中以上两类菌属的含量较高,随着储藏时间的延长高水分稻谷中的碳水化合物含量将会降低,脂肪酸值将会升高,稻谷的食用品质也会随之受到影响。这与周建新[33]等人储藏温度越高,稻谷含水量越大越容易发生霉变的研究结果相一致。因此,在稻谷入仓前合理的调控水分,对改善稻谷品质具有积极意义。
除此以外,霉菌的菌群结构变化与产区、储藏环境等因素有关。以印度20 个稻谷种植州收集的1200个稻谷和大米样品为研究对象,通过传统培养法和分子生物学手段进行检测,发现所有稻谷均可检出曲霉,其中黄曲霉、黑曲霉、赭曲霉Aspergillus ochraccus及寄生曲霉是鉴定出的四种曲霉,不同地区曲霉的污染情况存在种类差异;通过对所有霉菌数量进行统计,发现黄曲霉和黑曲霉是储藏期间的优势菌群[34]。以尼日利亚州的稻谷为研究对象进行霉菌检测时发现,稻谷受到污染的主要真菌属为:曲霉属、青霉属、镰刀菌属、链格孢菌属、白霉属、根霉属、木霉属、弯孢属、长蠕孢属、枝孢属。其中霉菌菌种数量排序由高到低依次是青霉菌、黄曲霉、寄生曲霉菌Aspergillus parasiticus、黑曲霉、毛霉Mucor、根霉Rhizopus、交链孢霉Alternaria[35]。这与本研究所得优势菌属基本一致,而不同之处在于本试验采用高通量测序技术,因此检测出稻谷中大量真菌群落结构信息以及一部分尚未被分类命名的菌种。尽管通过高通量测序得到很多的真菌种类,但是也只有少数真菌会在储藏过程中生长发育,并在一些特定的外部条件作用下才会产生不良的影响[36]。
4 结论
由于稻谷在收获和运输过程中,与土壤、空气、水等自然物质和机械接触,携带大量的微生物进入储藏期。因此,探究不同水分稻谷进入储藏前真菌群落的原始状态,可以为我们更准确的分析稻谷储藏期间的真菌菌群变化规律提供依据。本研究通过对测序数据的比对分析,初步明确了北方早粳稻在进入储藏前由于水分含量的不同其真菌菌群结构及多样性的异同,进一步探讨了水分在影响真菌群落生长的重要作用,同时筛选出一些具有显著差异的特征菌属,如Filobasidium、Sarocladium、Mycosphaerella,不仅对水分含量敏感性较高,同时也具有利用碳源进行发酵产酸的生物学功能。研究结果可以为不同水分稻谷进入储藏阶段菌群变化情况提供比对依据,同时也进一步为防霉体系的建立提供理论支撑。

