MDCK过表达SV40-LT基因稳定细胞系的构建
刘文凯,田 玲,乔自林,王家敏,王明明,李 铀*
(1.西北民族大学 生物医学研究中心 甘肃省动物细胞技术创新中心,甘肃 兰州 730030;2.西北民族大学 生物医学研究中心 生物工程与技术国家民委重点实验室,甘肃 兰州 730030;3.西北民族大学 生命科学与工程学院,甘肃 兰州 730100)
体外培养的细胞增殖能力十分有限,细胞的每次分裂都会造成端粒缩短,最终达到“Hayflick界限”,在大约60个PDs(群体倍增次数)后停止生长,当端粒太短而不能正常封顶时,复制性衰老(M1期,细胞生长停滞)就会发生[1]。细胞永生化可在M1期利用hTERT、病毒、放射性因素等阻止衰老,使细胞继续增殖[2]。细胞在经过20~30次的PDs后,进入危机期(M2期),端粒酶被激活并反转录DNA来延长端粒,使细胞越过M2期并无限增殖,从而变为永生化细胞[3]。
细胞衰老打开DNA损伤反应通路,肿瘤抑制因子p53被激活,进而导致细胞周期停滞。SV40属于猿猴病毒40,由结构蛋白(VP1,VP2,VP3)以及两种抗原(LT,st)构成[4],是建立永生化细胞系最直接的基因。SV40的表达可使LT与p53结合,从而致使p53失活,使其蛋白降解,最终有效促进细胞增殖并永生化。
1958年Madin和Darby从犬的肾脏中获得上皮细胞产生了MDCK细胞系[5],经检测MDCK细胞产毒效力较高,可适用于生产甲型及乙型流感病毒[6]。但MDCK细胞对脂质体转染的方式不够敏感,所以要利用SV40病毒介导的感染方式使其具有较高的转化率[7]。
本试验利用慢病毒将SV40-LT基因导入MDCK细胞,通过筛选检测到SV40-LT基因的表达,不仅探究了建立成熟永生化实验体系的过程,为后续原代永生化细胞系提供技术依据,而且提高了MDCK细胞的增殖能力,可为疫苗生产提供一定参考。
1 材料与方法
1.1 试验仪器
所用仪器包括生物显微镜、液氮罐、高压灭菌器、恒温水浴箱、冰箱、3 ml塑料细管、载玻片、盖玻片、10 ml移液管、CO2培养箱、共聚焦显微镜、基础电泳仪电源、小型转印槽、垂直电泳仪、细胞冻存盒、反转录试剂盒、总RNA提取试剂盒、DMEM/F12培养基、新生牛血清、0.25%胰蛋白酶、嘌呤霉素、SV40-LT病毒液,其余试剂均为实验室常规试剂。
1.2 细胞传代
按照细胞长势情况,加入5 ml新鲜培养基进行培养,待细胞生长至85%以上时进行传代培养,观察并拍照,记录细胞的生长形态与速度。重点记下F3、F10、F15代细胞的形态,并做生物学研究[8]。为了提高细胞的贴壁能力,可以先利用0.5 ml新生牛血清浸湿T25细胞培养瓶的底部,将培养瓶倒置放入CO2培养箱培养0.5 h。
传代时先对细胞瓶口消毒,倒去陈旧培养基,PBS溶液清洗3次后弃去,再向瓶内加入2 ml 0.25%胰蛋白酶,以覆满瓶底为限,置恒温培养箱中1~3 min。当发现细胞变圆、间隙变大后,弃去胰酶,用10 ml移液管缓缓吹打细胞底部把细胞吹下,形成细胞悬液[9]。按照1∶3的比例把细胞悬液分为3份加入细胞瓶中,并放在培养箱(37℃,5%CO2)中继续培养。
1.3 细胞冻存与复苏
冻存前24 h更换新鲜培养液,对数期细胞达到85%以上时进行细胞冻存,弃去培养基,加入PBS溶液清洗3次,加入胰酶消化1.5 min后,以800 r/min的速度离心10 min,弃上清液,加入2 ml冻存液,按照4℃ 0.5 h、-20℃ 1 h,-80℃过夜保存的顺序依次冻存,最终保存在液氮罐中[10]。
将冻存管放入37℃水浴箱中快速摇动,尽量在90 s内使细胞解冻,加入到2 ml无菌离心管中,以800 r/min的速度离心10 min,吸干上清液,加入1 ml新鲜细胞培养液使细胞悬浮,转移至T25细胞瓶中培养,再加入4 ml新鲜培养基,24 h后更换培养液去除漂浮的死亡细胞。
1.4 MDCK细胞嘌呤霉素筛选
选择生长状态良好的F3代细胞,以1×104/孔的细胞密度接种在24孔细胞培养板中。待细胞长至50%~60%时,弃去培养液,PBS溶液清洗3次,加入含有不同筛选浓度的培养基(含有嘌呤霉素和10%新生牛血清的DMEM培养液)[11],培养液中嘌呤霉素浓度为1~10 μg/ml。1 μg/ml为1个梯度,用培养液配置成不同的筛选浓度,每个浓度值设置3个重复孔、3个对照孔[12]。每2 d更换1次筛选培养基,在显微镜下观察并记录细胞生长状况,第4~7 d细胞全部死亡的最低浓度即为最小嘌呤霉素筛选浓度。
1.5 MDCK细胞感染SV40-LT病毒液
将复苏后的F3代MDCK细胞按照1×104/孔的细胞密度接种于24孔细胞培养板中,细胞汇合度为50%时,进行病毒感染。按照吉凯基因公司说明书以及MDCK细胞的moi值进行操作。设定moi值为100,根据细胞的moi数值和病毒滴度,加入SV40-LT病毒液,16 h后更换完全培养基,继续培养24 h后将细胞转移至细胞瓶中培养[13]。
1.6 阳性细胞筛选
感染SV40-LT病毒液的细胞加入4 μg/ml的嘌呤霉素筛选培养基,未感染的MDCK细胞也加入相同浓度作为对照[14]。每2 d更换1次筛选培养液,出现大量漂浮以及死亡细胞时,变为每日更换。4~7 d未感染的MDCK细胞死亡后,剩余感染SV40-LT病毒液的细胞即为阳性细胞。在筛选过程中首次长满T25细胞瓶时命名为F1代。感染SV40-LT基因筛选获得的细胞系命名为MDCK-SV40。
1.7 MDCK-SV40细胞中SV40-LT基因检测
将MDCK-SV40细胞F3代的总RNA进行抽提,按照RNA反转录试剂盒说明书进行操作,对抽提后检测合格的cDNA进行qPCR检测SV40-LT基因表达情况[15]。相应引物序列见表1。采用Real-time-qPCR检测SV40-LT的表达。引物序列应用Primer Primer 5.0软件设计,由北京擎科生物科技有限公司合成,内参为ACTB(肌动蛋白)。

表1 qPCR引物
1.8 细胞免疫荧光鉴定MDCK-SV40中的SV40-LT基因表达
将未感染的F3代MDCK细胞、F3代MDCK-SV40细胞分别以1×104个/孔接种于12孔板中,培养2 d进行免疫荧光试验。细胞长至70%时,PBST洗涤3次[16]。4%多聚甲醛固定爬片15 min。PBST洗涤3次,加入0.1%TritonX-100室温通透20 min。PBST洗涤3次,滴加山羊血清,37℃封闭30 min。弃去封闭液,滴加一抗并放入湿盒,4℃孵育过夜。PBST洗涤3次,加荧光二抗,37℃孵育2 h。PBST洗涤3次,滴加DAPI避光孵育5 min,吸干爬片上的液体,将爬片放置在滴有适量抗荧光淬灭剂的载玻片上,激光共聚焦拍摄。
2 结果
2.1 MDCK细胞传代培养的形态
观察细胞状态,消化后的细胞团块贴壁后进行生长,并逐渐铺满瓶底,呈铺路石状单层排布,在对数生长期呈火焰状生长,是典型的上皮样细胞(图1)。

图1 F3代MDCK细胞(×40)
2.2 细胞冻存与复苏
取3支冻存的MDCK细胞进行细胞活率测定,并计算其平均值,MDCK细胞冻存前平均活力为96.75%,冻存1个月后复苏,测得平均活力为93.28%,细胞活率有所下降,但对后续试验无实质性影响。
2.3 MDCK细胞嘌呤霉素筛选
F3代MDCK细胞经筛选培养后,第7 d细胞死亡的最低浓度为4 μg/ml(图2)。

图2 F3代MDCK细胞嘌呤霉素筛选(×40)
2.4 MDCK细胞感染SV40-LT病毒液及阳性细胞筛选
由图3可知,感染的细胞在经过72 h后于荧光显微镜下观察,感染率为50%~60%。筛选获得的MDCK-SV40细胞系已传至F15代。细胞均呈铺路石状排列,并单层生长,生长速度较快,按1∶3传代后2 d就可长满瓶底,未出现生长缓慢或漂浮死亡细胞,且未出现细胞衰老现象。
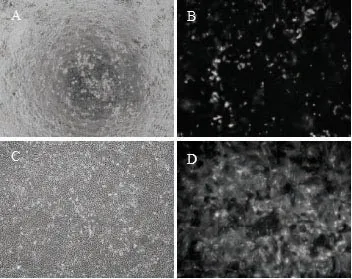
图3 MDCK-SV40细胞感染及阳性细胞筛选
2.5 MDCK-SV40细胞中SV40-LT基因检测情况
本试验通过qPCR法分析了F3代MDCKSV40细胞的表达情况,利用未感染F3代MDCK细胞作对照,结果显示MDCK-SV40相较于MDCK细胞中SV40-LT的基因表达差异显著(P>0.05,图4),表明SV40-LT基因在MDCK细胞中经慢病毒感染后成功表达,且传代后表达稳定。

图4 MDCK-SV40中SV40-LT的表达情况
2.6 MDCK-SV40细胞中SV40-LT的基因表达情况
通过免疫荧光染色法鉴定SV40-LT在MDCK-SV40细胞蛋白中的表达。结果表明,在F15代中,SV40-LT主要表达于MDCK-SV40细胞的胞质和细胞核周围,SV40-LT在MDCK和MDCK-SV40细胞核中的表达强弱不同。未感染的MDCK细胞表达为阴性,表明SV40-LT基因成功转入MDCK-SV40细胞中,并通过细胞转录翻译后稳定表达。

图5 细胞免疫荧光鉴定MDCK-SV40细胞中SV40-LT的表达(×40)
3 结语
季节性流感越发频繁,为适用于相同数量的预备疫苗,需要更快、产量更高的细胞以应对目前困境。流感病毒的生长环境依赖于合适的表面受体,在MDCK细胞中病毒复制优于其他受体。与鸡胚培养相比,MDCK细胞的病毒产量较高且具有更快的生产过程,是疫苗生产的优选宿主。
端粒酶是一种永生基因,其复合物可保持端粒长度,这是细胞增殖所必需的。p53是一种促进细胞周期阻滞、DNA修复、细胞衰老凋亡的转录因子,也是一种高度保守的抑癌基因。抑制p53通路即可诱导细胞无限增殖。SV40-LT可直接作用于p53使细胞永生化。
稳定的转染系统需借助病毒载体来敲低或过表达基因,嘌呤霉素可用于选择在这些系统中表达pac基因的感染细胞。本试验中通过不同梯度地筛选,确定MDCK的最小嘌呤霉素浓度为4 μg/ml,后续的阳性细胞筛选中也通过对照确定了经筛选后的细胞团。未挑取单克隆细胞,是考虑到细胞感染后状态较差,且单个细胞难以在短时间内大量增殖,从而影响后续鉴定。
MDCK细胞接种后1~6 h开始贴壁生长,细胞倍增时间约为30 h。相较之下,MDCK-SV40倍增时间明显缩短,生长速率加快,贴壁能力增强,表明SV40-LT对细胞有显著的增殖作用,且筛选后的F15代细胞仍呈铺路石状对数生长,增殖速度稳定,未出现生长缓慢或大量漂浮死亡的现象,现已传30多代。这些结果表明MDCK-SV40细胞系已成功构建。
本研究在MDCK-SV40细胞建系过程中,只采用了SV40-LT基因导入的方法,选择了2个形态、生长良好的克隆株进行连续传代培养,表明SV40-LT单基因导入MDCK细胞的方法是可行的。试验通过MDCK细胞感染SV40-LT基因,提高了细胞生长速度,为永生化细胞建系研究提供了技术依据。

