Graves病的手术前评估与准备(附126例报告)
孙寒星, 沈晓卉, 高浩基, 刘卓然, 陈 曦, 邱伟华, 严佶祺
(上海交通大学医学院附属瑞金医院外科,上海 200025)
Graves病(Graves′disease,GD)是一种自身免疫性疾病,由促甲状腺素受体自身抗体引起,导致甲状腺功能亢进(甲亢)[1]。目前,对于GD的治疗方式,主要包括抗甲状腺药物治疗、131I放射性核素治疗和外科手术治疗[2]。
相比常规甲状腺手术,GD术后并发症包括出血、声带麻痹、低钙血症等风险明显增加[3]。有的病人还需气管造口。因此,手术治疗GD需要明确的适应证,同时注意禁忌证。甲亢术前需行一系列术前评估和准备,以减少手术风险,降低术后并发症的发生率。现有的国内外指南共识对术前环节提出许多重要建议,但实际临床情况往往更复杂多变。本研究回顾我院近年GD外科治疗的经验,针对术前的评估与准备,总结临床经验。
资料与方法
一、一般资料
回顾2015年1月至2021年5月手术治疗的GD病例。所有病例经内分泌专科诊断与规范药物治疗。GD的诊断标准包括甲亢的症状和体征;超声检查显示甲状腺弥漫性肿大;甲状腺素水平升高,促甲状腺素降低;在此基础上伴有促甲状腺素受体抗体升高。选取病例资料完善、诊断GD、术前甲亢症状控制良好。共计126例,其中男27例,女99例,平均年龄(42.4±14.3)岁。收集基础情况、术前检验检查数据、术前准备与评估措施、手术方式、术后病理检查结果、术后并发症等临床资料。
二、术前一般准备
(一)症状控制
病人术前经规范药物治疗,症状及甲状腺功能控制满意。术前甲状腺素(T3、T4)、游离甲状腺素(FT3、FT4)、基础代谢率(basal metabolic rate,BMR)、心电图、肺功能及血气分析结果均处于正常范围。无不能耐受手术的其他临床情况。
(二)碘剂准备
术前根据体格检查与超声检查评估腺体肿大情况。对于腺体Ⅲ度肿大、气道受压狭窄、胸骨后甲状腺肿的GD病例,术前予以口服碘剂2周准备。
(三)影像学评估
术前常规完善超声检查,对于可疑结节,行细针穿刺活检;常规行电子喉镜检查,明确双侧声带活动功能;常规行颈部CT检查,评估腺体与周围毗邻关系,评估气道狭窄情况,筛查血管解剖变异。
(四)手术方式选择
根据术前评估结果,手术方式依据安全性及肿瘤根治的原则而定。对于单纯GD病例,术前超声检查未见可疑恶性结节,手术方式为甲状腺全切除或次全切除。对于穿刺活检明确伴恶性肿瘤的病例,患侧腺体全部切除,对侧全切除或次全切除,同时行中央组淋巴结清扫。部分病例术前未行穿刺活检,但超声检查怀疑恶性结节,手术原则与恶性肿瘤病例相同。对于术前明确颈侧区淋巴结肿瘤转移病例,同期行颈侧区淋巴结清扫。
三、术中神经监测准备
对于如下病例采用术中神经监测(intraoperative neural monitoring,IONM):术前怀疑存在甲状腺恶性肿瘤且肿块直径不小于2 cm,巨大腺体或胸骨后甲状腺肿压迫气管引起气管狭窄。
术中神经信号监测设备是美敦力肌电与诱发反应仪(NIM-Response 3.0,Medtronic Xomed,Jacksonville,Florida,USA)。监测方式为间断术中神经监测。系统设置为THYROID模式,术中刺激电流1.0 mA,信号阈值100 mV。左侧迷走神经、喉返神经信号对应为V1、R1;右侧迷走神经、喉返神经信号对应为V2、R2。术前已充分告知病人术中将使用神
四、数据统计
采用IBM SPSS Statistics 23.0软件进行数据分析。计量资料用±s表示。率的比较用卡方检验或Fisher确切概率法。P<0.05为差异有统计学意义。经监测设备,并签署知情同意书。
结 果
统计汇总病例基本情况,男27例,女99例,平均年龄(42.4±14.3)岁。其中GD伴恶性肿瘤77例,气道受压狭窄23例,胸骨后甲状腺肿9例,GD药物治疗不耐受7例,GD合并甲状旁腺功能亢进1例。恶性肿瘤中甲状腺乳头状癌75例,包括乳头状微小癌47例,另2例为滤泡状癌。对于术前穿刺活检明确恶性肿瘤的53例,常规行中央组淋巴结清扫,另40例术前超声检查怀疑恶性结节,但无穿刺检查结果。因术中冷冻病理检查不能排除恶性肿瘤,淋巴结清扫原则同恶性肿瘤。中央组淋巴结清扫共93例,其中8例伴颈侧区淋巴结转移,同期行颈侧区淋巴结清扫(见表1)。统计病人术后近期并发症,11例术后声音嘶哑,其中1例术后6个月内嗓音未恢复,经电子喉镜检查明确一侧声带麻痹。术后35例低血钙,需外周静脉补充,其中1例术后6个月血钙仍低于正常下限,随访复查甲状旁腺素偏低,考虑为永久性甲状旁腺功能减退(见表2)。术后无呼吸困难(即无法脱机拔管)病人。恶性肿瘤组与非恶性肿瘤组比较,术后并发症发生率差异无统计学意义。

表1 基本情况
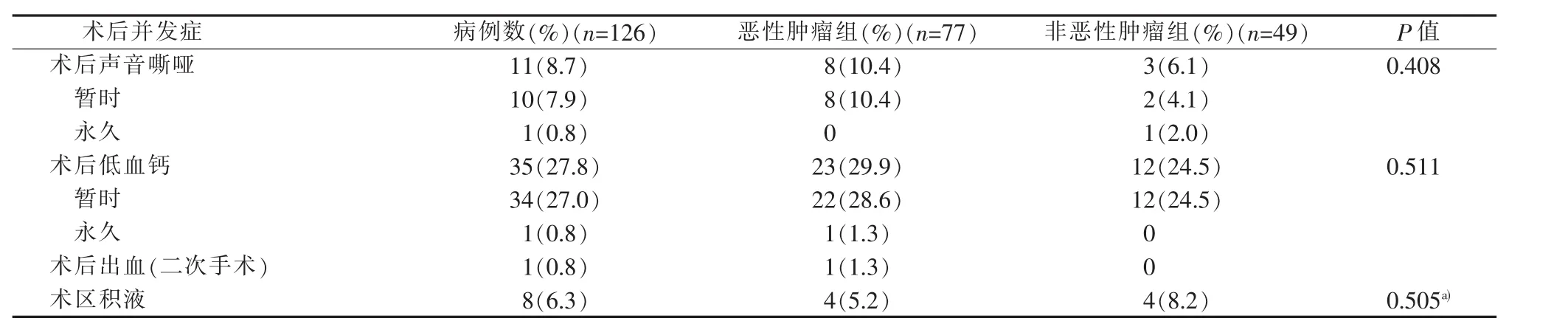
表2 术后近期并发症发生[n(%)]
讨 论
一、术前碘剂准备
随着抗甲状腺药物的应用,碘剂已极少被用来控制甲亢。作为术前准备的一部分,口服碘剂是否常规需要,碘剂对于甲亢手术能发挥何种作用,仍需进一步研究探讨。根据美国甲状腺学会的指南,术前口服碘剂被认为是GD病人的常规术前准备,碘剂减少腺体血流、减轻血管增生、减少术中出血[4]。国内的甲亢外科治疗共识(2020版),同样推荐GD病人术前服用碘剂。但又指出,碘剂在术前准备中的权重正在降低,术前服用碘剂的主要目的已从控制甲亢症状逐渐演变为功能保护,降低喉返神经损伤及甲状旁腺功能损伤发生,减少术后血肿形成[2]。
前瞻性研究指出,碘剂准备显著降低术后暂时性声音嘶哑与甲状旁腺暂时性功能低下的发生率,但腺体的体积、脆性、活动性无明显改变[5]。相反,另有研究在回顾442例甲亢手术后认为,术前碘剂准备并不降低术后并发症的发生率,且碘剂准备具有选择性。术前需服用碘剂的病例,腺体体积明显更大,手术时间更长[6]。
本研究碘剂准备并非常规,仅对腺体Ⅲ度肿大,或存在气管压迫致狭窄的病例,给与术前碘剂口服。对比碘剂准备前后,腺体体积无明显缩小,气管的压迫程度未因碘剂准备而减轻。碘剂准备2周后,术前查体可发现腺体质地明显变硬,术中腺体弹性较差,牵拉推移时易碎,术中空间暴露困难。但是,腺体表面血管未见明显扩张,腺体的密度增加,术中出血可控,出血量少于术前预计。与未服碘病例相比,术后声音嘶哑的发生率无明显差异;但碘剂组术后甲状旁腺功能暂时性减退的发生率较高,可能与腺体巨大相关。总之,对于甲亢术前碘剂准备,不能一概而论。需慎重评估术前腺体情况、激素水平等因素,个体化应用,以求临床获益最大化。
二、术前气道狭窄的评估及神经监测插管
甲亢的手术方案多为甲状腺全切除或近全切除。GD病人腺体肿大,伴有气道压迫或胸骨后甲状腺肿,是明确的手术指征[2]。此时,双侧腺体往往呈弥漫性、对称性增大,向中间挤压气管引起气道狭窄。围术期需考虑气管软化塌陷、术后拔管困难等风险。对于气道狭窄的评估直接影响术前麻醉插管。常规术前颈部CT检查可较清楚地提示气管受压狭窄的程度及范围。对于狭窄气道,可选择管径等于或稍大于气管内径的气管插管通过狭窄段。必要时可借助纤维支气管镜的引导。插管深度应超过狭窄段最低点。尤其是近胸廓段气道狭窄时,插管更为深入。
根据国内的临床指南,甲亢病人术前超声检查提示腺体大且内部血供丰富。对巨大甲状腺肿物,考虑喉返神经有移位的可能。推荐使用IONM[7],以帮助定位神经,规避风险。然而,目前所用IONM气管导管的电极位置固定。管径过细、插管过深都会引起电极与声带无法贴合,造成IOMN失败。在总结多例GD伴气道近胸廓处狭窄的病例后,笔者总结如下操作方案。术前诱导插管通过狭窄处(见图1)。术中优先处理腺体体积较大侧甲状腺。在将腺体翻起后,探查受压处气管质地,排除气管软化、损伤等情况。术中调整气管导管位置,将导管向外拖出至电极与声带贴合(见图2)。神经监测信号通过自检,证明导管位置合适。若无法有效调整导管至合适位置,应及时拔出导管。在可视喉镜引导下,重新气管插管。监测已处理一侧的迷走神经信号(V1、V2)、喉返神经信号(R1、R2)。暴露喉返神经时,记录初始R信号。腺体切除后,测量并记录喉返神经远离入喉处的神经信号。双侧腺体切除后,再次测定V1、R1、V2、R2信号,对比术中信号值有无明显减弱。
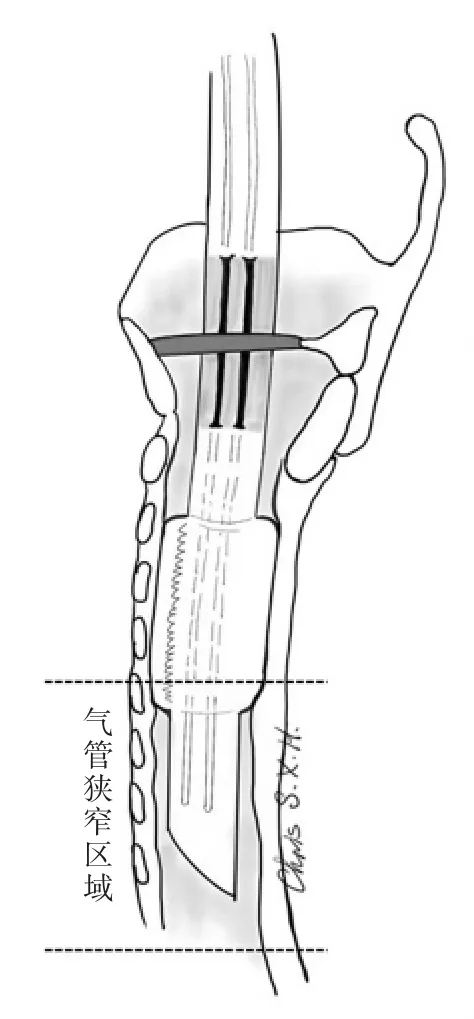
图1 术前诱导插管通过气道狭窄处
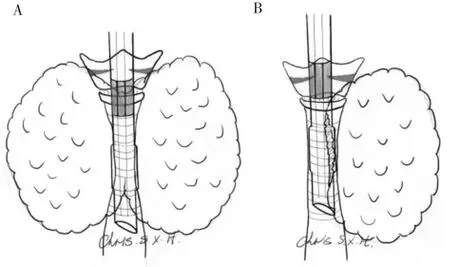
图2 术中神经监测插管调整示意图
三、术前喉不返神经的筛查
喉不返神经,又称非返性喉返神经。本科室前期报道其发生率为0.28%[8],基本发生于右侧,同时伴随头臂干动脉的解剖缺失。喉不返神经的存在,增加神经解剖的不确定性。术前可通过超声[9]或CT检查[10],追踪右侧颈总动脉和右锁骨下动脉的走行,间接判断神经解剖变异。对腺体极度肿大的GD病例,超声检查追踪右侧锁骨下动脉,可能受到不小的干扰。增强CT检查需碘剂造影,不推荐用于GD病人。因此,颈部CT检查将是最重要的筛查方法。
本研究发现1例伴有喉不返神经的GD病例。女性,37岁,右侧甲状腺结节直径<1 cm,细针穿刺检查诊断为乳头状癌。术前通过颈部CT检查筛查出右侧锁骨下动脉变异。术中使用IONM,通过对迷走神经近、远端信号的探查,寻找并追踪喉不返神经[11]。术中神经电信号未减弱,术后无声音嘶哑[11],术后病理诊断为甲状腺乳头状微小癌。尽管喉不返神经发生率不高,但在甲状腺手术量大的医院并不罕见。尤其对于GD等风险相对大的甲状腺手术,术前常规完善颈部CT筛查,术中规范使用IONM,能最大程度减少神经损伤的风险。
四、术前甲状旁腺功能的评估
甲状旁腺功能减退是甲亢术后常见的并发症之一。其中,GD是术后发生严重低钙(需静脉补钙、急诊处理或再次入院治疗)的重要独立危险因素(OR=2.06)[12]。对于术前已存在低钙或维生素D缺乏的甲亢病人,术前补钙和(或)维生素D可减少术后低钙血症的发生。本研究术后低血钙发生率27.8%,其中恶性肿瘤病例术后低血钙发生率29.9%。低钙病人在给与钙剂补充后症状消失。术后甲状旁腺功能减退与术中甲状旁腺意外损伤、胸腺意外切除、中央组淋巴结清扫等多种因素相关。GD病例甲状腺充血肿大压迫周围组织,造成甲状旁腺的解剖分界不清,甲状旁腺辨识困难;腺体血供增加,术中出血多,盲目止血引起甲状旁腺及其血供误伤的风险增大。
另一方面,甲亢时甲状腺素过量分泌可能导致破骨作用增强,引起术前血钙的轻度升高[13]。但需注意,少部分病人可能合并原发性甲状旁腺功能亢进(primary hyperparathyroidism,PHPT)。因此,甲状旁腺功能同样需常规评估。GD合并PHPT是甲亢的手术指征之一[4]。回顾性研究认为,GD合并甲状旁腺腺瘤可能与131I治疗甲亢有关,但放射性核素治疗对甲状旁腺腺瘤的临床与病理结果并无显著影响[14]。本研究发现1例甲状腺恶性肿瘤合并PHPT的GD病例。女性,46岁,以甲亢为首发症状,抗甲状腺药物治疗期间发现一侧腺体恶性结节,并穿刺检查明确。术前完善甲状旁腺功能评估,包括甲状旁腺素、血钙和颈部超声检查后,发现对侧甲状旁腺存在病灶。甲状旁腺素与血钙含量升高,核素显像提示甲状旁腺病灶高摄取。术中行甲状腺全切除,甲状旁腺肿瘤切除。术后病理诊断甲状旁腺腺瘤。
五、术前甲状腺恶性肿瘤的诊断
本研究合并甲状腺恶性肿瘤77例,占所有GD手术病例的61%,其中术前穿刺检查明确恶性肿瘤53例,中央组淋巴结转移28例(36.4%)。甲状腺恶性肿瘤在GD病例中并不罕见。荟萃分析显示,GD病人中甲状腺癌的发生率为7%[15]。对病例数据库分析发现,含有结节的GD病例,术后确诊甲状腺癌的比例(69%)远高于术后意外发现的甲状腺癌的比例(19%)[16]。因此,对于甲状腺结节,无论是否伴有甲亢,均应严格按照结节的随访管理流程,完善术前检查评估,行超声检查的随访,必要时细针穿刺,包含基因检测更佳。
GD合并甲状腺癌的预后,目前尚无定论。研究认为,GD病人诊断甲状腺癌时,多灶癌和远处转移的风险更高[17]。GD是甲状腺癌复发、进展的危险因素[18]。本科室前期报道了47例GD合并甲状腺癌。对微小癌、多灶癌的发生率和中央组、颈侧区淋巴结转移率4个指标,与同期单纯甲状腺癌病人对比,差异均无统计学意义[19]。另有对照研究显示,GD并不影响甲状腺乳头状癌的预后,肿瘤的复发率并未相对上升[20]。
综上所述,GD手术风险高于常规甲状腺手术,术前准备需严格规范进行,以减少围术期的风险。在此基础上,根据个体病情差异,建议从碘剂准备、气道情况、插管选择、甲状旁腺功能、喉返神经变异以及结节性质等多方面完善评估。

