趋化因子CXCL5和程序性死亡配体1在结肠直肠癌组织的表达与病人预后的关系
刘诗光, 赵敬坤, 陆爱国, 毛志海
(上海交通大学医学院附属瑞金医院外科 上海市微创外科临床医学中心,上海 200025)
结肠直肠癌是常见的消化道恶性肿瘤之一,也是引起病人死亡的主要癌症之一。在世界范围内,结肠直肠癌的发病率仅次于肺癌和乳腺癌[1]。在我国,随着饮食结构及生活习惯的变化,结肠直肠癌的发病率呈明显上升趋势,严重威胁我国人民的健康[2]。一直以来,结肠直肠癌的治疗采取以手术治疗为主,结合放、化疗的模式。近年来,以免疫检查点抑制剂为主的免疫治疗受到广泛关注,有望成为针对结肠直肠癌的一种新型治疗方式。免疫治疗通过再次激发机体自身的免疫系统,抑制肿瘤免疫逃逸,从而激活肿瘤微环境中免疫细胞杀伤肿瘤细胞的能力[3]。趋化因子是肿瘤微环境中重要的成分之一,是沟通免疫细胞与肿瘤细胞的关键因子[4]。然而,趋化因子与免疫检查点标志物在结肠直肠癌病人预后中的预测价值尚未充分阐述。
CXCL5(C-X-C motif ligand 5)又称上皮中性粒细胞激活肽78,属于ELR+CXC趋化因子家族的一员[5]。近年来的相关研究发现CXCL5在肿瘤的进展和转移中也发挥重要作用。在非小细胞肺癌(non-small cell lung cancer,NSCLC)中,CXCL5的高表达与NSCLC的血管生成相关[6]。Begley等[7]发现CXCL5在前列腺癌原发灶和转移灶中表达升高。此外,CXCL5可促进前列腺癌细胞的增殖、迁移和侵袭。
程序性死亡配体1(programmed death ligand 1,PD-L1)是B7家族成员之一,又称 B7-H1、CD274。其与受体PD-1结合,通过影响DC抗原提呈,或限制T淋巴细胞的活化和扩散,从而在肿瘤免疫逃逸中发挥重要作用[8]。本研究主要探讨趋化因子CXCL5与PD-L1在联合预测结肠直肠癌病人预后中的价值。
研究对象与方法
一、研究对象
入组78例不同病理分期的结肠直肠癌病人。收集自2010年至2011年我院外科行腹腔镜切除病人的肿瘤组织及癌旁正常组织,经活检和术后病理检查、明确诊断。不纳入急诊手术病人。所有病人术前未接受任何放、化疗及生物治疗。组织芯片委托上海芯超生物芯片定制。取自结肠直肠癌病人的肿瘤组织和癌旁正常组织,距离肿瘤>5 cm,后者作为对照。肿瘤的分期依照美国癌症联合会(American Joint Commission on Cancer,AJCC)的pTNM分期。标本的采集通过我院伦理委员会审批。
二、免疫组织化学染色
免疫组织化学染色一抗抗体:CXCL5(Mouse,R&D,USA);PD-L1(Rabbit,Abcam,UK)。 染色详细步骤见文献[9]。组织芯片脱蜡至水后采用H2O2室温停留10 min,磷酸盐缓冲液(phosphatebuffered saline,PBS)冲洗 3 次,每次 3~5 min。 100 μL 正常非免疫动物血清封闭2 h,弃去封闭液后加入一抗,4℃冰箱过夜。PBS冲洗3次,每次3~5 min,加入二抗,室温 20~30 min。PBS 冲洗 3 次,每次 3~5 min,加入辣根过氧化物酶或碱性磷酸酶的标志物,室温10 min。PBS冲洗3次,每次3~5 min。滴加DAB显色,复染、脱水、封片。
三、免疫组织化学评分
免疫组织化学评分采用免疫危险评分(immune risk score,IRS)标准,由2名病理专业医师在双盲情况下,对每个点进行染色评分。评分的内容包括组织化学染色的强度和阳性染色细胞所占的百分比。IRS=染色强度×阳性细胞百分比。染色强度分为4级,阴性为未见阳性细胞,0级,弱阳性1级,中等阳性2级,强阳性3级。阳性细胞百分比分为5级,即 0 级(无染色)、1 级(染色细胞<10%)、2 级(10%~50%)、3 级(51%~80%)、4 级(>80%)。
四、统计学方法
采用SAS 8.0、SPSS 16.0软件进行统计学分析。用 Pearson χ2检验分析 CXCL5、PD-L1 与临床特征之间的关系。用Kaplan-Meier方法绘制总体生存期曲线,并用对数秩和检验检出两组间差异。用Cox回归模型进行单因素和多因素分析。P<0.05为差异具有统计学意义。
结 果
一、CXCL5、PD-L1在结肠直肠癌组织与正常组织中表达的比较
CXCL5与PD-L1免疫组织化学染色评分最佳cut-off值运用X-tile软件 (版本3.6.1,Yale University School of Medicine,USA)依据病人的生存期计算得出。采用X-tile软件计算,CXCL5的最佳cutoff值为4.5,PD-L1最佳cut-off值为0.4。 当 PD-L1为0.4时IRS分值≥4.5为高表达,IRS分值<4.5为低表达(见图1)。

图1 基于结肠直肠癌病人生存数据的X-tile分析显示CXCL5和PD-L1免疫组织化学染色评分的cut-off值
CXCL5主要表达于结肠直肠癌组织的细胞质,其中48例(61.5%)高表达,30例低表达。与癌旁正常组织相比,其表达差异有统计学意义(P<0.001)(见表1、图2 A~B)。PD-L1在结肠直肠癌组织中表达于肿瘤细胞膜及浸润性淋巴细胞,其中37例(47.4%)高表达,41例低表达。在癌旁正常组织中几乎不表达,其表达差异有统计学意义(P<0.001)(见表 1、图 2 C~D)。
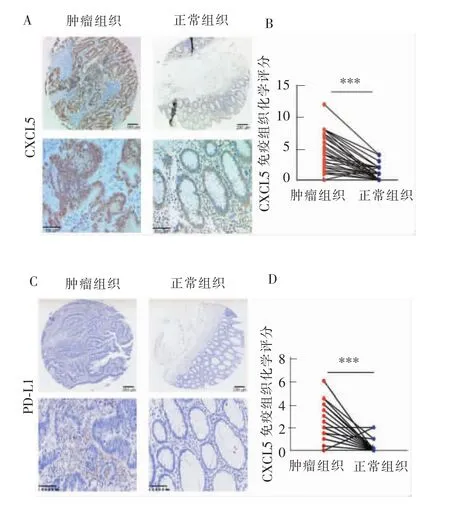
图2 免疫组织化学染色显示CXCL5与PD-L1在结肠直肠癌组织中的表达
二、结肠直肠癌组织中CXCL5、PD-L1表达与临床特征的关系
结肠直肠癌组织中CXCL5的表达,在不同肿瘤直径、TNM分期间的差异具有统计学意义 (P<0.05),不同性别、年龄、组织学分型间的差异无统计学意义(P>0.05)(见表1)。同样,PD-L1的表达,在不同肿瘤直径、TNM分期间的差异具有统计学意义(P<0.05),而不同性别、年龄、组织学分型间的差异无统计学意义(P>0.05)(见表1)。
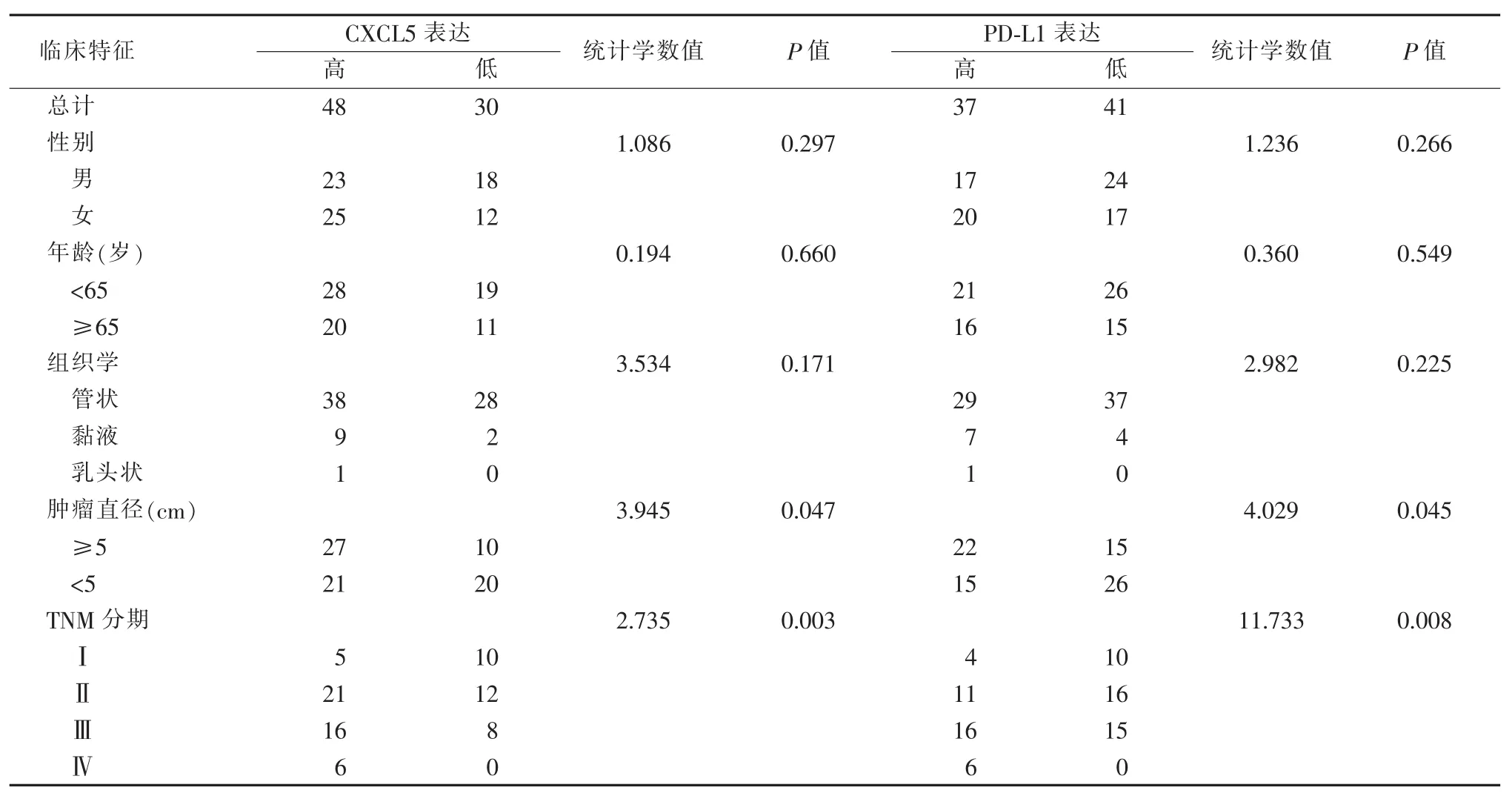
表1 结肠直肠癌组织中CXCL5、PD-L1表达与病人临床特征的关系
三、CXCL5、PD-L1在结肠直肠癌组织中的表达与病人预后的相关性分析
本研究结肠直肠癌病人5年总生存率为73.1%(57/78),中位生存时间为52(18~60)个月。Cox单因素回归分析结果显示,TNM分期、CXCL5高表达、PD-L1高表达是结肠直肠癌病人总生存率的 预 后 危 险 因 素 (P=0.002、P=0.019、P=0.040)。CXCL5高表达从统计学角度未能成为独立预后危险因素(P=0.098),但其P值接近0.05。造成该现象的原因可能是样本量有限。在将PD-L1纳入模型的情况下,TNM分期和PD-L1高表达成为结肠直肠癌病人总生存的独立预后危险因素 (P=0.013、P=0.006)。多因素回归分析显示,在未将PD-L1纳入模型的情况下,TNM分期是结肠直肠癌病人总生存的独立预后危险因素(P=0.011)。CXCL5高表达不是独立预后危险因素(P=0.728)(见表2)。
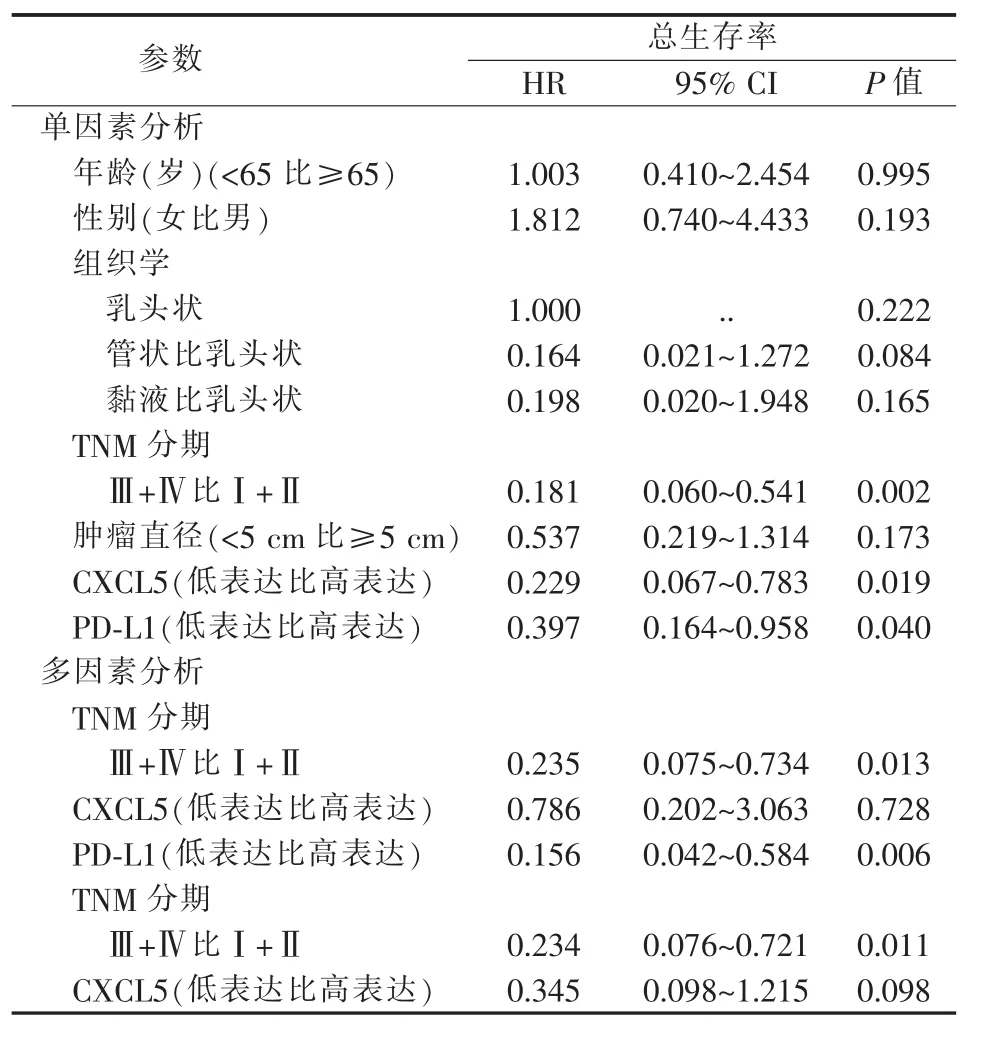
表2 结肠直肠癌病人单因素与多因素Cox回归分析
四、CXCL5、PD-L1高表达对结肠直肠癌病人预后生存的影响
CXCL5高表达组5年生存率64.6%(31/48),中位生存时间为50(18~60)个月。CXCL5低表达组5年生存率86.7%(26/30),显著高于高表达组,中位生存时间为53(19~60)个月。运用 Kaplan-Meier生存曲线法以及Log-Rank分析结果显示CXCL5低表达组5年生存率显著高于高表达组 (86.7%比64.6%,P<0.05)(见图 3 A)。表明 CXCL5 表达与结肠直肠癌病人不良预后相关。
PD-L1高表达组5年生存率54.1%(20/37),中位生存时间为50(18~60)个月。PD-L1低表达组5年生存率为90.2%(37/41),中位生存时间为53(32~60)个月。运用 Kaplan-Meier生存曲线法及Log-Rank分析,结果显示PD-L1低表达组5年生存率显著高于高表达组(92.7%比54.1%,P<0.05)(见图3B)。表明PD-L1表达预示结肠直肠癌病人不良预后。
五、CXCL5及PD-L1联合表达与结肠直肠癌病人生存期的关系
依据CXCL5与PD-L1表达情况,将78例结肠直肠癌临床标本分为4组样本[CXCL5高表达PDL1高表达组 (32例)、CXCL5高表达PD-L1低表达组(16例)、CXCL5低表达PD-L1高表达组(5例)、CXCL5低表达PD-L1低表达组(25例)](见图3C)。Kaplan-Meier生存曲线法及 Log-Rank分析结果显示,CXCL5高表达PD-L1高表达组较另外3组(CXCL5高表达PD-L1低表达组、CXCL5低表达PD-L1高表达组、CXCL5低表达PD-L1低表达组)5年生存率显著降低(46.9%比100%、80%、87.5%,P<0.05)。CXCL5高表达PD-L1高表达组较CXCL5高表达PD-L1低表达组预后差(46.9%比100%,P<0.05)。CXCL5低表达PD-L1高表达组5年生存率与CXCL5低表达PD-L1低表达组相比,差异无统计学意义(80%比87.5%,P>0.05)。 同样,CXCL5高表达PD-L1低表达组、CXCL5低表达PD-L1高表达组间的生存率差异也无统计学意义(100%比80%,P>0.05)(见图 3D)。
讨 论
趋化因子是肿瘤外微环境与肿瘤沟通的桥梁。趋化因子的表达受多种因素影响。
CXCL5在肿瘤的进展、生长和转移中起重要作用[10-11]。CXCL5基因定位于人4号染色体q13-q21,包含4个外显子和3个内含子,其mRNA全长2 475 bp,开放阅读框共342个核苷酸,编码含114个氨基酸的肽链[12]。CXCL5与受体CXCR2特异结合后,可趋化中性粒细胞、T淋巴细胞、B淋巴细胞等细胞的游走、脱颗粒等一系列生物学效应,在机体的抗感染、抗病毒免疫中发挥着重要作用。CXCL5同时具有促血管生成、介导炎性反应及参与结缔组织重塑等重要生物学功能[13-14]。PD-L1的表达则有助于构建免疫耐受微环境,促进肿瘤细胞免疫逃逸[15]。PD-L1除在淋巴细胞、巨噬细胞等表达外,也表达于多种类型的肿瘤细胞表面[16-18]。在结肠直肠肿瘤中,研究发现PD-L1蛋白的阳性表达预示着不良预后[19]。然而,也有学者认为结肠直肠癌病人中PD-L1蛋白的阳性表达与良好预后有关[20]。由此可见,PD-L1高表达与结肠直肠癌病人预后的关系尚存争议,有必要进一步研究明确。目前在其他实体瘤中尚无CXCL5与PD-L1联合预测肿瘤病人预后的研究,但已有研究证实CXCL5与PD-L1之间的关联。如小鼠结肠癌模型中,肿瘤相关成纤维细胞可分泌CXCL5促进肿瘤表面PD-L1的表达[21]。本研究探讨CXCL5与PD-L1联合预测结肠直肠癌病人预后的意义,具有一定创新性。如上所述,采用免疫组织化学的方法在78例结肠直肠癌组织样本中分别检测CXCL5和PD-L1的表达,并将结果与临床随访资料进行对比。笔者发现CXCL5在肿瘤组织中高表达。CXCL5的高表达与肿瘤直径、TNM分期相关,而与性别、年龄、组织学分型无明显相关性。同样,PD-L1蛋白在结肠直肠癌组织中也呈现高表达,在癌旁正常组织中几乎不表达。且PD-L1高表达与肿瘤直径、TNM分期相关,而与性别、年龄、组织学分型无明显相关性。这与Droeser等[20]的研究结果大致相符。
生存相关分析结果显示,TNM分期、CXCL5高表达、PD-L1高表达是结肠直肠癌病人总生存的预后危险因素。多因素回归分析显示,TNM分期和PD-L1高表达成为结肠直肠癌病人总生存的独立预后危险因素。CXCL5高表达不是独立预后危险因素。表明PD-L1比CXCL5能更好地预测结肠直肠癌病人的预后。这与国内Wang等[22]报道一致,在膀胱癌病人中,PD-L1的表达水平是一个独立可评估膀胱癌病人预后的风险因素。
生存分析显示CXCL5在肿瘤组织中的上调与结肠直肠癌病人较差的预后呈显著正相关。与CXCL5低表达的结肠直肠癌病人相比,CXCL5高表达的结肠直肠癌病人有较差的总生存率。相反,Speetjens等[23]证明肿瘤组织中CXCL5低表达与结肠直肠癌病人的不良预后呈正相关。将这种现象归因于T淋巴细胞和中性粒细胞在肿瘤组织内的浸润,这种相反结果出现的原因可能是研究中Ⅰ和Ⅱ期病人比例较高(67.1%比61.5%),且无Ⅳ期病人。
本研究对PD-L1表达情况与结肠直肠癌病人生存期所进行的分析结果显示,PD-L1低表达组5年生存率及平均生存时间明显优于高表达组。该结果与大多数研究所报道的结果一致[19]。Shi等[19]研究结果显示,PD-L1高表达的结肠直肠癌病人肿瘤进展风险率、肿瘤相关死亡率显著升高,总体生存率显著下降,提示PD-L1的表达水平可预测肿瘤进展及相关死亡。
最后,笔者探讨CXCL5与PD-L1联合对结肠直肠癌病人预后的影响,并依据CXCL5与PD-L1表达的4组独立样本,发现CXCL5高表达PD-L1高表达组较CXCL5高表达PD-L1低表达组预后差,提示在CXCL5高表达时,PD-L1直接或间接影响CXCL5所影响的预后,PD-L1表达水平是影响预后的一个独立危险因素。此外,CXCL5高表达PD-L1高表达组较另外3组(CXCL5高表达PDL1低表达组、CXCL5低表达PD-L1高表达组、CXCL5低表达PD-L1低表达组)5年生存率显著降低。表明CXCL5与PD-L1联合预测结肠直肠癌病人预后具有更好的预测效果。
目前,对于CXCL5与PD-L1在结肠直肠癌的表达情况已有相关研究,然而对于两者相关性以及联合影响结肠直肠癌病人预后的研究尚未成熟。本研究首次提出CXCL5与PD-L1的相互影响,以及两者联合可更精准预测结肠直肠癌病人预后。这有利于对亚群病人的筛选。此外,从治疗角度,降低趋化因子表达水平,理论上可能对肿瘤病人预后有正向作用。除相关靶点药物的研发,护理因素在该过程中也可能起到重要作用。综合护理措施主要从心理护理、疼痛护理、生命体征监测以及并发症护理等,根据病人的不同情况给予针对性护理[24],可加速创面的愈合,控制趋化因子,降低炎性反应,促进康复。
因此,深入探讨趋化因子在结肠直肠癌预后中的作用,有助于医护人员从多角度采取多种策略以期提高预后生存水平,符合结肠直肠癌多学科综合治疗的理念[25]。相关研究有待进一步开展。

