去泛素化酶YOD1调控肝脏脂代谢的初步研究
周子欣,杨旭乐,张 许,李 仲
南京医科大学罕见代谢性疾病研究重点实验室,南京医科大学生物化学与分子生物学系,江苏省人类功能基因组重点实验室,江苏 南京211166
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是在全球范围内引起慢性肝病的主要原因,其典型特征为:在没有大量摄入酒精、感染病毒或其他明确病因的情况下,肝细胞内出现中性脂肪堆积,主要为甘油三酯。作为一类进行性疾病,NAFLD的病程可由非酒精性脂肪性肝炎发展为肝硬化、肝细胞癌,直至死亡[1-3]。肝脏作为脂类代谢的重要脏器,是脂肪酸、胆固醇和脂蛋白合成的枢纽,若β-氧化、极低密度脂蛋白分泌、脂肪酸合成等生物途径发生改变,或外周血非酯化脂肪酸(non-esterified fatty acid,NEFA)增加,均可引起脂肪肝。
不仅如此,肝脏脂代谢过程还受到更复杂的分子网络调节。研究表明,固醇调节元件结合蛋白(sterol regulatory element-binding proteins,SREBP)家族包含由2个基因编码的3种蛋白。其中,SREBP1基因在不同的启动子作用下可编码产生SREBP-1a和SREBP-1c,而SREBP2基因则编码SREBP2。Shimomura等[4]发现,SREBP-1c是SREBP分布在小鼠和人类多个组织内的主要形式,在肝脏、白色脂肪、骨骼肌、肾上腺及脑组织中高表达,参与脂肪酸和甘油三酯代谢;而SREBP-1a则主要分布在脾脏及小肠组织,参与调控细胞增殖及脂质代谢。SREBP在剪切后发挥作用。在内质网上,SREBP与SREBP裂解激活蛋白(SREBP cleavage-activating protein,SCAP)结合形成复合体,经过外壳蛋白复合物(coat protein complexⅡ,COPⅡ)介导的囊泡运输,转移至高尔基体,先后经过蛋白酶S1P、S2P的剪切,形成具有活性的SREBP剪切体。多种脂质摄取及合成酶序列的启动子含有固醇调节元件(sterol regulatory element,SRE),SREBP剪切体入核后可与SRE相结合,从而调节脂代谢[4-5]。
既往报道显示,去泛素化酶YOD1是卵巢肿瘤相关蛋白酶(OTU)家族的一员,其UBX结构域可与含缬酪肽蛋白VCP(又称P97或CDC48)形成复合物,使折叠错误的蛋白从内质网上分离[6]。在酵母细胞中,YOD1的同源异构体OUD1可被VCP招募,使转录因子STP23(哺乳动物NF-κB的同源物)去泛素化而活化,从而调节酵母细胞内不饱和脂肪酸的稳态[7-8]。除了脂肪酸代谢外,研究还发现,YOD1参与了免疫调节及肿瘤免疫等多种生物过程[9-10]。本实验室前期研究发现,高脂饮食喂养后,小鼠肝脏中的YOD1表达下降。本研究为了探索YOD1在肝细胞营养代谢中的作用,分别检测了短期高脂饮食小鼠、db/db小鼠肝脏中以及经OA处理后的Hepa1-6细胞内YOD1的表达水平,并观察了其在小鼠体内的组织分布以及小鼠在不同营养状态下的表达情况,并在Hepa1-6细胞中过表达YOD1,经OA处理后观察细胞内脂质堆积情况,检测下游相关基因,为进一步揭示去泛素化酶YOD1在肝脏脂质代谢中的功能及作用提供新的实验数据。
1 材料和方法
1.1 材料
db/db雄性小鼠、C57BL/6雄性小鼠(北京维通利华实验动物技术有限公司),实验动物的使用及操作均获得南京医科大学伦理委员会批准(批准编号:IACUC-1901025)。抗Calnexin抗体(Stress gen公司,加拿大),抗Flag抗体、抗SREBP-1c抗体(Cell Signaling公司,美国),抗Insig-1抗体(Abcam公司,美国);蛋白marker(Bio-Rad公司,美国);TRIzol、转染脂质体LipofectamineTM2000(Invitrogen公司,美国);引物由上海捷瑞基因有限公司合成;甘油三酯检测试剂盒(北京普利莱生物公司);RevertAid First Strand cDNA Synthesis Kit逆转录试剂盒(Thermo Fisher公司,美国);SYBR GreenⅠMaster(Roche公司,瑞士);脱脂奶粉(青岛MDBio公司);Hepa1-6细胞(ATCC细胞库,美国);腺病毒(上海汉恒生物科技有限公司);60 kcal%高脂饲料(D12492)(Research Diets公司,美国)。
1.2 方法
1.2.1 动物分组和处理
选取4周龄C57BL/6雄性小鼠随机分为正常饮食组及高脂饮食组,每组各8只,喂养4周后摘取肝脏组织[11]。对8周龄C57BL/6雄性小鼠进行饥饿再喂食造模[12],分别给予小鼠如下处理:正常饮食、饥饿24 h以及饥饿24 h后再喂食12 h,每组随机纳入6只小鼠,处理结束后摘取小鼠肝脏。
1.2.2 Hepa1-6细胞培养和处理
在5% CO2的37℃的环境下,给予Hepa1-6细胞10%胎牛血清的高糖DEME培养基培养。以pcDNA3.3质粒为载体,构建YOD1过表达质粒。使用Opti-MEM培养基稀释脂质体LipofectamineTM2000与质粒,LipofectamineTM2000与质粒按照2∶1的比例分别配置转染液并混匀,加入细胞培养基内,转染细胞4~6 h后换液。
1.2.3 RNA提取和实时荧光定量PCR(Q-PCR)
匀浆机、离心机4℃预冷。将1 mL TRIzol加入匀浆管内,置于冰上预冷。切取小鼠肝脏,加入TRIzol中匀浆。向匀浆管内加入200 μL氯仿,剧烈震荡30 s,并静置5 min。12 000g离心30 min,转移上清至洁净EP管中(细胞RNA提取:500 μL TRIzol,100 μL氯仿)。向管内加入等量异丙醇,轻柔混匀,静置10 min,10 000g离心10 min,弃上清保留沉淀,加入预冷的75%DEPC乙醇,10 000g离心10 min洗涤RNA沉淀,弃上清,晾干至乙醇挥发。加入DEPC水溶解沉淀,并使用仪器Nano drop测浓度。
逆转录体系如下:总RNA 1 μg与DEPC水共计5.5 μL,反应液(5×)2 μL,RNA酶抑制剂(20 U/μL)0.5 μL,dNTP混合液(10 mmol/L)1 μL,随机引物0.5 μL。逆转录程序如下:95℃预变性1 min,95℃变性10 s,60℃退火延伸1 min,返回上一步循环40次,95℃变性1 min。取出cDNA样品,置于4℃保存。
Q-PCR体系如下:互补DNA(cDNA)1 μL,SYBR Green染料5 μL,上游引物(2.5 mol/L)0.75 μL,下游引物(2.5 mol/L)0.75 μL,去离子水2.5 μL。QPCR程序如下:95℃预变性,10 min;95℃变性,15 s;60℃退火延伸,60 s;循环40次。
1.2.4 蛋白免疫印迹法
匀浆机、离心机4℃预冷。配制组织裂解液,4℃预冷。向EP内加入500 μL裂解液,切取小鼠肝脏组织,浸入其中,并匀浆。而6孔板细胞蛋白提取步骤如下:弃培养液,预冷PBS溶液轻柔洗去残留培养液,加入适量裂解液,冰上裂解30 min。随后,10 000g离心10 min,转移上清至洁净EP管中。使用Thermo试剂盒测定蛋白浓度,以牛血清蛋白为标准品绘制标准曲线,计算得到蛋白浓度。
配制10%SDS-聚丙烯酰胺凝胶,过夜后使用。将上样缓冲液(5×)与蛋白样品混匀,金属浴95℃加热10 min,蛋白充分变性后置于冰上,并逐一上样。调节电压至80 V,待样品通过浓缩胶后,增加电压至120 V,继续电泳。结束后转膜,预先裁剪PVDF膜,甲醇激活后使用,贴合膜布与凝胶,并除气泡,以湿转“三明治”结构,在100 V、1 h的条件下转膜。配制5%牛奶溶液,将PVDF膜浸入,室温封闭60 min。
取出预先以1%BSA抗体稀释液配置的一抗,置于冰上,将PVDF膜置于塑封膜内,加入一抗,热合封闭塑封膜,置于摇床上,4℃过夜,使一抗与目的蛋白充分结合。次日,取出PVDF膜,回收抗体、洗膜,并配置二抗。室温条件下,使PVDF膜结合二抗,孵育1 h,并洗膜。将ECL发光液均匀滴加在PVDF膜上,曝光。
1.3 统计学方法
数据均使用Graphpad Prism 8.0软件进行统计分析,并作图。所示数据均以均数依标准差(±s)的形式表示。组间比较采用Studentt检验,P<0.05为差异有统计学意义。
2 结果
2.1 短期高脂饮食降低C57BL/6小鼠肝脏中YOD1的表达水平
前期研究发现,高脂饮食喂养后,小鼠肝脏中的YOD1表达下降。基于此,首先检测了短期高脂饮食的小鼠肝脏中YOD1的表达情况,并发现短期高脂饮食可降低C57BL/6小鼠肝脏中YOD1表达水平(图1A)。接下来,又检测了遗传性肥胖的db/db小鼠肝脏,与db/+小鼠相比,YOD1的表达水平并未观察到改变(图1B),提示YOD1的表达变化并非遗传因素所致。为了进一步明确YOD1是否受营养状态调节,利用单不饱和脂肪酸油酸(oleic acid,OA,200 μmol/L)处理Hepa1-6细胞16 h后,通过使用QPCR检测YOD1的表达水平,发现经过OA处理后,细胞内的YOD1表达水平显著下降(图1C)。

图1 短期高脂饮食可降低C57BL/6小鼠肝脏中的YOD1的表达水平Figure 1 Short-term HFD could reduce the expression level of YOD1 in the liver of C57BL/6 mice
2.2 YOD1的表达水平受营养状态调控
为了明确YOD1的组织分布情况,提取了C57BL/6小鼠多个组织器官的RNA。利用Q-PCR的方法检测白色脂肪组织、棕色脂肪组织、肝脏、骨骼肌、肾脏和胰腺中YOD1的mRNA水平,发现YOD1在肝脏中表达丰度最高(图2A),进一步提示YOD1可能在肝脏中发挥重要作用。为验证YOD1是否参与肝脏中的营养代谢,对C57BL/6小鼠进行禁食后再喂食处理,并观察到禁食24 h后,小鼠肝脏YOD1表达水平显著升高,再喂食后又显著下降(图2B)。上述结果提示,YOD1受营养状态调控,并可能参与肝脏营养代谢。

图2 YOD1在C57BL/6小鼠肝脏中的表达受营养状态调控Figure 2 The expression of YOD1 in C56BL/6 mice was regulated by nutritional status
2.3 过表达YOD1的Hepa1-6细胞中OA诱导的脂质堆积明显减少
为了进一步探索YOD1在肝细胞中的功能,通过构建YOD1质粒,在Hepa1-6细胞中过表达目的基因,并给予Hepa1-6细胞OA处理。通过甘油三酯试剂盒检测细胞中甘油三酯含量,结果显示与空载对照组相比,过表达YOD1的Hepa1-6细胞内,甘油三酯含量显著降低(图3A)。同时,对经过OA处理后的Hepa1-6细胞进行油红染色,镜下观察到过表达YOD1的Hepa1-6细胞内,脂滴数量明显减少,且体积亦变小(图3B),与细胞内甘油三酯含量的变化趋势相一致。

使用脂质体将YOD1质粒转染进入Hepa1-6细胞后,使用200 μmol/L的OA处理Hepa1-6细胞16 h。A:利用甘油三酯试剂盒检测Hepa1-6细胞内甘油三酯含量,两组比较,*P<0.05(n=3);B:Hepa1-6细胞经过OA处理后,使用10%多聚甲醛固定细胞,异丙醇溶液漂洗,使用油红染料在室温下染色10 min(×20)。
2.4 过表达YOD1抑制SREBP-1c的剪切
由于过表达YOD1后,Hepa1-6细胞内的甘油三酯含量显著下降,且脂质堆积明显减少。因此,初步推测,过表达YOD1后,可能引起Hepa1-6细胞中脂质合成减少。根据文献报道,SREBP家族的蛋白分子SREBP-1c作为转录因子,经过剪切入核后,通过结合启动子含有SRE序列的下游基因,可以激活乙酰辅酶A羧化酶、脂肪酸合成酶以及甘油-3-磷酸酰基转移酶等关键酶,从而促进脂肪酸及甘油三酯的合成[4]。
据此,首先在Hepa1-6细胞内过表达YOD1并使用OA(200 μmol/L)处理16 h后,通过蛋白免疫印迹法检测其表达效率,可知YOD1过表达成功(图4A)。进一步检测细胞内SREBP-1c的mRNA水平,与空载对照组相比,过表达YOD1后,SREBP-1c的总mRNA水平并未观察到变化(图4B)。由于SREBP-1c蛋白需要先后在内质网、高尔基体上经过剪切,才能以具有活性的剪切体形式入核发挥作用[4-5]。接下来,进一步通过蛋白免疫印迹法检测SREBP-1c的蛋白表达水平,发现过表达YOD1后,SREBP-1c前体的表达水平没有变化,但是SREBP-1c剪切体表达水平明显降低(图4C)。提示过表达YOD1抑制SREBP-1c的剪切,从而影响下游脂代谢。
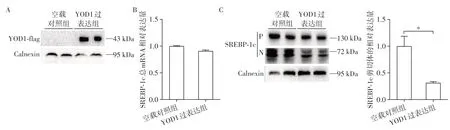
图4 Hepa1-6细胞内过表达YOD1可抑制SREBP-1c的剪切Figure 4 YOD1 overexpression in Hepa1-6 cell line inhibitedSREBP-1c cleavage
3 讨论
随着工业化进程的发展,人们的生活方式和饮食习惯的改变,NAFLD及与之相伴的肥胖、糖尿病和代谢综合征愈加多见。近十年来,NAFLD在亚洲流行率逐年增长,由1995—2005年的25.28%增至2012—2017年的30.90%,且患者普遍预后较差,成为公共卫生难题[13]。肝脏脂质合成的异常激活往往与肥胖、代谢紊乱的发生机制相关,尤其多见于NAFLD。在病理状态下,肝脏由于慢性内质网应激,并伴随着未折叠蛋白反应(unfolded protein response,UPR),随着SREBP-1c激活,脂肪变性、细胞应激和炎症反应加剧,导致病程发展[4]。最近研究发现,去泛素化酶USP20可以通过调节mTORC1-HMGCR轴调控肝脏中的胆固醇代谢,提示在肝脏中去泛素化酶在肝脏脂质代谢中发挥着重要作用[14]。
前期研究发现,高脂饮食喂养后,小鼠肝脏中的YOD1表达下降。本研究首先检测了高脂饮食小鼠肝脏中YOD1的表达水平,并观察到短期高脂饮食可诱导YOD1表达下调。但在正常饮食的遗传性肥胖的db/db小鼠肝脏中未观察到YOD1表达水平的变化。另外,通过OA处理Hepa1-6细胞,观察到细胞内YOD1的mRNA水平也出现显著下降。接下来,进一步明确了YOD1在C57BL/6小鼠体内的组织分布情况,发现其在肝脏中表达丰度最高,提示YOD1在肝脏内可能发挥重要作用。同时,对C57BL/6小鼠进行饥饿再喂食的处理,观察到饥饿后,小鼠肝脏中的YOD1表达水平显著增加,而再次喂食后,YOD1表达明显减少,综合以上结果,提示YOD1在肝脏中的表达受营养状态调控。为探索该基因在肝脏中的作用,在Hepa1-6细胞中过表达YOD1,并使用OA处理细胞。本研究观察到,过表达YOD1后,细胞内甘油三酯含量显著下降;而油红染色显示,过表达YOD1后,细胞内脂滴变小、数量明显减少,提示YOD1影响肝细胞内的脂代谢。由于SREBP-1c在肝脏脂肪酸及甘油三酯的代谢中发挥着重要的调控作用。通过Q-PCR在经OA处理的细胞中,发现过表达YOD1并不影响SREBP-1c的mRNA水平。既往研究已经揭示了SREBP-1c蛋白需经过剪切方可活化的现象,进一步通过蛋白免疫印迹法检测蛋白水平,发现过表达YOD1后SREBP-1c剪切体表达水平明显下调。结合本研究中过表达YOD1的Hepa1-6细胞经OA处理后,其甘油三酯含量较对照组出现显著下降的结果,提示过表达YOD1可抑制SREBP-1c的剪切减少细胞中脂肪酸和甘油三酯的合成,从而降低细胞中脂质的积累。
SREBP-1c具有bHLH-zip(basic-helix-loop-helix leucine zipper)结构,作为转录因子调节下游基因前,需要在高尔基体上进行剪切。首先,丝氨酸蛋白酶S1P在前体SREBP-1c两个跨膜结构域之间的环区进行切割,分离出N端的转录因子结构域。为锌离子依赖的金属蛋白酶S2P提供底物,在S2P作用下,将bHLH结构域从高尔基体膜上游离下来,形成具有活性的核型SREBP-1c片段。入核后,SREBP-1c作为转录因子,可结合靶基因启动子中SRE元件,可激活乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、脂肪酸合成酶(fatty acid synthase,FAS)硬脂酰CoA去饱和酶(stearoyl-CoA desaturase,SCD)以及甘油-3-磷酸酰基转移酶(glycerol 3-phosphate acyltransferase,GPAT)等,并最终促进脂肪酸及甘油三酯的合成[4-5]。
本研究现阶段的结果表明,去泛素化酶YOD1主要分布在肝脏,其表达水平受营养状态调控,在Hepa1-6细胞中过表达YOD1,可以使OA诱导的脂质堆积明显减少,并抑制SREBP-1c的剪切,提示YOD1可能对于SREBP-1c信号通路下游基因的表达也有影响,我们将在后续实验中进一步验证。对YOD1的研究将为进一步了解肝脏中脂质代谢的调控机制提供新的思路。

