JAK/STAT信号通路在狼疮肾炎中的研究进展①
林 婷 林 青(福建中医药大学附属人民医院,福州 350004)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种以多器官、多组织损害为主要特征的慢性自身免疫性疾病。狼疮肾炎(lupus nephritis,LN)是SLE最常见且最严重的并发症,可显著降低SLE患者的生存率[1-2]。LN的主要病理表现是大量免疫复合物(包括IgG、IgM、补体C3等)沉积在肾小球及其系膜区,并诱发炎症细胞的活化与浸润[3]。目前研究显示LN与多种细胞因子及其免疫信号通路异常相关。Janus激酶(Janus kinase,JAK)/信号转导和转录激活因子(signal transducer and activator of transcription,STAT)信号通路(简称JAK/STAT信号通路)参与调节多种细胞因子的生物学功能,可能与LN存在联系。本文回顾JAK/STAT信号通路结构及转导过程,阐述其在LN发生发展中的作用以及通过阻断该信号通路治疗LN的研究进展,以期对LN发病机制研究及治疗有所帮助。
1 JAK/STAT信号通路结构及转导过程
1.1 JAK家族成员及结构JAK家族是一类存在于细胞内的非受体型酪氨酸蛋白激酶,含有1 100多个氨基酸,分子量约120~140 kD[4]。在哺乳动物体内JAK家族包含4个成员:JAK1、JAK2、JAK3和TYK2。所有的JAK都包含7个同源区(JH1-7),并由同源区组成4个结构域:C端的JH1、JH2、SH2和N端的FERM。JH1是激酶结构域,具有磷酸转移酶的活性;JH2是假激酶结构域,不具有催化功能,主要在受体诱导JAK活化的过程中发挥调节作用[5];SH2主要负责稳定酶的结构;FERM介导激酶与细胞因子受体的结合,可正向调节激酶的催化活性[4]。JAK存在于细胞质中,可选择性与不同细胞膜上受体相结合,通过磷酸化自身或邻近的酪氨酸残基来传递信号,包括STAT[6]。
1.2 STAT家族成员及结构STAT是一类可以与DNA结合的蛋白质,由750~850个氨基酸组成,分子量约84~113 kD。STAT家族包含7种蛋白:STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6[7]。它们的结构和功能域高度保守,主要包括:N端结构域、螺旋结构域、DNA结合结构域、连接区、SH2结构域和C端激活结构域[8]。N端结构域介导STAT多聚体的形成,增加转录活性;螺旋结构域可影响蛋白的相互作用及核转录;DNA结合结构域决定每个STAT的DNA结合特异性;SH2结构域可介导STAT与特定受体的酪氨酸残基结合;C端激活结构域可调控转录的激活,其反式激活域内的丝氨酸磷酸化可增强转录活性[8-9]。STAT磷酸化后,发生二聚体化并从细胞质转移到细胞核,在核内与DNA结合从而影响基因的转录和表达。
1.3 JAK/STAT信号通路的转导过程和调节 随着对JAK/STAT信号通路研究的深入,其信号传递过程已逐渐明了:细胞膜上的Ⅰ型或Ⅱ型受体与细胞因子结合后发生二聚体化,同时与受体偶联的JAK激酶发生磷酸化并激活。活化的JAK激酶将磷酸基团转移至受体亚基中的酪氨酸残基上形成STAT蛋白的识别位点[10]。STAT结合该位点后在JAK激酶的作用下发生磷酸化,有活性的STAT从受体上脱落进入细胞质发生二聚体化,最后STAT二聚体进入细胞核内与DNA特定区域结合调节目的基因的表达[11]。
JAK/STAT信号通路可被多种细胞因子激活,包括干扰素(interferon,IFN)、白介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor,TNF)等,同时也调控多种细胞因子的表达,包括IL-10、IL-17、γ-干扰素诱导蛋白10(interferon-γ-inducible protein 10,IP-10)和单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)等[12-13]。JAK/STAT信号通路主要受3种负性因子调节,包括细胞因子信号抑制因子(suppressor of cytokine signaling,SOCS)、活化STAT的蛋白抑制剂和蛋白酪氨酸磷酸酶[14]。其中,SOCS被认为是经典的JAK/STAT信号通路负性调节因子,主要包含8种蛋白:SOCS1-SOCS7和CIS(cytokine-inducible SH2 domain-containing protein)。
2 JAK/STAT信号通路在LN中的作用
LN是一种自身免疫性疾病,可表现为免疫复合物沉积于肾小球、免疫细胞功能紊乱以及肾脏细胞的增殖和炎症反应[15]。LN的免疫异常与多种细胞因子的表达水平异常相关,如IFN-γ、IL-6、IL-12、IL-15、IL-21和IP-10等[16-17]。相关研究发现,这些细胞因子可能通过JAK/STAT信号通路发挥生物学效应,其中研究较多的信号通路是JAK/STAT1和JAK/STAT3。
2.1 JAK/STAT1与LN相关研究发现,JAK/STAT1信号通路在LN的多种细胞中存在高表达,或许与LN的发生发展有关。临床研究发现,LN患者T细胞的STAT1表达水平是SLE患者的2.04倍(P=0.038)[18],肾小管上皮细胞STAT1表达水平与SLE疾病活动指数(SLE disease activity index,SLEDAI)呈正相关,肾小球中STAT1表达增多的LN患者血清肌酐含量较高,预后较差[19]。在MRL/lpr小鼠的肾小球系膜细胞、内皮细胞和部分肾小管上皮细胞中均表达p-STAT1,并且较健康对照组小鼠明显升高[20]。在患有活动性LN的MRL/lpr小鼠肾小球(主要是系膜细胞和内皮细胞)中STAT1和p-STAT1的表达量显著高于没有LN的MRL/MP-lpr+/+小鼠,将这两种小鼠的肾小球系膜细胞在体外培养后,MRL/lpr小鼠的STAT1蛋白表达仍然高于MRL/MP-lpr+/+小鼠[21]。ZHANG等[22]用LN患者血清刺激人肾小球系膜细胞模拟LN体内环境后,系膜细胞中STAT1的表达明显提高。同样DIMOU等[23]利用LN患者血清刺激人肾小球内皮细胞后,IL-10和TNF-α表达增高;利用IFN-γ刺激人肾小球内皮细胞后STAT1通路 被 活 化,IL-10和TNF-α表 达 同 样 增 多,提 示STAT1通路与LN肾小球内皮细胞释放促炎症因子的过程相关。WANG等[24]发现,LN患者和MRL/lpr小鼠的肾小球中抗dsDNA抗体表达增高,在体外实验中应用抗dsDNA抗体刺激小鼠肾小球内皮细胞、系膜细胞和近端肾小管上皮细胞后,JAK2/STAT1信号通路被激活,p-STAT1表达增加,猜测STAT1参与抗dsDNA抗体促进LN肾脏病变的过程。以上研究结果提示,JAK/STAT1信号通路在LN相关的多种细胞中发挥作用,共同参与肾脏病变。
为研究STAT1在LN中发挥的具体作用,WANG等[25]抑制MRL/lpr小鼠肾小球、肾间质和肾小管上皮细胞中的STAT1磷酸化,结果发现MCP-1、IFN-γ等炎症因子表达降低,肾小球、肾间质和血管周围的T细胞与巨噬细胞浸润减少,IgG和C3沉积减少,蛋白尿水平降低,小鼠肾功能改善,提示JAK/STAT1通路与MRL/lpr小鼠肾脏炎症的进展有关,抑制该通路的表达可能对LN的治疗有益。不过值得注意的是,YIU等[26]研究发现,虽然敲除STAT1基因的MRL/lpr小鼠IgG和IgM在肾小球的沉积减少,肾小球炎症情况改善,但同时T细胞、巨噬细胞和嗜酸性粒细胞在间质的浸润增加,尿素氮和血清肌酐水平明显提高,出现明显的间质炎症。这与SHAO等[27]的研究结果类似,他们发现STAT1敲除的小鼠蛋白尿增多,小鼠死亡率增高,但肾小球中STAT3的表达水平增高,IFN-γ和IL-6释放增多,巨噬细胞浸润增加,提示或许在LN中STAT1和STAT3的动态平衡可以影响狼疮样病变的发展。
2.2 JAK/STAT3与LN相关研究发现JAK/STAT3在LN中表达增加,或许与LN的发生发展也存在联系。在LN患者肾组织活检中发现,系膜细胞中p-STAT3表达增加,肾小球与肾间质的p-STAT3阳性细胞数与血清肌酐浓度呈正比,与肌酐清除率呈反比,p-STAT3阳性的间质细胞数量与间质炎症浸润程度和间质纤维化、小管萎缩程度相关,提示STAT3在不同肾脏细胞中表达增加,并与肾脏炎症和纤维化存在联系[28]。除了肾脏细胞外,STAT3还与LN患者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)的异常增生相关,利用IL-12刺激活动期LN患者的PBMC后,PBMC增殖明显并伴随STAT3激活,提示STAT3参与LN患者PBMC的增殖过程[16]。同样CHEN等[12]在LN患者的单个核细胞中也检测到STAT3和p-STAT3的高表达以及下游的IL-17表达增加,并推测STAT3通过调控IL-17在单个核细胞中的表达参与LN的疾病进展。
除了IL-17之外,还有多种细胞因子参与LN的发生发展,并与STAT3存在联系。RAMALINGAM等[17]对常用的LN模型小鼠(NZB/WF1、NZW/BXSB和NZM2410)进行检测,发现在这三种小鼠肾脏共同表达的263个基因中有60个基因的启动子上含有STAT3的结合位点,包括IP-10、SOCS3和C3;通过STAT3通路调控的IL-6和IL-10在这3种小鼠肾脏中的表达显著上调,可见STAT3与LN小鼠的疾病发展存在联系。研究者同时在SLE患者肾脏中发现,这60个基因中有30个在肾小球表达,25个在肾小管间质中表达,提示STAT3参与调控SLE患者肾脏中多种基因的异常表达,与LN的发生发展存在密切联系。此外,LIU等[29]在实验中发现,IL-6家族的抑瘤素M(oncostatin M,OSM)在MRL/lpr小鼠肾皮质中的表达量是未发病小鼠MRL/MpJ的10.23倍(P<0.05),p-STAT3和p-STAT1的表达较MRL/MpJ小鼠明显增高,利用抗-OSM抗体干预后p-STAT3表达下降41.21%(P<0.05),肾脏炎症及肾小管间质纤维化情况明显改善,推测OSM参与LN肾小管间质损害的过程与STAT3的激活和过表达相关。
反之,抑制STAT3活化或者敲除STAT3基因是否有助于减缓肾脏病变?DU等[30]应用STAT3抑制剂S3I-201抑制MRL/lpr小鼠肾脏STAT3激活后,MCP-1和细胞间黏附分子-1表达水平降低,细胞外基质沉积减少,炎症浸润和肾小管间质纤维化情况改善,尿蛋白水平降低,证明STAT3的激活介导了LN小鼠肾小管间质病变,抑制STAT3的活化对减缓MRL/lpr小鼠肾小管间质病变产生有利影响。YOSHIDA等[31]还发现,敲除T细胞特异性STAT3的狼疮小鼠血液中抗dsDNA抗体明显减少,蛋白尿水平降低,IgG与炎症细胞在肾脏的浸润明显减少,提示STAT3可能还通过参与B细胞活化、自身抗体的产生以及炎症细胞浸润等过程影响狼疮小鼠的肾脏病变。
3 JAK/STAT信号通路与LN治疗
目前临床上常用大剂量激素联合免疫抑制剂治疗LN,然而部分患者治疗效果不佳甚至无效,且长时间治疗易导致感染、免疫功能紊乱等继发性疾病,因此寻求新的治疗药物也显得格外重要。动物实验和临床试验研究发现,对JAK/STAT信号通路的各个环节实行靶向治疗,如降低JAK激酶活性、降低STAT的磷酸化水平,提高相关负性调节因子的表达等,从而阻断该信号通路的正常传导,或许可以预防或延缓LN的肾脏病变,改善肾功能(表1)。
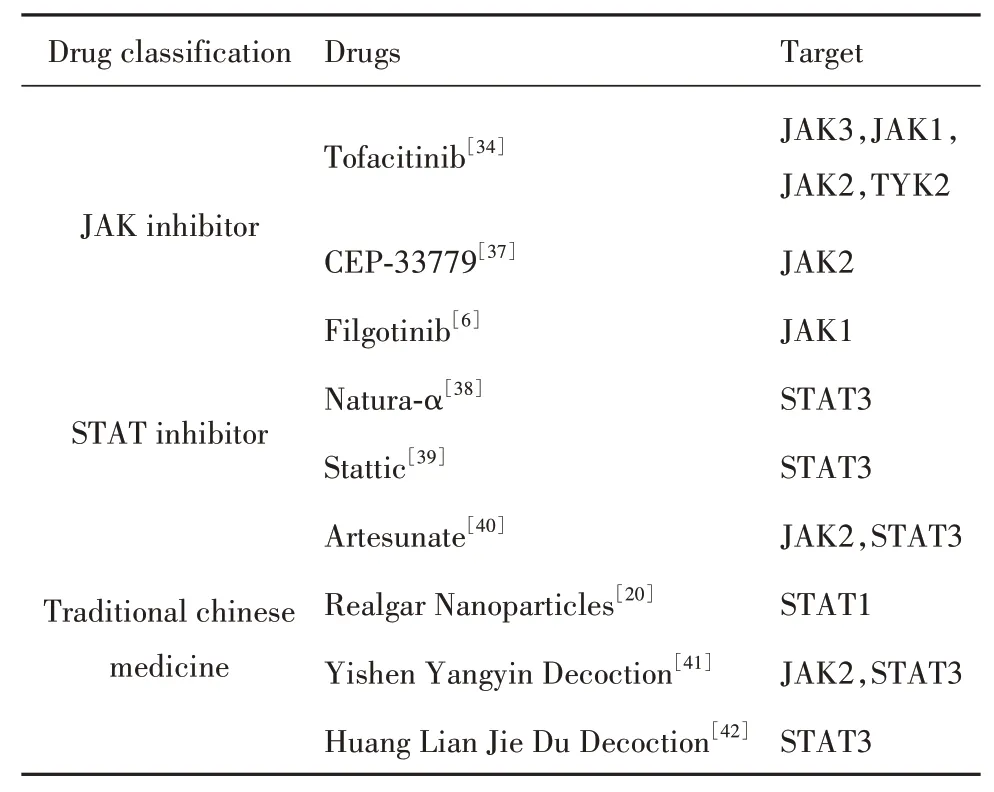
表1 JAK/STAT信号通路与LN治疗靶点Tab.1 JAK/STAT signaling pathway and LN therapeutic target
3.1 JAK抑制剂JAK抑制剂研究在过去的十年里发展迅速,已研发出两代共超过20种药物,第一代非选择性抑制剂主要包括Tofacitinib(TOFA)、Baricitinib、Ruxolitinib等,第二代为选择性抑制剂,包括JAK1抑制剂Filgotinib、JAK2抑 制 剂CEP-33779等。JAK抑制剂与其他生物制剂相比使用更方便,价格更低廉[32],目前主要应用于类风湿性关节炎和银屑病等的研究中,与LN相关的研究较少[33]。在动物实验中,FURUMOTO等[34]发 现 对MRL/lpr小鼠预防性使用TOFA不仅可以有效抑制STAT3和IP-10在肾脏的表达,还可显著抑制促炎症因子的合成,延缓肾脏损害。无论是单独使用TOFA还是TOFA与地塞米松联合治疗,都可显著降低IL-2和IL-6在NZB/WF1小鼠肾脏的表达,减少补体和IgG在肾脏的沉积以及炎症细胞浸润,减少蛋白尿的产生[35-36]。单独使用TOFA治疗还可减少STAT蛋白(STAT1、STAT2、STAT3、STAT4和STAT5a)的产生,减少肾脏组织损害,改善肾功能[35]。CEP-33779是一种新的小分子JAK2抑制剂,在诱导性狼疮小鼠MRL/lpr中使用CEP-33779治疗可以抑制STAT3磷酸化,减少炎症细胞浸润,延缓或者阻断LN的发展;在自发性狼疮小鼠NZB/WF1中,CEP-33779治疗可降低p-STAT3表达水平,抑制肾小球细胞增殖与间质纤维化,显著改善蛋白尿及肾脏病理情况,小鼠存活率较未治疗组小鼠明显提高并与环磷酰胺治疗组相当,说明该药物在诱导性和自发性狼疮小鼠中都可以有效减轻肾脏炎症情况,预防并延缓LN的发展,并且没有明显的毒性[37]。FILGOTINIB对LN的治疗研究目前已进入Ⅱ期临床试验阶段,值得进一步关注[6]。虽然JAK抑制剂的有效性和安全性与预期的效果还存在一定差距,各个药物与其剂量范围之间的相对风险尚未确定[6],但以上研究结果提示,通过对JAK/STAT信号通路中JAK激酶进行抑制或许对LN治疗有益,研发更具选择性的JAK抑制剂具有重要意义。
3.2 STAT抑制剂 理论上,JAK/STAT信号通路也可通过抑制STAT激活、中断STAT与受体相互作用、阻断STAT二聚体化或干扰STAT与DNA结合而被阻断,然而与JAK不同,STAT并不是酶,由于生物利用度、体内有效性和选择性等方面的原因,研发适合临床使用的阻断药物一直存在困难[10]。虽然目前有部分针对STAT家族成员尤其是STAT3抑制的药物已经研发出来,例如Natura-α、Stattic等,但仍处于基础研究阶段,在LN治疗上的应用研究进展有限。Natura-α是一种小分子合成剂,可用于治疗某些自身免疫性和炎症性疾病。CHIAO等[38]发现,经Natura-α灌胃治疗的NZB/WF1小鼠肾组织中STAT3磷酸化的细胞数量减少,C3在肾小球沉积减少,蛋白尿水平明显降低,小鼠生存率显著提高,提示该药可通过抑制STAT3磷酸化治疗LN。Stattic是另一种STAT3小分子抑制剂,可以抑制STAT3的磷酸化进而阻断STAT3的二聚体化和核转录过程。在MRL/lpr小鼠中,Stattic预防性用药可减少T细胞在肾脏的浸润,延缓肾炎的发生;长期治疗可减少IgG在小鼠肾脏的沉积,延缓蛋白尿的出现,证实在狼疮小鼠中抑制STAT3的磷酸化可以延缓LN的发生发展[39]。以上实验结果提示,应用STAT蛋白抑制剂对JAK/STAT信号通路进行阻断,可延缓LN的疾病进展,提高生存率。
3.3 中药 中医中药在治疗LN中具有增强免疫力、降低复发率,同时减轻毒副作用的优点。随着对中药治疗LN的研究增多,部分学者发现中药治疗LN与JAK/STAT信号通路也存在一定联系[20,40-42]。青蒿素是从中草药青蒿中提取的半合成衍生物,DANG等[40]在实验中发现,青蒿素治疗可抑制JAK2和STAT3的磷酸化,减少IL-21在MRL/lpr小鼠肾脏中的表达,改善肾功能,提高存活率,推测青蒿素或许是通过阻断JAK2/STAT3信号通路的传导从而抑制促炎症因子的产生,延缓肾脏损伤。雄黄是一种广泛应用于临床的中药方剂,XU等[20]应用高剂量纳米雄黄混悬液给MRL/lpr小鼠灌胃后,小鼠肾组织中STAT1磷酸化被抑制,血清尿素氮和肌酐水平降低,24 h尿蛋白含量下降,提示纳米雄黄可能通过下调p-STAT1的表达发挥对LN的治疗作用。吴洋等[41]发现,应用益肾养阴合剂治疗后MRL/lpr小鼠的尿蛋白含量逐步降低,肾脏IgG沉积减少,JAK2、STAT3的磷酸化水平明显降低,IL-17表达下降,提示益肾养阴合剂或许通过抑制JAK2/STAT3信号通路的激活从而减少IL-17的分泌,发挥对MRL/lpr小鼠肾脏的保护作用。NIE等[42]也在实验中发现,与控制组MRL/lpr小鼠相比,黄连解毒汤治疗组小鼠的肾小球内皮细胞、系膜细胞和肾小管上皮细胞中的STAT3磷酸化被抑制,24 h尿蛋白含量、血清尿素氮和肌酐水平下降,肾脏病理情况改善,小鼠死亡率降低,故提出黄连解毒汤可能是治疗LN的潜在药物,其作用机制可能是抑制p-STAT3在肾脏的表达。以上实验结果提示,多种中药可能通过抑制JAK/STAT信号通路发挥对LN的治疗作用,研发能有效阻断该信号通路的中药具有良好的应用前景。
4 总结与展望
JAK/STAT信号通路作为细胞因子发挥生物学效应的一个重要通路,与LN的发生发展存在密切联系,但目前二者的相关性研究中还存在许多问题需要解决。首先,LN的发病机制尚无定论,JAK/STAT信号通路在其中发挥的作用也尚未明确。其次,JAK/STAT信号通路受多种因素的调节,在LN中产生的不同效应有待进一步阐明。因此,深入探讨JAK/STAT信号通路在LN发生发展中的作用,不仅可以为LN的发病机制研究提供靶点,还可以为LN的临床治疗带来更有效的药物。