一例鸡细小病毒、鸡传染性贫血病毒及鸡传染性支气管炎病毒共感染病例的检测
张 龙,林裕胜,江锦秀,张靖鹏,黄潇航,胡奇林*
(1.福建省农业科学院畜牧兽医研究所,福建 福州350013;2.福建农林大学动物科学学院,福建 福州350002)
0 引言
【研究意义】鸡传染性支气管炎是由鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起的一种具有重大经济影响的病毒病[1]。鸡传染性支气管炎的病变部位主要取决于毒株对不同组织的亲嗜性,通常都会表现出咳嗽、喘气、啰音、精神沉郁等临床症状,6周龄以内的死亡率在25%~40%。病鸡死亡原因可能是由于IBV的直接感染,也可能是死于之后的细菌继发感染[2]。鸡细小病毒(Chicken parvovirus,ChPV)是导致鸡群发生肠道疾病的重要病原之一,影响鸡的肠道健康,引起腹泻、生长发育不良等症状[3]。鸡传染性贫血病病毒(Chicken infectiousanem ia virus,CIAV)是造成2~3周龄鸡群发生贫血和免疫抑制的主要病因之一,通常成年鸡感染CIAV时不会产生明显的临床症状。由于该病原造成的免疫抑制等原因,往往会增加继发感染的可能性,导致严重的经济损失[4]。目前对IBV和CIAV感染的研究比较多,ChPV的病例虽然较少却也偶见报道。但至今未见三者共感染病例。本研究从表现出呼吸症状以及腹泻症状的病死鸡体内检测到IBV、CIAV和ChPV,表明现阶段福建省内部分鸡群存在ChPV、CIAV、IBV的共感染,可为后续福建省内开展相关病原研究及流行病学提供参考。【前人研究进展】不同病毒的共感染可能会对机体造成更严重的影响。当前,IBV与其他病原的共感染已然成为常态[5]。Erfan等[6]的研究表明,在感染CIAV的前提下,再发生IBV感染时会加剧病情及延长发病持续时间,二者的共同感染可能会促进IBV的传播和进化。与此同时,CIAV在国内有较高的发生率,Yao Shuai等[7]的研究表明在2014—2015年间,国内的CIAV的阳性率为13.30%,和其他病毒的混合感染是主要的感染类型,占总感染的55.56%。李岳等[8]的研究也得到类似的结果,国内部分地区(13个省市)CIAV的阳性检出率为14.43%,和其他病毒的混感占感染总量的52.94%。当前国内缺乏ChPV的流行病学数据,Zhang等[9]对中国广西壮族自治区的ChPV发病情况进行调查发现,ChPV在广西的商品鸡场中普遍存在(51.73%),在所有阳性样本中,从肉鸡中检测到的频率最高(64.18%),其次是种鸡和蛋鸡,相较于封闭式鸡舍,饲养在开放式鸡舍中的鸡群更容易感染ChPV。【本研究切入点】2021年1月,福建省南平市某肉鸡养殖户饲养的60~90日龄辰山牧鸡(南平地区本土品种)开始出现以呼吸道症状为主、并伴有腹泻情况的病情。根据临床表现及剖检观察,初步诊断为IBV感染。该养殖户同一场地多批次饲养,每批鸡都进行过常规的IBV免疫,每批次鸡饲养至60~90日龄时均会出现类似的病症,该场通过使用抗病毒药物有效减少了鸡只死亡。根据流行病学特点、临床表现及剖检观察,初步诊断为IBV感染,具体病因有待进一步探明。【拟解决的关键关题】为了进一步明确具体病因,对南平市该养殖户送检的病料进行分子生物学检测,明确病原,为该病的防控提供科学依据。
1 材料与方法
1.1 病料来源与采集
发病鸡由福建省南平市某肉鸡养殖户提供,病鸡临床表现为消瘦、咳嗽、喘气,排绿色稀粪。采集病鸡肝、心、脾、肺、肾、小肠等器官,−20℃保存,备用。
1.2 主要试剂
EasyPure Viral DNA/RNA Kit、TransScript®One-Step gDNA Removal and cDNA Synthesis Super M ix,北京全式金生物技术有限公司;universal DNA Purification Kit,天根生化科技(北京)有限公司;2×CataAmp High Fidelity PCR M ix,北京开拓赛思生物技术有限公司;pMC100-MB Top-cloning M ix,武汉齐美欣科生物技术有限公司;DH5α感受态细胞,本实验室保存。
1.3 引物设计与合成
利用Oligo 7.0软件,根据GenBank公布的鸡传染性支气管炎病毒(IBV)、鸡传染性喉气管炎病毒(Laryngotracheitis virus,LTV)、鸡 新 城 疫 病 毒(Newcastle disease virus,NDV)、传染性法氏囊病毒(Infectiousbursal Disease virus,IBDV)、禽肾炎病毒(Avian nephritis virus,ANV)、禽腺病毒(Fow l adenovirus,FadV)、鸡细小病毒(ChPV)基因序列,设计相应引物,参考相关文献[10]设计鸡传染性贫血病病毒CIAV特异性引物(表1),引物委托尚亚生物技术(福州)有限公司合成。

表1 所用引物及其序列Tab le 1 Prim ersand sequences app lied
1.4 组织匀浆制备
用无菌的1×PBS溶液将脏器冲洗干净后,称取5 g组织,剪碎,加入20m L无菌1×PBS溶液;加入双抗(每1m L组织匀浆加入2000 IU·m L−1青霉素和2000μg·m L−1链霉素)进行研磨,制成组织匀浆。将组织匀浆放置于4℃冰箱中,作用4 h;−70℃反复冻 融3次,6 000 r·m in−1,4℃离 心10 m in,取 上清,分装备用。
1.5 细菌分离培养
无菌环境下,用接种环分别接触肝、心、脾、肺、肾等脏器的深部组织并划线接种于血琼脂平板上,37℃培养箱过夜。
1.6 核酸提取
取处理好的组织匀浆,按照全式金DNA/RNA提取试剂盒操作说明提取核酸样本,−20 ℃保存。并取部分核酸样本,按照全式金反转录试剂盒的操作说明,进行RT-PCR,反转录产物置于−70℃保存。
1.7 PCR鉴定
以提取后的核酸样本为模板,进行LTV、ChPV、FadV、CIAV的常规PCR;以反转录后的cDNA为模板,进行IBV、IBDV、NDV、ANV的常规PCR。
PCR反应体系为20μL:10μL 2×ProTaqMaster M ix;4μL RNase FreeWater;4μL模板;上/下游引物各1μL。PCR反应条件:94℃预变性5m in;94℃45 s,53℃45 s,72℃45 s,共35个循环;72℃延伸10m in,4℃保存。在反应结束后,PCR扩增产物使用1.0%的琼脂糖凝胶进行电泳检测。并按照胶回收试剂盒操作说明,回收PCR产物,经连接转化后送往福州尚亚生物技术有限公司进行测序。
1.8 基因序列分析
应用PCR方法扩增ChPVNS1基因、IBVS1基因和CIAVVP1基因,将测序结果与GenBank数据库中收录的部分鸡细小病毒参考株(33株)、3株火鸡细小病毒(Turkey parvovirus,TuPV)参考株NS1基因,26株IBV参考株S1基因和36株CIAV参考株(表2)VP1基因序列进行比对;采用Mega7.0软件的Neighbor Joining方法进行上述基因的遗传进化树绘制。
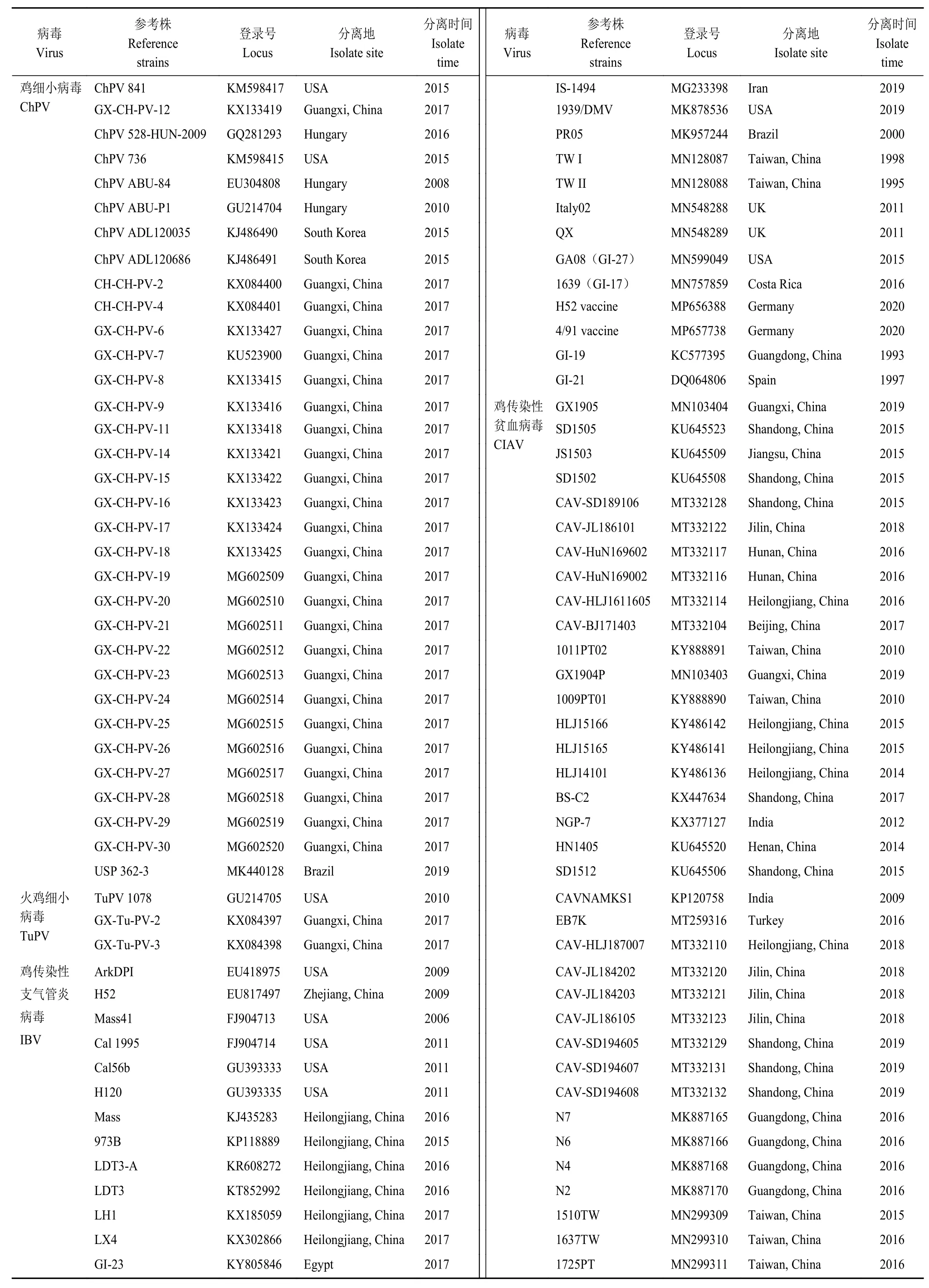
表2 鸡细小病毒、鸡传染性支气管炎病毒、鸡传染性贫血病毒参考株Table 2 Reference strains of ChPV,IBV,and CIAV
2 结果与分析
2.1 临床症状和剖检病变
临床表现为呼吸急促,咳嗽,喘气,排绿色稀粪。剖检可见病鸡消瘦,输尿管堵塞严重,肾脏肿大,呈典型的“花斑肾”(图1),腹气囊浑浊,充斥大量气泡;肠管苍白且有肿胀(图2)。
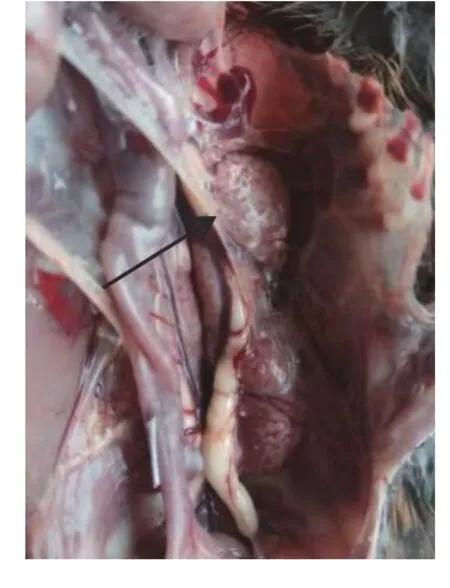
图1 花斑肾Fig.1 Spotted K idney

图2 腹气囊及肠管病变Fig.2 Abdom inal air sac and bowel disease
2.2 细菌培养结果
血琼脂平板上未发现细菌生长。
2.3 PCR扩增结果
使用1.0%凝胶,于125 V、299mA条件下电泳25m in。结果显示(图3),使用CIAV、IBV、ChPV的特异性引物进行扩增,分别在675、215、937 bp处出现各自对应的条带,与目的条带大小一致。按照胶回收试剂盒(天根)操作说明,进行DNA纯化回收,连接、转化后,将菌液送往福州尚亚生物技术有限公司测序,利用Blast将测序结果进行对比,本研究测定的毒株与IBV的同源性为76.9%~84.3%,将其命名为FJNP210113;与CIAV的同源性为91.19%~92.14%,将其命名为FJ2101;与ChPV的同源性为92.17%~100%,将其命名为ChPV-FJNP。
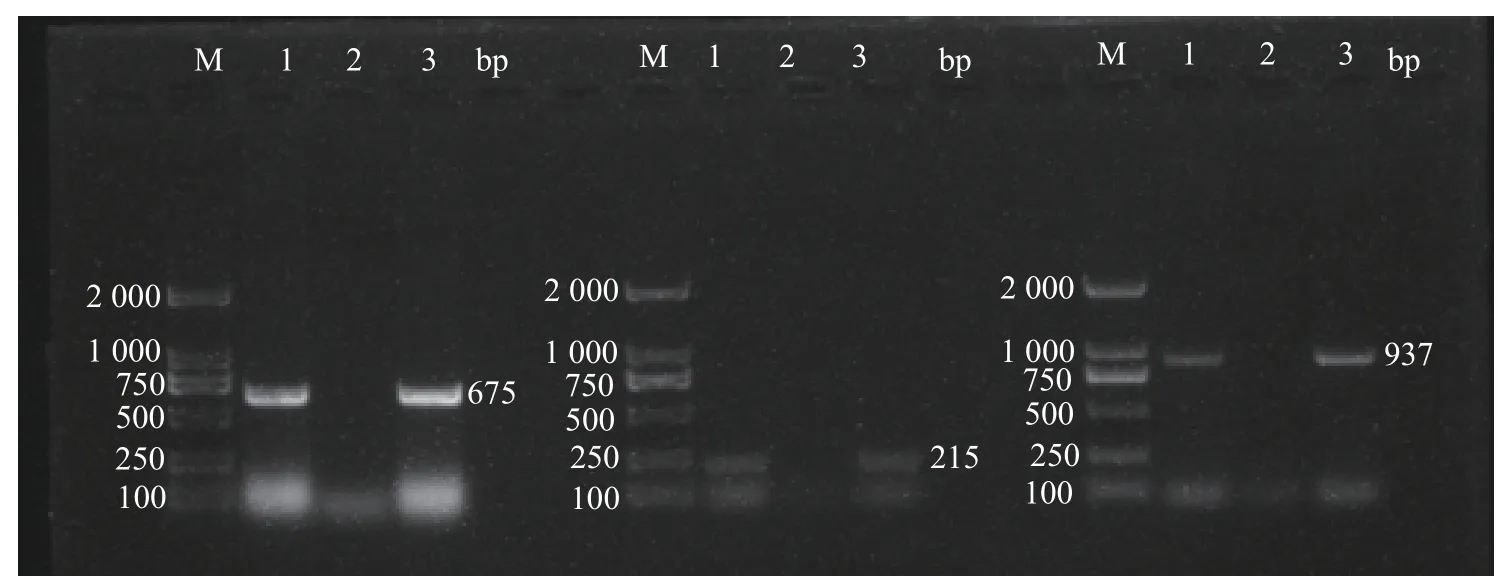
图3 PCR扩增结果Fig.3 PCR am p lification results
2.4 遗传进化分析
登录NCBI,用Blast对ChPVNS1基因核苷酸序列进行同源性分析(图略),结果显示,ChPV-FJNP分离株与26株中国参考株的同源性为92.17%~100%;与美国参考株ChPV-736的同源性为95.58%,与2株匈牙利参考株ChPV-ABU-84、ChPV-ABU-P1的同源性分别为93.87%、97.73%;与3株韩国参考株的同源性为93.14%~93.25%;与巴西参考株的同源性为96.18%;与火鸡细小病毒(TuPV)的同源性为77.04%~77.48%。应用MEGA7.0软件的Neighbor Joining方法构建遗传ChPVNS1基因进化树(图4),从图中可见,ChPV-FJNP与中国广西参考株ChPVGX-CH-28处于同一分支,与中国广西参考株ChPVGX-CH-12、ChPV-GX-CH-9、ChPV-GX-CH-17、ChPVGX-CH-19、ChPV-GX-CH-25和韩国参考株ADL120035、ADL120686处于同一大分支。
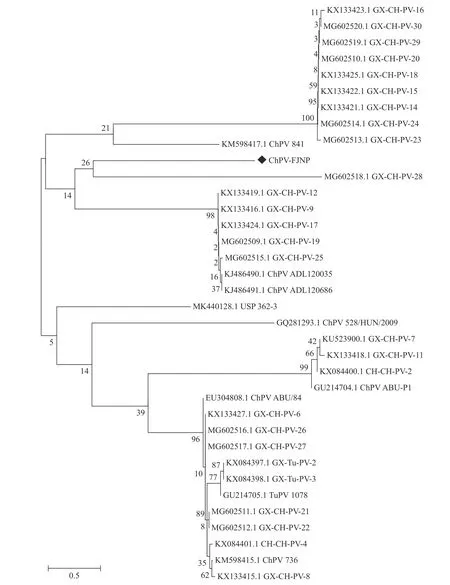
图4 ChPV NS 1基因遗传进化树分析Fig.4 Phylogenetic analysis on ChPV NS1 gene
用Blast对IBV FJNP210113株S1基因核苷酸序列进行同源性分析发现,IBV FJNP210113株与参考株LDT3的同源性为84.1%;与参考株GI-19、参考株LX4、参考株QX的同源性分别为82.9%、82.6%、83.1%;与参考株TW I的同源性为81.1%,表明FJNP210113株S1基因发生了较大变化。应用同上方法构建S1基因核苷酸序列遗传进化树(图5),发现IBV分离株FJNP210113与参考株KT852992(LDT3)的遗传距离最近。

图5 IBV S1基因遗传进化树Fig.5 Genetic evolutionary tree of IBV S1 gene
CIAV分离株FJ2101进行的Blast分析结果(图略)显示,分离株FJ2101与参考株GX1904P的同源性为92.6%,与参考株SD1502的同源性为92.1%,与参考株HLJ15165的同源性为91.5%。基于CIAVVP1基因的遗传进化分析结果(图6)显示,分离株FJ2101处于单独的一个分支,表明该分离株与现有参考株的亲缘关系较远,可能发生了变异。

图6 CIAV VP1基因遗传进化树Fig.6 Genetic evolutionary tree of CIAV VP1 gene
3 讨论
CHACÓN等[11]从表现出呼吸及腹泻症状的肉鸡肠道中分离到2株IBV毒株,通过回归实验证实,可以在肠道、肾脏等多个器官中检测到分离的毒株,表明同一种基因型/血清型的病毒可能表现出不同的组织嗜性和多种病理表现型,从肠道中分离到的毒株没有对肠道细胞造成明显的损伤,除了表现明显的呼吸道症状以外,并没有表现出腹泻症状。因此,分离株FJNP210113或许只是导致病鸡发生呼吸道症状的原因。目前我国主要的流行IBV基因型是QX型[12],最早是王玉东等[13]在表现为腺胃肿大的病鸡身上分离。除了表现腺胃肿大以外,QX型IBV也能导致呼吸系统疾病、生殖道以及肾脏疾病。然而从遗传进化树可以得知,分离株FJNP210113不属于QX型,也不属于该养殖户使用的疫苗株(H120),基于分支上来看,本研究中的分离株处于LDT3基因型和TWⅠ基因型之间,表明分离株的S1基因已经发生了改变。
鸡传染性贫血病毒能够引起鸡群的免疫抑制的发生,是造成免疫失败的原因之一,该病毒的传播方式包括垂直传播和水平传播两种途径[14]。有研究表明,病毒诱导的免疫抑制在IBV的流行过程中发挥重要作用,在免疫力降低的前提下,发生IBV感染时,能够产生更严重和持续的临床症状和病变[15]。Kum iko等[16]的研究也证实这一点,CIAV和IBV共感时,雏鸡死亡率会显著升高。本研究中该养殖户死淘率偏高或许与此有关,感染CIAV后导致鸡群发生免疫抑制,加剧了其他病原感染程度,使得病程更持久,死亡数量增加。至于为何在按照正常免疫程序进行免疫后该场依然多次爆发鸡传染性支气管炎的原因,可能是场地消毒不彻底,春季温差较大,以及该场所使用的疫苗株(H120)与该场爆发的IBV毒株之间交叉保护力低的缘故。本研究中,CIAV分离株FJ2101处于一个独立的分支,表明该分离株可能发生了变异,其原因有待进一步研究。
ChPV的传播方式与CIAV一样,在鸡群中也是通过垂直传播[17]和水平传播两种方式,病鸡是否表现出相应的症状及病理表现主要和肠道内的病毒载量的高低有关[18]。当鸡群受到ChPV感染时,临床上主要表现出腹泻、泄殖腔附近有粪便粘连、嗜睡、精神沉郁、羽毛杂乱、矮小和发育迟缓等症状,但是不会引起肠道宏观上明显的病变,因此需要注意ChPV和其他病毒或者细菌的共感染[19]。由于ChPV在体外不易分离,在鸡群中检测ChPV通常是通过发现病毒DNA。通常认为,ChPV的靶细胞位于肠道,但是在病鸡的法氏囊、脾脏、胸腺等免疫器官中也能检测到病毒核酸[20]。该病例中ChPV的存在可能是产生腹泻的原因之一。ChPV能够对肠道细胞造成损伤,继而产生严重的腹泻。由遗传进化分析树可知,不同地区之间的ChPV差异并不明显,表明ChPV之间的差异可能和地域无关。目前缺乏合适的培养体系,NUÑEZ等[21]通过鸡胚卵黄囊途径连续盲传三代,胚体出现明显病变,并从胚体和卵黄中分离到ChPV。高倩文等[22]采用同样的卵黄囊途径接种,未能从胚体和卵黄中检测到病毒,推测在混感情况下,其他病毒的存在可能会对ChPV的复制造成干扰。本研究从病料中鉴定出ChPV后,曾将组织匀浆通过尿囊腔途接种10日龄SPF鸡胚,试图对ChPV进行分离,结果鸡胚出现了死亡,胚体也表现出水肿、出血、发育不良等症状,然而却未能从尿囊液和胚体上检测到ChPV的核酸。目前还没有针对这3种病原的特效药物,该养殖户通过使用某些抗病毒药物降低了该场的死淘率,或许是因为抗病毒药物能够干扰肠道中ChPV的复制,使病鸡肠道逐渐恢复了正常功能,减少了鸡只死亡。
本研究从送检的病鸡中检测到CIAV、ChPV以及IBV,初步判断该场发病的原因是由于3种病原共感染导致。然而这3种病毒是否是本病的确切病原,ChPV和CIAV在本病例中具体发挥什么作用,以及抗病毒药物是否能够对ChPV的复制过程起到干扰,还需要进行动物回归试验进行验证。
本研究首次报道了ChPV、IBV、CIAV等3种病原的共感染病例,为福建省ChPV、IBV、CIAV的流行病学研究和防控提供了参考。

