茶树MYC转录因子家族的全基因组鉴定及表达分析
郑玉成,谷梦雅,毕婉君,胡清财,王鹏杰,叶乃兴,孙 云
(福建农林大学园艺学院/茶学福建省高校重点实验室,福建 福州350002)
0 引言
【研究意义】茶Camellia sinensis(L.)O.Kuntze是重要的经济作物,以其独特的风味而闻名。前人研究表明,茉莉酸在茶叶加工过程中香气的形成起到了重要作用[1]。髓细胞组织增生蛋白(Myelocytomatosis proteins,MYC)是植物茉莉酸信号转导途径中的重要转录因子。因此,对茶树MYC家族进行全面的生物信息学分析,预测各成员潜在功能,研究其在不同组织及不同胁迫处理下的表达模式,对茶叶品质的改善具有重要意义。【前人研究进展】MYC转录因子是bHLH家族成员中的一个亚族,具有bHLH和bHLH_MYC_N两个十分保守的结构域。可与G-box(CACGTG)顺式作用元件结合并与其突变体(5′-CACATG-3′、5′-CAC-GTG-3′)表现出较高亲和性[2]。前人研究表明,MYC转录因子作为转录激活因子在茉莉酸触发的级联信号反应中起重要作用[3]。正常条件下,植物体内茉莉酸保持在相对较低的水平,Jasmonate ZIM-domain(JAZ)抑制子与MYC2相互结合并抑制下游胁迫响应基因的表达[4]。当植物响应损伤胁迫或生物胁迫时,植物细胞中会大量积累茉莉酸,并被COI1感知。随后,JAZ蛋白被COI1介导的E3泛素化降解从而释放MYC转录因子,激活下游茉莉酸(Jasmonic acid,JA)响应基因的表达[5]。另外,拟南芥中AtMYC3与AtMYC4被发现可与AtMYC2形成同源和异源二聚体来结合G-box元件参与茉莉酸信号调控[6]。大量研究发现,MYC转录因子还参与了茉莉酸与其他植物激素的串扰网络,共同调节植物生命活动。在拟南芥中,MYC2可与Ethylene-insensitive3(EIN3)相互作用,抑制JA的伤口反应及草食诱导基因表达,调节茉莉酸和乙烯信号的拮抗作用。MYC2同样也可以作为脱落酸依赖性干旱的转录激活因子,并且是水杨酸依赖性防御所必需的[7]。除了参与茉莉酸信号通路,MYC转录因子也广泛参与了植物叶片衰老、根毛发育等生命活动及花青素、芥子油苷、和萜类等次级代谢物的合成[8–10]。拟南芥AtMYC1基因参与调控种子萌发[11];水稻OsMYC2与樱花素的生物合成密切相关,在MEP萜类合成途径中,4个合成异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)基因受到OsMYC2调控[12–13];在玉米中,ZmMYC7在抵抗禾谷镰孢和玉米大斑刚毛座腔菌的侵染中起到了关键作用[14];烟草NtMYC2可参与尼古丁及相关生物碱合成;长春花Catharanthus roseusCrMYC2可有效激活AP2/ERF结构域转录因子ORCA3的表达,参与长春花萜类化合物的合成[9]。目前,该家族已经在拟南芥、水稻、红豆杉、玉米等多个物种中被鉴定。【本研究切入点】茶产品的独特风味依赖于其丰富的次级代谢产物。植物MYC家族广泛参与植物生长发育和次级代谢合成,但有关植物MYC基因家族的研究主要集中在模式植物中,在茶树中进行全基因组范围内的鉴定及初步预测MYC各成员的潜在功能还鲜有报道。另外,随着组学技术的发展,高质量茶树基因组的发布为本研究提供基础[15]。【拟解决的关键问题】本研究利用生物信息学手段鉴定茶树MYC基因家族所有成员,系统分析了该家族成员的基本结构特点,利用前期转录组数据及qRT-PCR技术研究在不同组织、不同胁迫处理下的表达情况,为进一步探明茶树MYC各成员功能奠定基础。
1 材料与方法
试验于2020年3~11月在福建农林大学园艺学院茶学重点实验室进行。
1.1 供试材料
2年生铁观音(C. sinensiscv.Tieguanyin)以相同的栽种条件(盆栽土培)种植在福建农林大学试验基地,选取长势良好、生长一致的茶树植株分别进行下述处理:
干旱胁迫:将茶树从盆土中取出,用纯水将根部土壤冲净后,迅速置入10%(m/V)PEG-6000溶液中。
低温胁迫:将在正常温度(24±2℃)下生长的茶树植株连盆转移至4℃的生长室。
脱落酸(ABA)及茉莉酸甲酯(MeJA)处理:用新鲜制备的100μmol·L−1ABA和MeJA分别喷洒不同茶树植株叶片。
收集以上处理后6 h的一芽二叶(无病害)及未处理的叶片(对照),每个处理3次重复,包入锡箔纸后,迅速置于液氮中固样,−80℃冷冻保存,用于后续RNA提取。
1.2 茶树MYC基因家族成员鉴定
为了准确鉴定所有的茶树MYC成员,结合使用Blast比对和HMMER搜索两种方法。从拟南芥基因组数据库下载所有AtMYC成员氨基酸序列作为诱饵,在茶树基因组网站进行Blast比对(http://pcsb.ahau.edu.cn,BLASTP,E value≤1×10−5)[15];从Pfam数据库中下载MYC蛋白的隐马尔可夫模型(Pfam accessions:PF14215 and PF00010,http://pfam.xfam.org/),并利用HMMER 3.0在茶树蛋白数据集中搜索潜在MYC序列(Hmmsearch, E value≤1×10−5)[16]。最后,使用CDD(https://www.ncbi.nlm.nih.gov/cdd/)和SMART(http://smart.embl-heidelberg.de/)网站进一步确认鉴定到的潜在MYC基因是否具有完整的bHLH和bHLH_MYC_N保守结构域。
1.3 染色体定位及共线性分析
使用互惠Blast将草图中的基因与染色体级别的基因进行一一比对以获得相应的染色体位置信息。茶树染色体位置信息在茶树基因组数据库下载,使用在线网站MG2C(http://mg2c.iask.in/mg2c_v2.0/)绘制CsMYC基因家族染色体位置信息图;利用TBtools软件进行MYC基因共线性分析,其中葡萄基因组数据下载自ensembl数据库(http://plants.ensembl.org/index.htm l)。
1.4 多序列比对与系统发育树构建
使用R包ggmsa进行多序列比对分析;使用ggtree构建茶树CsMYC系统进化树,建树方法为邻接法(NJ),boostrap值设定为1 000重复。数据来源方面,水稻MYC家族成员蛋白序列来自网站TIGR(http://www.tigr.org/tdb/e2k1/),拟 南 芥MYC家 族成员蛋白序列来自网站TIAR(http://www.arabidopsis.org/),云杉MYC家族成员蛋白序列来自网站NCBI(http://www.ncbi.nlm.nih.gov/),其余物种MYC家族成员蛋白序列均下载自JGI(http://genome.jgi-psf.org/)。
1.5 CsMYC基因和蛋白质的结构分析
从茶树基因组网站(http://tpdb.shengxin.ren/)下载茶树基因组注释文件,使用MEME在线网站(http://meme-suite.org/tools/meme)对茶树CsMYC进行保守结构域分析。使用TBtools软件进行基因结构和蛋白保守结构域可视化。
1.6 茶树CsMYC基因激素处理、干旱胁迫及组织特异性表达分析
根据实验室前期的方法[17],从SRA(Sequence read archive)网站下载茶树8个组织原始RNA-seq数据(登录号:PRJNA381277),使用TopHat2[18]将质控后的数据比对到茶树基因组,使用HTseq[19]软件计算基因FPKM值。从茶树基因组网站(http://tpdb.shengxin.ren/)下载茉莉酸甲酯及冷胁迫处理后的茶树叶片表达谱。使用TBtools软件进行热图绘制。
1.7 实时荧光定量PCR分析
使用天根多糖多酚植物总RNA提取试剂盒提取上述试验样总RNA,使用全式金Easyscript One-step gDNA Removaland cDNA synthesis superM ix试剂盒合成cDNA用于实时荧光定量PCR。茶树MYC家族成员引物设计在primer3plus网站上进行(表1)。qRTPCR反应在CFX 96 Touch荧光定量PCR仪上进行,反应体系参照Transstart®Tip green qPCR superM ix试剂盒方法,反应程序为94℃30 s;94℃5 s;60℃30 s;40个循环。使用2−△△Ct方法计算基因相对表达量[20],并使用TBtools进行热图绘制。内参基因CsGAPDH登录号为GE651107。
1.8 茶树CsMYC成员潜在功能预测分析
为了进一步预测茶树MYC各成员的功能,使用茶树茉莉酸甲酯处理后茶树叶片表达谱数据(下载自茶树基因组网站,http://tpdb.shengxin.ren/),提取出CsMYC成员在处理后各时期的FPKM值,使用R包corrplot计算MYC各成员与其他所有基因的皮尔森相关系数及P值,默认相关性r≥±0.9且P≤0.05的基因与MYC有潜在调控关系。使用ClusterProfil包对与MYC各成员有潜在调控关系的基因集进行KEGG富集分析。
2 结果与分析
2.1 CsMYC家族成员的鉴定
为了全面鉴定茶树中所有的MYC家族成员,结合使用BlsatP比对和Hmmsearch搜索两种方法,手动删除冗余序列后,将鉴定到的所有潜在茶树MYC成员提交到CDD和SMART网站再次验证是否具有完整的保守结构域。最后,在茶树基因组中总共鉴定得到9个MYC家族成员,分别命名为CsMYC1~CsMYC9(表2)。CsMYCs的ORF氨基酸长度为442~1 003 aa,分子量为49.39(CsMYC9)~110.27 kDa(CsMYC5)。对茶树MYC家族的理论等电点及亲水性平均水平进行预测发现,所有成员理论等电点小于7,亲水性平均水平小于0,说明茶数MYC家族成员均为酸性亲水蛋白。对MYC家族成员的亚细胞定位进行预测发现,CsMYC家族成员主要定位在细胞核中。
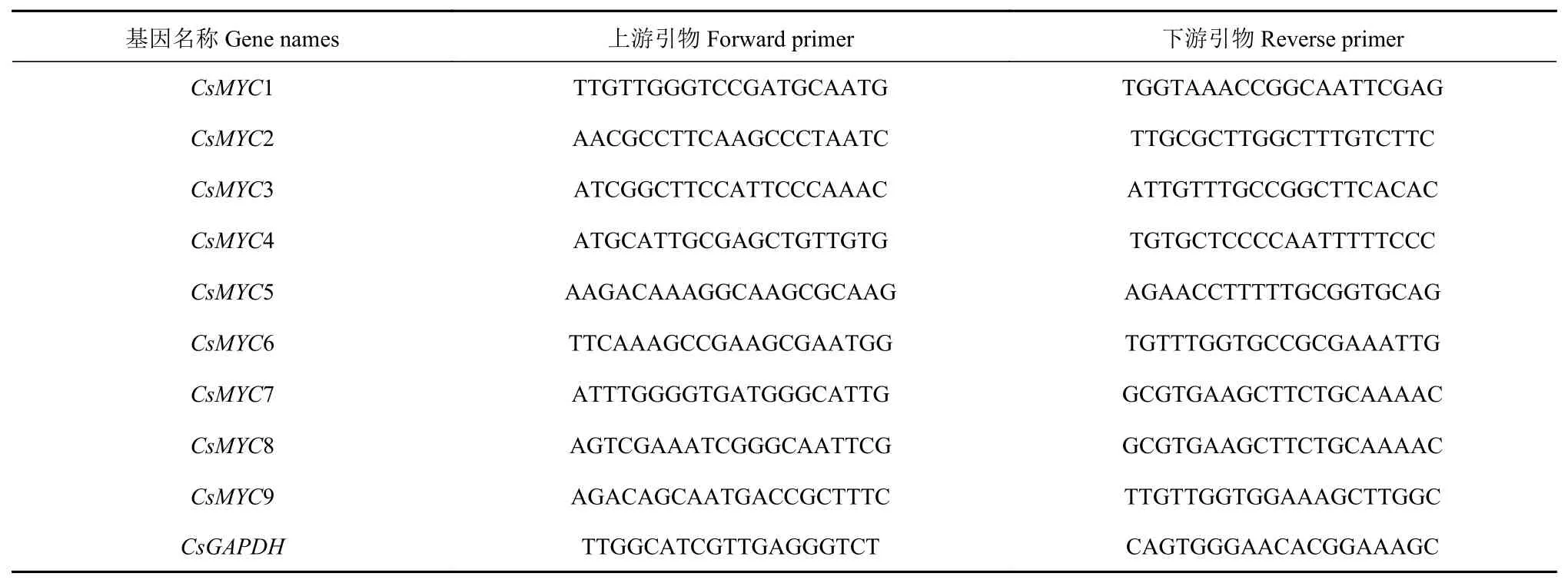
表1茶树CsMYC家族成员引物序列Table1 Primer sequence of CsMYC s in tea p lant

表2 茶树CsMYC家族成员特征Table 2 Information on CsMYC in tea plant
2.2 CsMYC成员的系统发育和分类分析
为了解MYC蛋白之间的进化关系,来自7个典型物种的53个MYC蛋白被用于构建系统进化树,包括小立碗藓Physcomitrella patens(苔藓类植物)、中华卷柏Selaginella moellendorffii(蕨类植物)、云杉Picea sitchensis(裸子植物)、水稻Oryza sativa和高粱Sorghum bicolor(单子叶植物)以及拟南芥Arabidopsis thaliana和茶树Camellia sinensis(双子叶植物)(图1)。值得注意的是,在对几个典型的藻类(红藻类、绿藻类及褐藻类)进行MYC同源基因鉴定时,并未发现MYC成员,说明MYC家族可能起源于陆生植物。进化树结果显示,MYC家族总共可以被分为8个保守亚家族(a~h)。其中,a与g亚族只包含苔藓类植物,b亚族只包含卷柏类植物,说明MYC在陆生植物进化过程中,苔藓类与卷柏类植物各自形成特有的亚族。茶树MYC成员主要分布在3个亚家族中(e、f和h),这3个亚家族中只包含种子植物,推测茶树MYC成员与较古老的苔藓类植物与蕨类植物产生明显的功能分化。前人研究表明,f亚族中的A tMYC2、AtMYC3和AtMYC4以及e亚族中的AtMYC10(bHlH14)功能冗余参与到茉莉酸信号转导途径中[5],表明该亚族中的茶树MYC家族成员CsMYC2、5以及CsMYC1、6、9可能在茶树中行使相似功能。

图1 MYC家族系统发育分析Fig.1 Phylogenetic analysis of MYC fam ily
2.3 CsMYC成员的结构和保守结构域分析
为了更好地了解茶树MYC家族成员之间的结构多样性,分析CsMYC各成员的外显子、内含子结构,保守结构域分布情况以及构建CsMYC成员之间的系统发育树。结果如图2-a所示,CsMYC成员之间自然地分为2个亚组(Ⅰ~Ⅱ),其中CsMYC2、5、1、6、9被归为Ⅱ亚组。同时,发现Ⅰ亚组与Ⅱ亚组之间9号模体的所在位置出现了漂移。另外,CsMYC6、9上丢失了7号模体。CsMYC2、5、6、9上发现了可能发挥功能的潜在模体。以上结果表明,茶树MYC在进化过程中模体出现了漂移和丢失,这可能是导致茶树MYC家族功能分化的重要原因。对茶树CsMYC家族基因结构进行分析发现(图2-b),CsMYCs基因结构较为简单,只含有1~3个内含子。另外,对CsMYC家族成员的保守结构域蛋白序列比对发现(图2-c),CsMYCs具有保守bHLH和bHLH_MYC_N两个结构域。其中,bHLH结构中含有高度保守的H4-V5-E8-R9-R11-R13序列,其中第9位和第11位精氨酸是与E-box(CANNTG)或G-box(CACGTG)结合的必需位点。
2.4 CsMYC染色体定位及共线性分析
全基因组加倍事件和基因串联重复事件是基因家族成员加倍的主要方式[21]。CsMYCs家族成员分布在5条染色体上,其中12号染色体上的3个成员和13号染色体上的两个成员距离均大于1 M,说明CsMYC家族成员不存在基因串联重复事件(图3-a)。对茶树MYC家族成员与葡萄(双子叶)、水稻(单子叶)的种间进行共线性分析(图3-b)。结果显示,茶树中有8个MYC成员与葡萄中4个基因存在共线性,表明茶树与单子叶植物葡萄的分化时间较短,MYC成员在功能上也更为相似。

图3 CsMYC成员染色体定位及共线性分析。Fig.3 Chromosom e location and collinearity analysis of CsMYC s
2.5 CsMYC成员在茶树不同组织中的表达分析
为了更好了解CsMYC基因各成员在茶树生长发育中的潜在作用,下载8种具有代表性的茶树组织转录组数据以研究其不同表达模式。如图4所示,除了CsMYC2和CsMYC9外,其他成员在芽和叶中表达量较高(FPKM>10),推测CsMYC家族成员在茶树芽叶发育中发挥重要作用。另外,CsMYC各成员在不同组织中也显示出特异表达模式,CsMYC1在成熟叶和茎中有较高表达;CsMYC7在茎中有较高表达;CsMYC4、5和8在花中显著表达;CsMYC2和CsMYC3在老叶中转录水平显著增加。同时,CsMYC2在花中被显著抑制表达,CsMYC4在茶树老叶和果实中被显著抑制。以上结果显示,茶树MYC各成员在茶树的生长发育过程中发挥不同的作用。
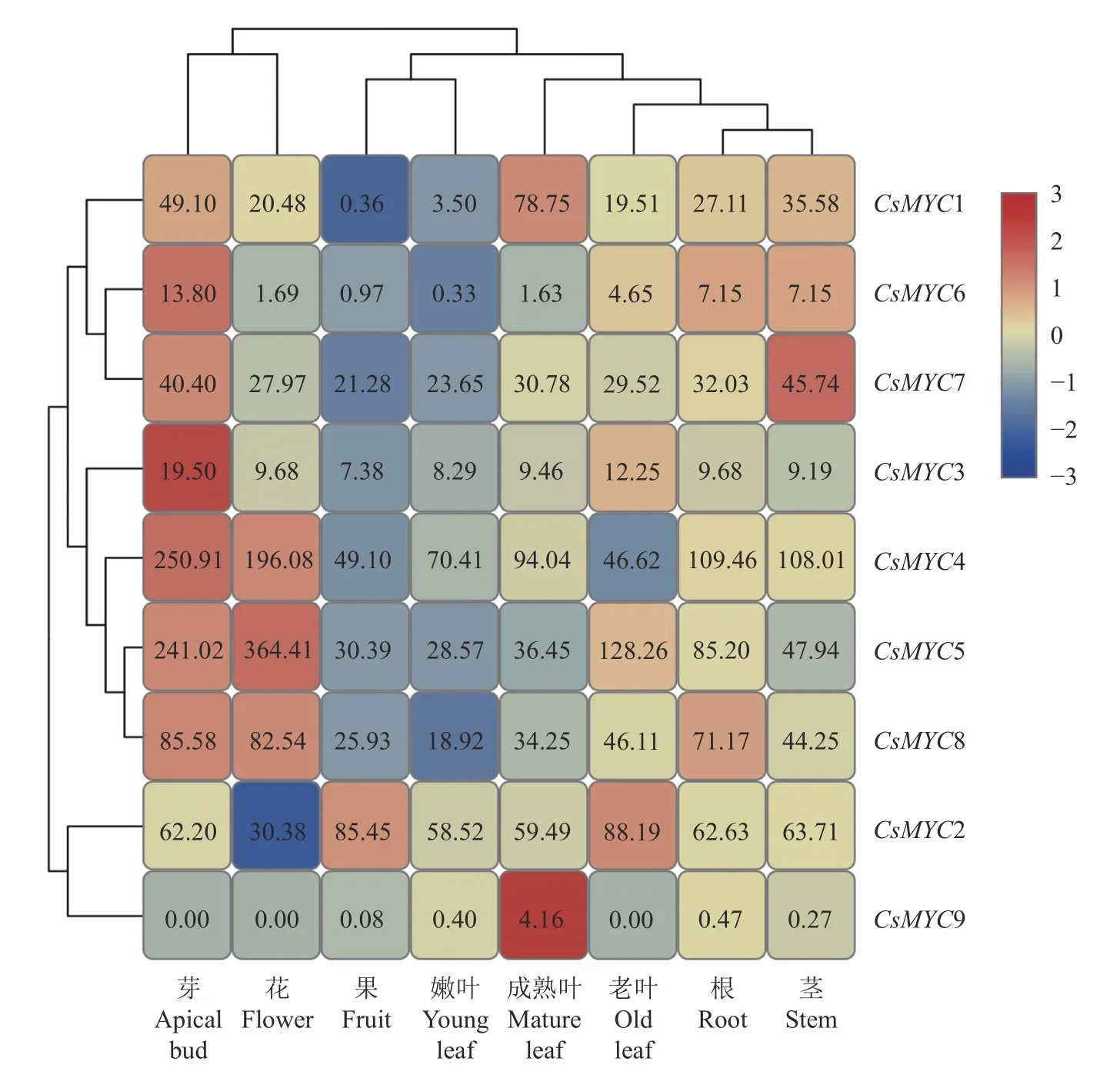
图4 CsMYC基因在8个代表性茶树组织中的表达模式热图Fig.4 CsMYC expression patterns in 8 rep resentative tea p lant tissues
2.6 CsMYC家族响应非生物胁迫处理的表达分析
为了初步了解CsMYC基因家族成员对非生物胁迫的响应模式,利用q-RT-PCR技术测定了包括低温处理(4℃)、干旱处理(PEG)、赤霉素和茉莉酸处理下所有CsMYC成员的相对表达量。如图5所示,所有MYC成员在茉莉酸处理后的6 h,均明显上调表达(倍数变化>2)。在低温处理下,CsMYC4、CsMYC5和CsMYC7的转录水平明显提高,而CsMYC6被抑制表达。在干旱处理6 h后,CsMYC2、CsMYC3和CsMYC9转录本数量明显增加,说明这3个成员可能参与茶树干旱胁迫响应。在赤霉素处理后,CsMYC2、CsMYC4和CsMYC7的表达量明显提高。以上结果表明,茶树MYC各成员在茶树响应非生物胁迫中扮演了重要角色。

图5 CsMYC基因响应非生物胁迫的表达模式热图Fig.5 Expression patterns of CsMYC s in response to abiotic stresses
2.7 CsMYC家族成员功能预测
利用前期的转录组数据,对与CsMYC各成员有潜在调控关系的基因集(r≥0.9且P≤0.05)进行KEEG富集分析。结果如图6所示,发现MYC各成员广泛参与到茶树的次级代谢的生物合成与降解的途径中。这可能与茉莉酸作为植物的生物与非生物胁迫响应信号有关。一些CsMYC家族成员与茶树的挥发性香气物质有关,例如,与CsMYC8和CsMYC9相关的基因集被显著富集到茶树萜类代谢途径;而与CsMYC4、CsMYC6和CsMYC9相关的基因集被显著富集到茶树脂肪酸合成代谢途径。大量研究表明茉莉酸作为茶叶加工过程中损伤胁迫的信号转导物质,表明这些CsMYC成员可能参与了茶树加工过程中的香气形成[1]。CsMYC1、CsMYC4和CsMYC7和茶树胁迫响应下的黄酮生物合成有关;CsMYC1、CsMYC3、CsMYC5和CsMYC8则和茶树胁迫响应下的光合作用有关。同时,我们发现除CsMYC4和CsMYC2外,其余7个成员均与茶树的氨基酸合成代谢有关,预示氨基酸在茶树响应胁迫中发挥了重要作用。

图6 CsMYC成员潜在调控基因集的KEGG富集分析Fig. 6 KEGG enrichment analysison gene clusters w ith potential role in regulatory function relating to CsMYC
3 讨论
前期大量研究表明,MYC蛋白广泛参与了植物生长发育和胁迫响应,并在水杨酸与茉莉酸、乙烯与茉莉酸、生长素与茉莉酸的串扰网络(Crosstalk)中发挥了重要作用[22]。目前,已经在草莓中鉴定到2个MYC成员[23],水稻和短柄草中鉴定到7个MYC成员[24],玉米中鉴定到8个MYC成员[25]。然而,有关茶树MYC家族成员数量、结构和功能却了解较少。本研究基于茶树基因组数据,总共鉴定到了9个CsMYC成员。
3.1 茶树MYC家族的进化
内含子和外显子可以通过获得或丢失(gain/loss)和插入或删除(insertion/deletions)在基因家族的多样性和进化中扮演了重要的角色[26]。前人研究表明,MYC家族成员经历了两次内含子丢失事件,一次是蕨类和苔藓类植(6~13个内含子)到种子植物,另一次是种子植物自身发生内含子丢失事件(0~3和3~6个内含子)[27]。在本研究中,茶树MYC成员数量介于0~3个内含子,说明茶树MYC成员在进化过程中可能经历了两次内含子丢失事件。最新研究认为基因中较少的内含子可以使植物更快速地应对环境变化[28]。因此,作为茉莉酸信号转导途径中的关键转录因子,MYC基因家族成员内含子丢失事件是茶树MYC家族进化的有效机制,可能使茶树可以更快速响应环境胁迫。
与前人研究结果相似,在对藻类基因组进行检索时,并未发现MYC家族成员[27],说明MYC家族可能起源于陆生植物。使用邻接法对53个MYC成员构建系统进化树,结果显示了一些具有谱系特异性(Lineage-specific)的MYC亚组。如,a与b亚组中只包含了小立碗藓MYC家族成员;b亚组中只包含了卷柏MYC家族成员;e亚组中只包含了双子叶植物(茶树与拟南芥);f亚组中只包含了种子植物。表明MYC家族可能在陆地植物基因组中经历了谱系特异性分化事件。对于茶树MYC成员,CsMYC1、CsMYC6和CsMYC9与双子叶植物直接聚为一类;CsMYC3、CsMYC4、CsMYC7和CsMYC8直接与被子植物聚为一类;CsMYC2和CsMYC5与种子植物直接聚为一类。以上结果表明,在漫长的进化过程中,茶树MYC家族成员可能经历了全基因组复制事件。
3.2 茶树MYC家族成员在不同茶树组织及非生物胁迫中的差异表达
MYC对植物的生长发育至关重要。8个不同茶树组织的转录组数据显示CsMYC家族成员在茶树的生长发育过程中起到了不同作用。前人研究表明,拟南芥AtMYC5在调控植物叶片衰老中起到了重要作用[29]。在本研究中,CsMYC2和CsMYC3在老叶中具有较高的表达水平。系统进化分析表明,CsMYC3与AtMYC5被归为同一个亚族。以上结果显示CsMYC2和CsMYC3可能参与了茶树叶片衰老的过程。另外,植物MYC转录因子也参与了根生长、毛状体萌生及花发育等过程[30−31]。通过茶树转录组数据分析表明,大部分CsMYC成员在茶树嫩芽叶中的表达水平极高;CsMYC4、5和8的转录本水平在茶树花中显著积累;CsMYC8在茶树根中表现出较高水平的表达量。结果表明CsMYC各成员协同或特异性参与了茶树的生长发育过程。
MYC作为茉莉酸信号转导途径的关键转录因子在植物响应非生物胁迫中同样发挥了重要作用。据报道,拟南芥两个MYC成员可以与ICE1相互作用以调控拟南芥的耐寒性[32]。玉米两个MYC成员ZmbHLH103和ZmbHLH104在干旱胁迫下显著上调[33]。荧光定量结果显示,所有CsMYC成员均响应茉莉酸处理;CsMYC2、CsMYC3和CsMYC9明显响应干旱胁迫处理;CsMYC4、CsMYC5和CsMYC7响应低温处理。预示茶树MYC家族成员同样参与到茶树的各种非生物胁迫响应中。
3.3 茶树MYC成员的潜在功能
MYC可以通过调控植物各种次级代谢物的生成来响应生物或非生物胁迫。拟南芥MYC3和MYC4参与了黄酮化合物的调控[8]。在水稻黄酮合成途径中,酰基辅酶A合成酶OsACS、查尔酮合成酶OsCHS及查尔酮异构酶OsCHI可由OsMYC2激活并显著提高黄酮类化合物的积累[13]。另外,水稻芳樟醇合成酶AtLIS、倍半萜合成酶同样可以通过OsMYC2由JA上调,调控水稻萜类化合物的合成[12]。最近的研究表明,水稻OsMYC2与拟南芥AtMYC2具有相似的功能,都可以增强整个JA合成途径来进一步放大JA信号,如激活脂氧合酶LOX及脂肪酸氢过氧化物裂解酶HPL的表达[34]。本研究中,通过使用皮尔森相关系数对与茶树各CsMYC成员有显著相关性的基因集进行KEGG富集分析。结果显示,茶树MYC家族成员主要涉及了茶树的次级代谢过程及植物光合作用相关通路。例如,与茶树CsMYC4、6、8、9显著相关的基因集被显著富集到挥发物相关通路;与CsMYC1、4和7显著相关的基因集被显著富集到黄酮合成相关通路。这预示着以上茶树MYC成员可能与茶树胁迫响应下次级代谢物的生成有关。在逆境胁迫下,植物可以通过提高体内氨基酸含量及光合速率来提高植物对逆境的适应性。如通过提高植物体内脯氨酸含量可以增强对盐胁迫的适应性[35];组氨酸被发现与植物抵抗重金属有关[36]。在逆境胁迫下,植物通过提高光合速率加速能量的贮存,有助于减少逆境对植物的伤害。在本研究中,我们发现除CsMYC4和CsMYC2外,其余7个成员均与茶树在茉莉酸胁迫下的氨基酸合成代谢有关;CsMYC1、3、5和8与茶树光合作用相关通路显著相关。以上结果表明,在逆境胁迫下,茉莉酸信号可能通过MYC来改变茶树体内氨基酸含量及光合效率,从而提高逆境胁迫下茶树的适应性。在今后的研究中,将重点关注CsMYC4、6、8、9这4个潜在参与茶树挥发物形成的候选成员,并进一步探究这些MYC成员在乌龙茶摇青过程中挥发性香气组分的形成的作用。
4 结论
本研究在茶树中总共鉴定到9个CsMYC家族成员,可分为3个亚族,每个成员均具有保守的bHLH和bHLH_MYC_N结构域;9个成员不均等分布在5条染色体上;各成员可能发生了内含子丢失事件,CsMYC具有组织表达特异性且在响应茶树茉莉酸等非生物胁迫中发挥了重要作用。另外,在今后的研究中,我们将重点关注CsMYC4、6、8、9这4个潜在参与茶树挥发物形成的候选成员,并进一步探究这些MYC成员在乌龙茶摇青过程中挥发性香气组分的形成的作用。

