m6A修饰调控的COL6A5对肺腺癌细胞侵袭能力的影响
王馨,黄嘉星,潘辉林,冯正富,汤锐明,邱惠思
据美国癌症学会统计,2020年全球新诊断肺癌220.02万例,因肺癌死亡的患者有180万例[1]。根据组织类型可将肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌约占所有肺癌病例的85%,其组织学亚型主要包括肺腺癌、肺鳞癌和大细胞癌[2]。据美国癌症学会统计,肺癌死亡患者中约40%为肺腺癌[3]。目前,肺腺癌的发病机制尚未明确。6型胶原蛋白α5(COL6A5)含有336个氨基酸组成的三重螺旋结构,侧翼则包括7个N末端von Willebrand因子A样结构域和3个C末端von Willebrand因子A样结构域[4]。有研究报道,COL6A5的3个单核苷酸多态性(SNP)位点rs13062453、rs1497305和rs77123808与肺癌风险显著相关[5],但目前关于COL6A5在肺腺癌中作用的研究尚少见。本研究拟从数据库、组织标本和细胞层面分析COL6A5在肺腺癌中的表达模式,探讨其在肺腺癌发生发展过程中的作用。
1 材料与方法
1.1材料 正常肺上皮细胞BEAS-2B和肺腺癌细胞(A549、H1975、H1650、PC9和H1299)均购自中科院上海细胞所。胎牛血清和1640培养基均购自Gibco公司。Lipofectamine 3000转染试剂、逆转录试剂盒、PowerUp™SYBR™Green预混液和COL6A5抗体均购自Fermentas公司。RNA extraction kit购自广州飞扬生物有限公司。锌指转录因子(ZEB1)、E-钙黏蛋白(E-cadherin)、锌指转录因子家族蛋白(Snail)、Twist相关蛋白1(Twist1)、AlkB家族同源蛋白5(ALKBH5)和β-肌动蛋白(β-actin)抗体均购自Cell Signaling Technology。Magna RIP™RNA-Binding Protein Immunoprecipitation Kit购自Millipore公司。ALKBH5 shRNA质粒和COL6A5过表达质粒均购自广州复能生物有限公司。CO2培养箱购自美国ThermoFisher有限公司,荧光定量PCR仪、蛋白电泳仪及湿转系统均购自美国BioRad公司,倒置相差显微镜购自美国Leica公司。
1.2标本收集 收集2013年3月—2018年12月于广州医科大学附属第六医院胸外科就诊的肺腺癌患者27例,其中男16例,女11例,年龄27~91岁,平均(47.90±3.02)岁。所有患者均经病理学确诊为肺腺癌,收集患者肺癌组织及配对的癌旁正常组织,于-196℃液氮中保存备用。本研究经我院伦理委员会批准,并与患者签署知情同意书。
1.3转染 将H1299细胞用含10%胎牛血清的1640培养基于37℃5%CO2培养箱中培养。待其融合度为80%时,将该细胞以4×104个/孔接种至6孔板,置于37℃5%CO2的培养箱中过夜,次日进行脂质体转染。利用Lipofectamine 3000转染试剂进行脂质体转染。组分1配制:3µg质粒(COL6A5过表达质粒、靶向ALKBH5的各个shRNAs以及各对照质粒)和5µL p3000与500µL无血清培养基混合均匀;组分2配制:5µL Lipofectamine 3000加入500µL无血清培养基混合均匀。将组分1和组分2混合,室温静置30 min,将上述混合液加入6孔板中,48 h后用于后续研究。在转染时,将过表达COL6A5分为con组(转染对照质粒con)和过表达组(转染COL6A5)。敲低ALKBH5分为4组:con组(转染对照质粒con)、sh-1#组(转染靶向ALKBH5的shRNA片段1质粒)、sh-2#组(转染靶向ALKBH5的shRNA片段2质粒)和sh-3#组(转染靶向ALKBH5的shRNA片段3质粒)。
1.4实时荧光定量PCR(qPCR)检测mRNA表达 按照RNA提取和cDNA合成试剂盒的说明书操作,分别提取目标细胞(H1299、H1975、A549、BEAS-2B、H1650和PC9)和目标组织(肺腺癌组织及配对癌旁组织)RNA并逆转录成cDNA。SYBR法用于检测mRNA表达,各基因引物序列见表1。PCR反应体系:SYBR Mix 10µL,上、下游引物各0.5µL,模板1µL,双蒸水8µL。反应条件:25℃2 min,95℃预变性2 min;95℃变性30 s,60℃退火延伸30 s,共40个循环。采用2-ΔΔCt法计算mRNA相对表达量,实验重复3次。

Tab.1 Primer lists in this study表1 qPCR引物序列
1.5Western blot法检测蛋白的表达量 将目标细胞H1299、H1975、A549、BEAS-2B、H1650和PC9以7×104个/孔接种于6孔板,于37℃5%CO2培养箱中培养过夜。次日,弃去培养基,预冷的磷酸盐缓冲液(PBS)洗涤细胞1次,每孔加入60µL含有cocktail蛋白酶抑制剂的RIPA裂解液,冰浴10 min。将细胞收集至离心管中,14 000×g高速离心10 min,取上清液即为细胞总蛋白,BCA法测定蛋白浓度。蛋白样品上样量20µg,蛋白样品经10%SDS-PAGE电泳(100 V恒压)分离后,200 mA恒流1.5 h转至PVDF膜上。PVDF膜经5%BSA室温封闭2 h,加入一抗(COL6A5抗体1∶800;E-cadherin抗体1∶1 000;ZEB1抗体1∶1 000;Snail1抗体1∶600;Twist1抗体1∶1 000;ALKBH5抗体1∶500;β-actin抗体1∶5 000)孵育过夜。TBST洗涤3次,每次5 min。分别加入羊抗兔二抗或者羊抗鼠二抗(1∶10 000)室温孵育2 h,TBST洗涤3次,每次5 min。ECL底物发光试剂盒增强发光,X线胶片显影。蛋白条带用Image J进行灰度分析。实验重复3次。
1.6Transwell小室法检测细胞的侵袭能力 将1×105个细胞用1%胎牛血清的1640培养基重悬,加入Transwell上室,下室中加入600µL完全培养基;培养24 h后,将小室置于甲醇中固定20 min,弃去小室里面的培养基,用棉签轻轻擦掉小室里面的细胞及基质胶,将小室置于1%结晶紫中染色10 min,流动水冲掉结晶紫,风干;在显微镜下随机读取5个视野,拍照并计数侵袭过小室的细胞。侵袭能力抑制率=(对照组侵袭细胞数-实验组侵袭细胞数)/对照组侵袭细胞数×100%,实验重复3次。
1.7RNA甲基化免疫沉淀-实时荧光定量PCR(MeRIPqPCR)实验检测转录本上是否存在m6A位点 按照Magna RIP™RNA-Binding Protein Immunoprecipitation Kit说明书进行MeRIP-qPCR实验。将1×106个H1299细胞接种至直径10 cm细胞培养皿中,用700µL RIP裂解液冰上裂解细胞10 min,14 000×g离心10 min,取上清液作为细胞裂解物,用wash buffer重悬磁珠,分为IgG组(加入Normal Rabbit IgG抗体)和m6A组(加入anti-m6A抗体),室温孵育1 h。将上述磁珠/抗体混合物与细胞裂解液4℃孵育过夜,wash buffer洗涤3次,蛋白酶K处理上述磁珠沉淀,纯化RNA并逆转录成cDNA,按照1.4中的方法检测COL6A5mRNA的表达。
1.8生物信息学预测
1.8.1Oncomine Oncomine(https://www.oncomine.org/resource/login.html)查询条件为:“Gene:COL6A5”,“Analysis Type:Cancervs.Normal”,“Cancer Type:Lung Cancer”,“Data Type:mRNA”。探究COL6A5在肺癌中的表达情况。
1.8.2GEPIA GEPIA(http://gepia.cancer-pku.cn/)查询条件为:选 择“Boxplots”,“gene:COL6A5”,“Datasets Selection:LUAD,点击add”,点击“Plot”,即可查询COL6A5与肺腺癌患者预后的关系。
1.8.3cBioPortal for Cancer Genomics cBioPortal for Cancer Genomics数据库(https://www.cbioportal.org/)用于查询与COL6A5表达相关的基因。打开数据库,“Select Studies for visualization&Analysis:Lung,LUNG ADENOCARCINOMA”,选择“lung adenocarcinoma(TCGA,PanCancer Altas)”,点击“Query by Gene:mRNA expression;Entre Genes:COL6A5”,点击“submit Query”,点击“Co-expression”,即可查看与COL6A5表达相关的基因。
1.8.4SRAMP 进入SRAMP网站(http://www.cuilab.cn/sramp),点击“Prediction”,输入COL6A5 mRNA序列,点击“submit”,即可查询COL6A5转录本上潜在的m6A位点。
1.9统计学方法 采用SPSS 19.0软件进行数据处理。计量资料以±s表示,2组间比较采用独立样本t检验,多组间比较采用方差分析;相关分析采用Pearson相关。计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 COL6A5在肺腺癌中的表达模式 在线数据库Oncomine分析结果显示,与正常组织相比,COL6A5在肺癌组织中显著低表达,见图1。GEPIA数据库分析结果显示,肺腺癌组织中COL6A5mRNA表达水平(n=483,0.77±0.09)显著低于正常组织(n=347,2.61±0.22),差异有统计学意义(t=4.710,P<0.05)。本研究qPCR结果亦显示,肺腺癌组织中COL6A5mRNA表达水平低于癌旁正常组织(0.97±0.01vs.1.66±0.04,n=27,t=2.220,P<0.05)。COL6A5mRNA在正常肺上皮细胞BEAS-2B及肺腺癌细胞A549、H1299、H1975、H1650和PC9中的表达量分别为1.00±0.00、0.14±0.01、0.11±0.00、0.11±0.01、0.13±0.02和0.28±0.06,COL6A5mRNA在A549、H1299、H1975、H1650和PC9中的表达量显著低于BEAS-2B(n=3,F=192.197,P<0.01)。

Fig.1 The online databank Oncomine used to measure COL6A5 expression pattern in several kinds of cancers图1 在线数据库Oncomine分析COL6A5在多种肿瘤中的表达模式分布图

Fig.2 The correlation between COL6A5 and prognosis of LUAD patients analyzed by TCGA databank图2 TCGA数据库分析COL6A5与肺腺癌患者预后的关系
2.2 COL6A5在肺腺癌中的表达 TCGA数据库显示,237例肺腺癌患者随访0.92~604.00个月,中位随访时间为55.83个月。以COL6A5中位表达量为界,将肺腺癌患者分为高表达组119例(≥333.578)和低表达组118例(<333.578),高表达组肺腺癌患者累积总生存率高于低表达组(Log-rankP=0.013),见图2。
2.3 ALKBH5下调COL6A5的表达 在线软件SRAMP预测结果显示,COL6A5转录本上存在多个m6A位点(图3A)。本研究MeRIP-qPCR实验结果显示,m6A组H1299细胞COL6A5mRNA的相对表达量显著高于IgG组(39.03±8.63vs.1.00±0.00,t=7.625,P<0.01)。qPCR结果显示,肺腺癌组织中ALKBH5mRNA表达水平高于癌旁正常组织(3.99±1.33vs.1.66±0.29,t=3.459,P<0.01);肺腺癌组织中ALKBH5mRNA与COL6A5mRNA表达呈负相关(r=-0.599,P<0.01)。在H1299细胞中敲低ALKBH5,qPCR结果显示,con组、sh-1#组、sh-2#组和sh-3#组ALKBH5mRNA表达水平分别为1.00±0.00、0.93±0.06、0.22±0.01和0.82±0.07,sh-2#组ALKBH5mRNA表达水平最低(F=152.400,P<0.01);Western blot结果显示,con组、sh-1#组、sh-2#组和sh-3#组ALKBH5蛋白条带灰度值分别为0.334±0.030、0.862±0.005、0.092±0.003和0.434±0.017,sh-2#组对ALKBH5的沉默率达72.46%(图3B)。在H1299细胞中敲低ALKBH5,qPCR结果显示,sh-2#组COL6A5mRNA表达水平明显高于con组(10.43±2.06vs.1.00±0.00,t=7.940,P<0.01);Western blot结果显示,sh-2#组COL6A5蛋白表达水平高于con组(3.592±0.197vs.0.169±0.001,t=30.100,P<0.01),见图3C。
2.4 COL6A5抑制肺腺癌细胞增殖 通过cBioPortal在线数据库下载与COL6A5共表达的基因,KEGG分析发现COL6A5可能参与上皮间质转换(epithelial-mesenchymal transition,EMT)、止 血(hemostasis)和细胞表面相互作用(cell surface interaction)等生命活动,见图4A。在H1299细胞中过表达COL6A5,Transwell结果显示,COL6A5过表达组发生侵袭转移的细胞数目少于con组(275±24vs.581±37,t=9.629,P<0.01),见图4B。COL6A5过表达组E-cadherin mRNA和蛋白表达水平升高,ZEB1、Snail1和Twist1 mRNA和蛋白表达水平降低,见图4C、表2。
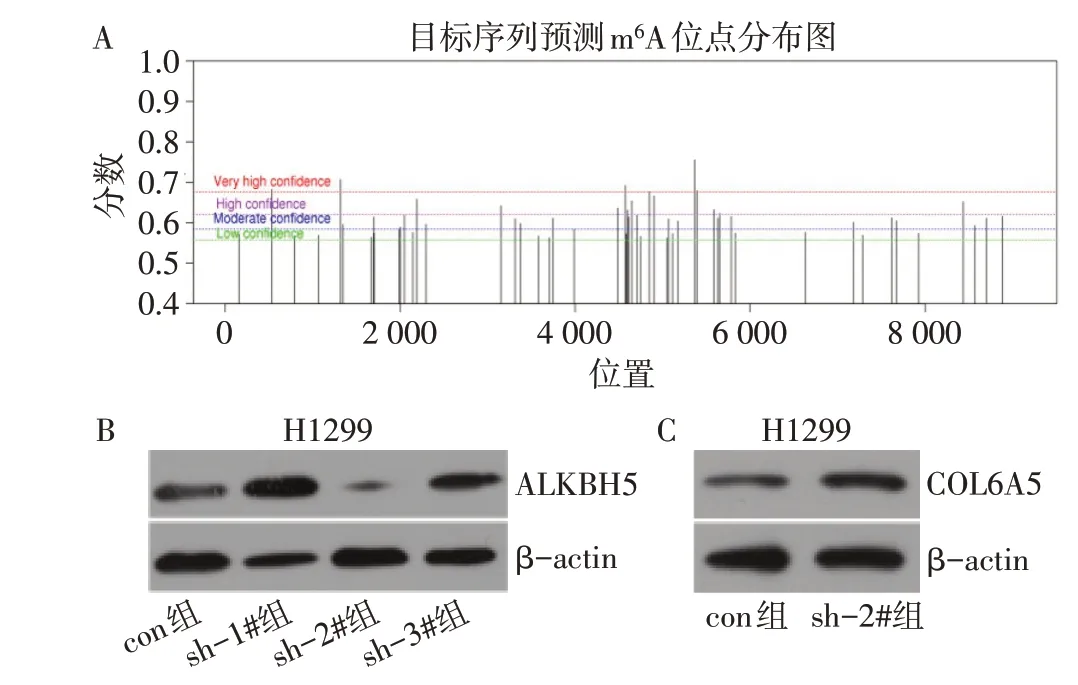
Fig.3 The effect of ALKBH5 on COL6A5 analyzed by bioinformatics combined with experiments图3 生物信息学分析结合实验验证ALKBH5对COL6A5的调控作用
3 讨论
挖掘数据库信息对探索肺腺癌发生发展分子机制的研究具有重要作用[6-8]。有研究通过GEO和TCGA数据库确定了分泌型磷酸化蛋白1(SPP1)在肺腺癌中高表达,且其表达量与肺腺癌患者预后差呈正相关(P=0.017)[9]。在TCGA数据库中发现8个B7家族配体和CD28家族受体(B7-CD28家族基因)与肺腺癌患者预后有关[10]。从TCGA数据库中分析到聚合酶ε(POLE)突变能够提高肺腺癌患者的总体生存率[11]。但是,与程序性细胞死亡配体1(PD-L1)低表达的POLE突变患者相比,PD-L1高表达的POLE突变肺腺癌患者总体生存率较高[11]。有研究者从在线数据库The Human Protein Altas中提取了基因数据集,通过一系列生物信息学分析发现,有丝分裂纺锤体相关标志物驱动蛋白成员15(KIF15)、有丝分裂检查点丝氨酸/苏氨酸激酶(BUB1)、细胞周期蛋白B2(CCNB2)、细胞周期依赖性激酶1(CDK1)、驱动蛋白成员4A(KIF4A)、Discs大同源物关联蛋白5(DLGAP5)、上皮细胞转化序列2癌基因(ECT2)和苯胺素(ANLN)可以作为预测肺腺癌患者预后的独立指标[12]。研究人员从在线数据库Oncomine以及后期实验验证发现,序列相似性为83%的家族成员A(FAM83A)在肺腺癌中显著高表达,且FAM83A高表达与肺腺癌淋巴结转移、临床分期及患者预后有关[13]。本研究通过Oncomine和GEPIA数据库分析发现,COL6A5基因在肺腺癌中低表达;经qPCR验证,COL6A5在肺腺癌组织及细胞中的表达量均远低于癌旁正常组织及正常肺上皮细胞。

Fig.4 Focusing the effect of COL6A5 on the invasion ability of LUAD cells图4 COL6A5对肺腺癌细胞侵袭能力的影响
Tab.2 Comparison of the expression of EMT biomarkers between the two groups表2 COL6A5过表达组与对照组EMT标志物的表达比较 (±s)
Tab.2 Comparison of the expression of EMT biomarkers between the two groups表2 COL6A5过表达组与对照组EMT标志物的表达比较 (±s)
*P<0.05
组别对照组COL6A5过表达组t n 3 3 E-cadherin mRNA 1.00±0.00 7.39±1.63 7.423*蛋白0.132±0.001 1.923±0.218 19.310*ZEB1 mRNA 1.00±0.00 0.18±0.09 16.820*蛋白1.097±0.014 0.634±0.005 53.080*Snail1 mRNA 1.00±0.00 0.20±0.12 12.710*蛋白0.314±0.008 0.016±0.002 6.190*Twist1 mRNA 1.00±0.00 0.39±0.03 39.950*蛋白1.532±0.182 0.849±0.127 49.890*
目前,关于COL6A5在肿瘤中的研究较少,且主要集中在突变功能上。有研究报道,在遗传性大肠癌中COL6A5可发生突变,但是否与大肠癌发生有关及其如何在大肠癌中发挥功能尚未明确[14]。有研究者统计TCGA数据后发现,COL6A5在食管鳞状细胞癌中低表达,且COL6A5低表达与患者预后不良有关[15];也有学者统计了GSE84846数据集,发现COL6A5与口腔鳞状细胞癌患者预后有关[16];但是上述2个研究仅从不同数据库分析信息,未行实验验证。本研究通过生物信息学预测到COL6A5可能参与调控肺腺癌细胞的EMT表型、止血和细胞表面相互作用等生命活动,并通过Transwell实验证实COL6A5能够抑制H1299细胞发生侵袭;qPCR和Western blot结果发现,过表达COL6A5可明显抑制EMT标志物,增加上皮标志物E-cadherin的表达,提示COL6A5通过调控H1299细胞的EMT表型来抑制其侵袭能力。
近年来,广泛存在于真核细胞的RNA甲基化(m6A修饰)调控备受关注。m6A修饰能够影响mRNA的稳定性,进而调节基因的表达,最终参与细胞分化、细胞稳态、细胞对应激的反应等生命活动。在这种修饰系统中,m6A编码器由核心催化成分甲基 转 移 酶 样3(METTL3)/甲 基 转 移 酶 样14(METTL14)组成,以插入m6A修饰[17]。ALKBH5和脂肪与肥胖相关蛋白(FTO)被称为m6A销码器,可去除基因转录本上的m6A修饰[18]。m6A位点由m6A读码器(含YTH结构域的蛋白质和IGF2BPs)执行[19]。本研究通过生物信息学及实验证实,COL6A5转录本上存在m6A修饰位点,且ALKBH5调控COL6A5表达,但是该系统中的读码器尚未明确,这将是本课题组下一步研究的内容。另外,COL6A5如何调控细胞EMT相关标志物,进而影响细胞侵袭转移能力,尚有待进一步研究。在后续研究中,本课题组将通过免疫共沉淀联合蛋白质谱实验寻找COL6A5的作用靶标,以揭示其抑制肺癌细胞侵袭转移的具体分子机制。
——一道江苏高考题的奥秘解读和拓展

