犬弓首蛔虫感染比格犬不同阶段肝circRNAs表达模式的分析
邹 扬,郑文斌,张金鹏,路义鑫*,朱兴全2,*
(1.东北农业大学动物医学学院,黑龙江省动物源性人兽共患病重点实验室,哈尔滨 150030;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046;3.山西农业大学动物医学学院,太谷 030801)
犬弓首蛔虫是一种呈全球性分布的被严重忽视的人兽共患寄生线虫,可引起包括人类在内的多种动物的弓首蛔虫病,尤其是在热带和亚热带地区较低社会经济阶层的人群中[1]。据统计在2011—2015年我国东北和华北地区人感染弓首蛔虫病的血清学阳性率为12.25%(351/2 866)~19.3%(281/1 458)[2-4]。寄生于终末宿主(犬科动物)肠道内的犬弓首蛔虫成虫,可通过粪便将受精虫卵排出体外,在适宜的土壤环境中,这些受精虫卵可发育为感染性虫卵,并存活数月至数年。当被包括人类在内的转续宿主误食后,犬弓首蛔虫幼虫虽不会发育为成虫,但幼虫会在宿主的多种组织器官中移行,造成严重的病理损伤[1]。如内脏幼虫移行症(visceral larva migrans,VLM)、眼睛幼虫移行症(ocular larva migrans,OLM)和神经型弓首蛔虫病(neurotoxocariasis,NT)等[1,5-6]。截至目前,弓首蛔虫病的确诊比较困难[7],且对其预防、治疗和监测的关注也十分有限,因此往往确诊感染时,已经出现了严重的不可逆的病理特征[8-9]。虽然用显微镜检测病原是鉴定犬弓首蛔虫病的金标准,但在实际操作上却很难实现。而ELISA检测虽然是当前推荐的一种可行的方法,但是它的敏感性只接近80%[10],因此开发一种更为精准的检测手段是十分必要的。通过对寄生虫与宿主相互作用关键分子的鉴定,可以为开发寄生虫病新的诊断方法提供潜在的生物标志物。
作者前期研究发现,许多长链非编码RNAs(lncRNAs)和编码RNAs(mRNAs)以及小RNAs(miRNAs)在犬弓首蛔虫感染宿主的过程中发挥着重要的作用[11-12]。环状RNA(circular RNA,circRNA)广泛地存在于真核转录组中,且具有细胞和组织特异性,能通过吸附miRNAs而成为竞争性内源RNA[13-14],并通过与RNA结合蛋白结合而参与生物体多种生理和病理学进程。此外,由于分子量低的特性,环状RNA能通过外泌体、纳米微粒等胞外囊泡进行转运,被选作结核病等多种疾病的诊断靶标和治疗靶点。然而,在犬弓首蛔虫感染宿主过程中,circRNAs的调控及其在宿主肝中的发病机制中所起的作用仍然未知。因此本研究通过对犬弓首蛔虫感染比格犬肝的circRNAs进行RNA测序,揭示宿主肝circRNAs在犬弓首蛔虫感染过程中发挥的作用,为进一步探究犬弓首蛔虫与宿主之间的相互作用奠定基础。
1 材料与方法
1.1 感染虫卵的制备
从雌性成虫的子宫内分离出犬弓首蛔虫受精虫卵,将收集到的受精虫卵放置于含有高压灭菌的滤纸和脱脂棉的培养皿中,置于0.5%的甲醛溶液中,28 ℃恒温孵育28 d后,收集感染性虫卵。用200目筛网除去杂质,并将虫卵浸泡在1%的甲醛溶液中,置于4 ℃冰箱保存[15]。
1.2 比格犬感染模型的建立
从国家犬类实验动物资源库购买18只6~7周龄的未进行任何疫苗免疫的比格犬,所挑选的比格犬通过粪检以确保无任何蠕虫虫卵,且采用间接ELISA法[16]检测犬弓首蛔虫抗体以确保所有的幼犬均无犬弓首蛔虫感染,并饲养于广州医药研究总院有限公司的大动物GLP实验室中。这些幼犬被平均分成3组:感染后0.5 d组、感染后1 d组和感染后36 d组,每组包括试验和对照各3只幼犬。试验组的幼犬灌服300个感染性的虫卵,来模拟自然感染,而对照组的幼犬灌服相同剂量的生理盐水。感染后0.5、1及36 d,用EDTA-K2分别采集幼犬血液来检查幼犬的嗜酸性粒细胞。使用Zoletil 50(Virbac,法国)将幼犬进行全身麻醉,用KCl溶液注射入心脏内进行人道猝死。然后采集幼犬肝并用生理盐水冲洗掉表面的血液,取10 g的肝组织剪碎,置于-80 ℃液氮中保存,用于提取组织总RNA。
1.3 比格犬肝组织总RNA的提取
用液氮将-80 ℃冷冻保存的18个幼犬肝组织研磨成粉末,用TRIzol(Life Technologies,美国)提取组织总RNA,然后用DNase I(NEB,美国)除去肝组织总RNA中的基因组DNA。采用1%的琼脂糖凝胶法来检测肝组织RNA的降解情况。使用NanoPhotometer®分光光度计(IMPLEN,CA,USA)检测RNA纯度。对于初筛合格的肝组织RNA样品,分别使用Qubit®2.0 Flurometer(Life Technologies,美国)和Agilent生物分析仪2100系统(Agilent Technologies,美国)评估肝组织总RNA的浓度和完整性。之后,对RNA完整性(RNA integrity number,RIN)≥8的样品进行后续分析[17]。
1.4 circRNA文库的构建及鉴定
吸取5 μg每个肝样品的总RNA用于构建RNA测序文库。使用Epicentre RibozeroTMrRNA Removal试剂盒(Epicentre,USA)去除核糖体RNA,用乙醇沉淀法清除rRNA残留。然后用RNase R进行线性RNA酶切(Epicentre,美国)。选择150~200 bp的cDNA片段,用AMPure XP系统(Beckman Coulter,Beverly,USA)进行纯化。然后用3 μL USER Enzyme(NEB,美国)进行片段大小的筛选,与选择尺寸的接头连接的cDNA在37 ℃ 下连接15 min,然后在95 ℃下连接5 min,用高保真DNA聚合酶、通用PCR引物和指数(X)引物进行PCR扩增。最后对产物进行纯化(AMPure XP系统),并在安瑞伦生物分析仪2100系统上进行文库质量评估。测序文库由针对Illumina®(NEB,美国)的NEBNext®UltraTM定向RNA文库准备试剂盒并按照制造商的说明构建,并利用HiSeq 4000测序平台构建18个肝样品的circRNA测序文库,生成150 bp的配对端序列[18]。高通量测序(illumina HiSeq 4000)测序得到的原始图像数据文件经碱基识别(base calling)分析转化为测序序列(raw reads),结果以FASTQ(简称为fq)文件格式存储。所获序列去除带有接头、ploy-N和低质量的reads (来自原始reads),以获得有效reads (clean reads)。然后从Ensembl数据库中下载Canislupusfamiliaris基因组和注释文件(CanFam3.1)。使用bowtie2 v2.2.8[19]建立参照基因组指数,并使用Bowtie将配对末端clean reads与参照基因组对齐。映射到的reads被删除,未映射的reads包括拼接连接对齐的reads,由find_circ[20]和CIRI2[21]软件进一步处理。最后,识别出含有剪接位点对齐reads的circRNAs。选择两种算法的交集进行circRNAs的预测。
1.5 circRNAs的定量、差异分析及差异circRNAs序列亲缘关系进化分析
通过每百万条reads的转录本(transcripts per million reads,TPM)[22]的表达水平来评估circRNAs相对表达量。试验组和对照组的肝circRNAs的差异表达量采用DESeq2软件进行分析,默认以Pvalue值0.05为差异表达阈值。对差异的circRNAs序列进行亲缘关系的进化树比较,在Tamura-Nei模型的基础上,利用极大似然法(maximum likelihood)对其演化历史进行了推断[23]。利用双参数遗传距离模型在MEGA7软件上构建系统发育树[24]。使用引导分析(1 000次重复)对系统发育树的稳健性进行评估,以评价差异circRNAs亲缘关系[25]。
1.6 实时荧光定量PCR (qRT-PCR)验证分析
为了验证RNA-seq结果的准确性,随机挑选9个差异性表达的circRNAs与1个管家基因进行荧光定量PCR(qRT-PCR)的验证。利用Hiscript II Q RT SuperMix cDNA试剂盒(Vazyme,中国南京)合成了circRNA的第一链cDNA。采用ChamQ SYBR qPCR Master Mix qRT-PCR试剂盒(Vazyme,中国南京)进行qRT-PCR。反应条件包括95 ℃预变性30 s,95 ℃预变性10 s,60 ℃预变性30 s,40个循环,所有反应都进行了3次重复。此外进行解离曲线分析,以保证每个反应的特异性扩增。反应条件为95 ℃10 s,65 ℃1 min,从65 ℃逐步升高到95 ℃。使用内参基因GTI[26]对所有的circRNA表达量进行归一化处理,用2-ΔΔCt方法[27]计算每个样品中特定circRNAs的相对表达量。所有基因和引物见表1。
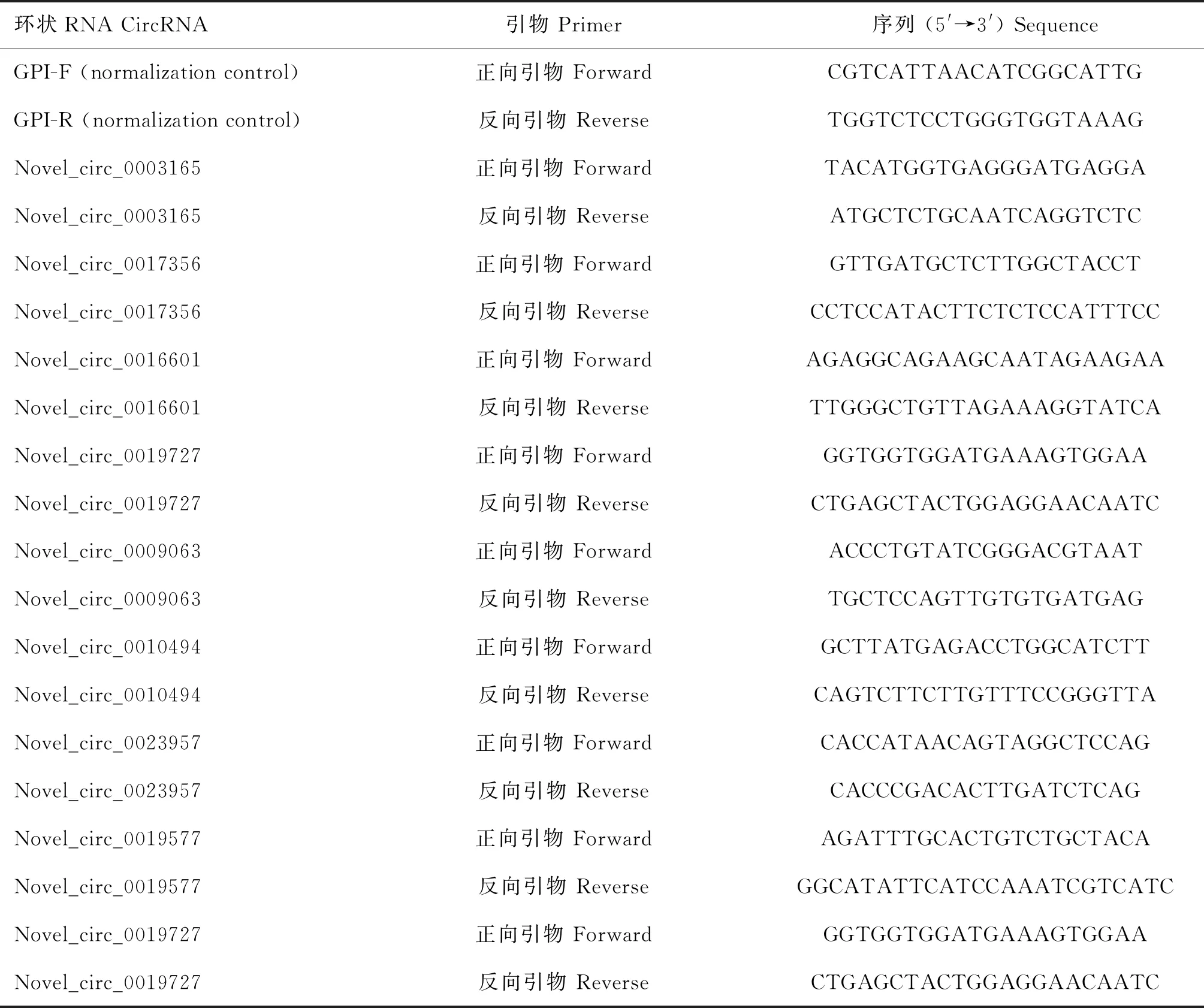
表1 用于环状RNA的实时荧光定量PCR分析的引物Table 1 Primers used in circRNA specific quantitative real-time PCR (qRT-PCR)analysis
1.7 统计分析
使用 GraphPad Prism 8对qRT-PCR中基因表达的circRNAs差异结果进行分析,并用平均值±标准误差(SEM)表示。
1.8 circRNA亲本基因的功能分析
根据circRNAs与其来源基因(source gene)间的对应关系,对每组差异表达的circRNAs的来源基因进行功能预测,使用R包中的GOseq进行基因本体论(gene ontology,GO)的注释分析[28],并分析这些差异表达的circRNAs在犬弓首蛔虫感染幼犬中的生物学功能,包括3个分类:生物进程(biological process,BP)、细胞成分(cellular component,CC)和分子功能(molecular function,MF),Pvalue 小于0.05被认为是显著注释。通过 KEGG(kyoto encyclopedia of genes and genomes)Pathway显著性富集确定circRNAs的来源基因参与的最主要生化代谢途径和信号转导途径[29]。
1.9 伦理道德
本研究经中国农业科学院兰州兽医研究所动物伦理委员会批准(编号:2018-015)。试验用比格犬按照国家和地方有关实验动物福利伦理规定的要求进行操作。
2 结 果
2.1 比格犬感染犬弓首蛔虫后血清中嗜酸性粒细胞的变化
在感染后0.5 d,试验组中的犬血清嗜酸性粒细胞的数量与对照组的犬相比显著增加(P<0.05)(图1)。

*.P<0.05图1 感染组与对照组比格犬血清中的嗜酸性粒细胞的量Fig.1 Eosinophils level in serum of infected and control Beagle dogs
2.2 幼犬肝RNA数据及环状RNA的差异表达
在本研究中从18只幼犬的肝样本(3个感染阶段:0.5、1、和36 d)中获得了2 119 950 482个raw reads、2 068 104 062个clean reads和310.22 Gb clean reads。Clean reads中GC和Q30的平均值分别为52.47% 和93.73%。在感染后0.5 d,试验组与对照组相比,共有94个差异的circRNAs,其中包括55个上调的circRNAs,39个下调的circRNAs(图2A);在感染后1 d,共鉴定到103个差异的circRNAs,其中包括61个上调的circRNAs,42个下调的circRNAs(图2B);在感染后36 d,共鉴定到84个差异的circRNAs,其中包括47个上调的circRNAs,37个下调的circRNAs(图2C)。但是在3个感染阶段,没有发现共同的差异circRNAs(图3)。此外在3个感染阶段随机筛选出10个差异的circRNAs构建系统进化树,来评估各阶段犬肝的差异circRNAs亲缘关系(图4)。

图2 差异表达环状RNA的火山图Fig.2 Volcano plot of the differentially expressed (DE)circRNAs

图3 差异表达环状RNA的维恩图Fig.3 Venn diagram of the differentially expressed (DE)circRNAs

进化树系按比例绘制,用每个位点的替换次数来衡量分支长度。分析涉及30个核苷酸序列。密码子定位为1+、2+、3+及非编码。消除所有包含间隙和缺失数据的定位。最终的数据集中共有111个定位The tree is drawn to scale,with branch lengths measured in the number of substitutions per site.The analysis involved 30 nucleotide sequences.Codon positions included were 1 st+2nd+3rd+Noncoding.All positions containing gaps and missing data were eliminated.There were a total of 111 positions in the final dataset图4 3个感染阶段部分差异表达环状RNA的系统进化树Fig.4 Phylogenetic tree of partial differential expression of circRNAs at three stages of infection
2.3 实时荧光定量PCR验证
随机挑选了9个差异的circRNAs进行表达趋势验证,如图5。其中转录组测序结果为4个上调和3个下调的circRNAs,与qRT-PCR检测表达趋势一致,进一步验证了转录组测序结果的可靠性。

y轴表示环状RNA与管家基因GTI表达水平的相对变化,x轴显示用于表达分析交叉验证的9个环状RNAs的名称The y-axis shows the relative change of circRNA levels expressed compared with the control GTI gene.The x-axis shows the name of the nine circRNAs used in the cross-validation of expression analysis图5 差异表达环状RNA的实时荧光定量PCR验证Fig.5 qRT-PCR validation of the differentially expressed (DE)circRNAs
2.4 差异性表达的环状RNAs的GO注释和KEGG富集分析
通过GO注释分析发现,在犬弓首蛔虫感染后0.5 d,共有415个GO条目中被显著富集(P<0.05)。差异的circRNAs主要与“化合物代谢生物过程”“细胞器组成相关”(见OSID开放科学数据与内容附图1A);在感染后1 d,共涉及768显著富集的条目。差异的circRNAs主要与“调节中性粒细胞介导生物过程”“连接酶的活动分子功能”相关(见OSID开放科学数据与内容附图1B);在感染后36 d,有344个GO条目被显著富集。差异的circRNAs主要与“胞内部分细胞组成”相关(见OSID开放科学数据与内容附图1C)。另外,作者筛选出一些与免疫或炎症相关的GO条目(P<0.05),而这些条目大部分富集在感染后1 d(图6)。并主要与“固有免疫”“中性粒细胞介导”和“细胞因子的产生”进程相关(图6)。在犬弓首蛔虫感染后0.5 d,novel_circ_0016108、novel_circ_0016184和novel_circ_0027468参与固有免疫进程;在感染后1 d,novel_circ_0002212与中性粒细胞介导作用过程相关;在感染后36 d,novel_circ_0002091、novel_circ_0014164、novel_circ_0019985、novel_circ_0023071和novel_circ_0023218主要参与细胞因子的产生进程。
KEGG富集分析表明,在感染后0.5 d,2条KEGG信号通路被显著富集,如“促性腺激素释放激素信号通路”“丙型肝炎通路”(图7A)。其中novel_circ_0025586、novel_circ_0016800和novel_circ_0024378与“丙型肝炎通路”相关;在感染后1 d,有4条通路被显著富集(P<0.05),如“丙酮酸代谢”“精氨酸和脯氨酸代谢”“核糖体在真核细胞中生物合成作用”和“脂肪酸的生物合成”通路(图7B)。其中novel_circ_0002212和novel_circ_0019907涉及“精氨酸和脯氨酸代谢”通路;在犬弓首蛔虫感染后36 d,有6条通路被显著富集,如“泛醌及其他萜醌类生物合成”“军团杆菌病”“血小板激活”“泛素介导的蛋白水解作用”“抗坏血酸和醛酸代谢”和“类固醇生物合成”通路(图7C)。其中novel_circ_0019985和novel_circ_0001521与军团杆菌病通路相关。

A、B和C.代表靶基因在感染后0.5、1和36 d显著富集的与免疫或炎症相关的基因本体(GO)术语。y轴左侧代表靶基因个数,右侧代表P value值。x轴表示基因本体(GO)术语A,B and C.Represent the significantly enriched immunity-or inflammation-related differential GO terms at 0.5 dpi,1 dpi and 36 dpi.The left y-axis shows the numbers of target genes,and the right y-axis shows the P value.The x-axis shows the Gene Ontology (GO)terms of the source gene图6 与免疫或炎症相关的差异环状RNA的GO条目Fig.6 The enriched immunity-or inflammation-related differential GO terms of the differentially expressed (DE)circRNAs

A、B和C.代表靶基因在感染后0.5、1和36 d的差异环状RNA亲本基因富集的信号通路。y轴左侧代表信号通路,右侧矩形代表-lg P value 值,黑色圆圈表示靶基因数目,x轴表示靶基因比率A,B and C.Represent the signaling pathways enriched by the source genes of differentially expressed (DE)circRNAs at 0.5 dpi,1 dpi and 36 dpi.The left y-axis shows the signaling pathways,and the right rectangle shows the -lg P value,and the black circle shows gene numbers.The x-axis shows the Gene Ontology (GO)terms of the source gene图7 前20个差异环状RNA亲本基因富集的信号通路Fig.7 The top 20 signaling pathways enriched by the source genes of differentially expressed (DE)circRNAs
3 讨 论
犬弓首蛔虫是一种被忽视的寄生性蠕虫,它可以导致人体弓蛔虫病,如内脏和眼睛幼虫移行症以及明显的免疫病理反应等。目前的治疗手段主要是药物,而对犬弓首蛔虫病疫苗研究仍十分有限[30]。circRNAs是一类新兴的内源性非编码RNA,因其不具有5′端帽子和3′端poly(A)尾结构,所以能够稳定地存在于各种类型的真核细胞中[31]。circRNAs能够吸附miRNAs发挥海绵(sponge)作用,从而在转录后水平调控基因表达[14]。研究表明,circRNAs在生物的生长发育、胁迫应答、疾病发生和发展等方面发挥重要作用,并显示出其在疾病诊断标记物等方面的应用潜力[31]。因此本研究对犬弓首蛔虫不同感染阶段的比格犬肝的circRNAs转录本变化进行研究,分析其差异表达的circRNA,预测其来源基因的生物功能,从而为阐明犬弓首蛔虫与终宿主之间相互作用的机制提供基础数据。
本研究中,在犬弓首蛔虫感染的过程中大部分差异的circRNAs被上调。这表明,在犬弓首蛔虫感染比格犬期间,犬肝的circRNAs受到正向调控,从而参与犬弓首蛔虫的感染过程。通过对差异的circRNAs序列亲缘关系的进化树比较,发现在犬弓首蛔虫感染的不同阶段,肝差异的circRNAs的亲缘关系不强。另外随着犬弓首蛔虫感染的不同阶段,犬肝的生物学进程也发生了改变,这说明犬弓首蛔虫感染比格犬后肝的生物学功能发生改变可能与circRNAs表达量的改变有关。据文献报道,大部分犬弓首蛔虫幼虫在终末宿主(犬)体内,在24 h移行到肝,可引起肝剧烈的免疫反应[32]。这也进一步解释了为什么大部分与炎症或免疫相关的GO条目被显著富集在感染后1 d。此外,在感染后0.5 d,与免疫或炎症相关的GO条目主要与固有免疫相关,这说明犬弓首蛔虫在感染后0.5 d时可引起宿主肝的天然免疫反应。而作者推测novel_circ_0016108、novel_circ_0016184和novel_circ_0027468可能参与了犬弓首蛔虫引起的宿主肝的天然免疫反应相关,但其作用机制仍需进一步研究。中性粒细胞是免疫防御所必需的多功能先天效应细胞,在防御的同时也会引起炎症反应。有试验证明在缺乏中性粒细胞或中性粒细胞迁移或功能受损的小鼠中,实验性诱导的关节炎没有发生[33-34]。类似的研究表明,中性粒细胞是介导多种免疫疾病如神经炎症和结肠炎中关键的效应因子[35-36],是一种重要的药物靶点。而在本研究中,在感染后1 d,大部分与免疫或炎症相关的通路是与中性粒细胞介导相关,这也说明中性粒细胞在犬弓首蛔虫感染的过程中发挥着重要作用。并且novel_circ_0002212可能参与了犬弓首蛔虫引起的肝炎症反应,并可能成为治疗该炎症的潜在药物靶点。细胞因子一般通过与相应的细胞表面受体结合发挥其免疫调节作用,包括调节细胞增殖分化、激活先天和获得性免疫应答,参与促炎和抗炎反应机制等。而本研究中,在感染后36 d,novel_circ_0002091、novel_circ_0014164、novel_circ_0019985、novel_circ_0023071和novel_circ_0023218参与细胞因子的产生过程。这说明在犬弓首蛔虫感染比格犬后期,这几种新鉴定到的环状RNA在肝的免疫反应中发挥着重要作用。
丙型肝炎可以触发多种信号通路诱导宿主先天免疫应答,并可以利用自噬抑制先天免疫反应[37]。KEGG富集分析发现在感染后0.5 d,环状RNA novel_circ_0025586、novel_circ_001680和novel_circ_0024378与“丙型肝炎通路”显著相关。这说明这三种circRNAs,可能与犬弓蛔虫感染引起宿主肝的先天免疫反应有一定的联系。在利什曼原虫感染过程中,L-精氨酸代谢可调节免疫应答和炎症反应[38-39]。精氨酸代谢在宿主防御以及生长和分化中发挥作用。精氨酸代谢可以使机体在受伤后24~72 h内诱导型一氧化氮合酶(iNOS)达到高峰,并产生瓜氨酸和一氧化氮(NO)。一氧化氮对微生物和寄生虫是有毒的,可以抵抗寄生虫的增殖[40]。因此我们猜测,在感染后1 d,大部分移行到肝处的幼虫[32]导致肝损伤,从而促使精氨酸代谢上调,释放NO来抵抗犬弓首蛔虫侵袭。但这仍需要后续试验进一步验证。然而,在本研究中,novel_circ_0002212和novel_circ_0019907与“精氨酸和脯氨酸的代谢”通路有密切联系。这说明这两种环状RNA可能在宿主肝抵抗犬弓首蛔虫侵袭的过程中发挥着重要作用。在军团杆菌病通路中,有一种半胱氨酸蛋白酶Caspase-3(Casp3),它在细胞凋亡和炎症反应中发挥作用,在Casp3敲除的小鼠中,炎症基因表达被上调,出现轻度脾肿大和肾炎症[41]。作者之前的研究发现,Caspase-3在犬弓首蛔虫感染宿主的肺后被上调了15.6倍,在犬弓首蛔虫感染的过程中发挥抗炎的作用[11]。这些研究表明,军团杆菌病通路可能与犬肝抵抗犬弓首蛔虫的感染有关。在感染后36 d,novel_circ_0019985和novel_circ_0001521参与“军团杆菌病”通路,提示这两种circRNAs可能与犬肝抵抗犬弓首蛔虫的感染的抗炎作用有关。
4 结 论
本研究结果表明,犬弓首蛔虫感染会引起比格犬肝的circRNAs表达谱的改变,这些差异的circRNAs参与宿主肝的免疫或者炎症反应。这些发现也为后续研究circRNAs在犬弓首蛔虫致病机制中的作用提供了参考。
——W 字幼犬队

