鲍曼不动杆菌UDP-葡萄糖4-差向异构酶Gne1的表征
张 展,冯 雁,李 谦,崔 莉**
(1上海交通大学生命科学技术学院微生物代谢国家重点实验室,上海200240;2中国药科大学生命科学技术学院,南京210009)
大多数构型的吡喃糖分子及其衍生物在自然界中较为稀有[1]且具有广泛的生物活性谱,如D-阿洛酮糖可用作低卡路里甜味剂,同时具有血糖抑制、活性氧清除和神经保护等活性[2],D-塔格糖具有低热量、降血糖、抗龋齿和抗肥胖等特性[3-4],L-塔格糖可用作治疗半乳糖贮积症的分子伴侣药物米格斯他的起始原料[5]。然而,化学合成稀有功能糖必须克服糖分子多手性中心的障碍,生物酶合成法为解决这个难题提供了方案,为更加便利高效精准地生产各种构型的稀有功能糖,日本香川大学教授Izumori 等[6]提出了可用来生产所有稀有糖的生物制备策略,即以廉价的单糖为原料,利用醛糖异构酶、D-塔格糖3-差向异构酶等糖异构酶生产稀有功能糖,其中帮助糖分子实现羟基构型变化而生成稀有功能糖的是糖差向异构酶(EC 5.1.3.-),根据作用于糖分子手性中心位置的不同,其可以分为C-1 差向异构酶,如醛糖1-异构酶、C-2 差向异构酶(如N-乙酰-D-葡萄糖胺2-差向异构酶)和C-3 差向异构酶(如D-塔格糖3-差向异构酶等)。
UDP-葡萄糖4-差向异构酶(EC 5.1.3.2)是作用于UDP-葡萄糖或UDP-半乳糖的C-4 差向异构酶,能够特异性改变4-羟基构型以实现两种底物相互转化。不同来源的UDP-葡萄糖4-差向异构酶对底物的杂泛性不同,据此可被分为3 类:第1 类是对UDP-葡萄糖/UDP-半乳糖具有偏好性,第3 类是对UDP-N-乙酰葡萄糖胺/UDP-N-乙酰半乳糖胺均具有偏好性,如来自大肠埃希菌O5:K4:H4 的UDP-葡萄糖4-差向异构酶显示出对乙酰化底物更高的活性[7],而第2 类是对两种底物均不具有偏好性[8]。UDP-葡萄糖4-差向异构酶具有诸多研究价值,例如,该酶参与的遗传疾病会导致严重的半乳糖血症[9-10],该酶可参与致病细菌的主要致病因子脂多糖O-抗原的生物合成,可参与链霉菌具有抗菌活性的次级代谢产物莫诺霉素的生成[11],可参与有价值的半乳糖基化产物的生物催化[12]。此外,该酶还可被用来催化生成稀有功能糖,Kim等[13]利用来自大肠埃希菌的UDP-葡萄糖4-差向异构酶催化生成塔格糖,且通过对UDP 基团附近的氨基酸进行饱和突变筛选,获得了对塔格糖催化能力提高的突变体,为稀有功能糖的合成开辟了新的方法和思路。然而这种催化能力还需进一步提高,为了达到这个目的,除了对这个酶本身进行改造,也可以通过选择与其具有一定相似性的不同来源的异构酶作为候选改造模板。
本研究对与大肠埃希菌UDP-葡萄糖4-差向异构酶进化关系较近的鲍曼不动杆菌AB0057 来源的同工酶Gne1 的酶学性质进行表征,通过序列比对、同源建模与分子对接等方法揭示了其与底物、辅因子的结合模式和催化机制,为蛋白质工程改造提高酶活力进而应用于稀有功能糖的生物合成提供理论依据。
1 材 料
1.1 菌株与质粒
UDP-葡萄糖4-差向异构酶Gne1(GenBank:ACJ39545.1)来源于鲍曼不动杆菌AB0057;异源表达宿主大肠埃希菌BL21(DE3)感受态细胞(北京全式金生物技术有限公司);UDP-葡萄糖4-差向异构酶基因与表达载体pET-28a(上海生工生物工程股份有限公司);T7 通用引物(北京擎科新业生物技术有限公司)。
1.2 主要试剂
PrimeSTAR Max Premix DNA 高保真聚合酶(日本宝日医公司);限制性核酸内切酶(美国赛默飞世尔公司);质粒DNA 小量制备试剂盒(上海捷瑞生物工程有限公司);PCR 产物纯化试剂盒(美国康宁公司);PAGE 蛋白电泳凝胶制备试剂盒(西安晶彩生物科技有限公司);Bradford 蛋白质浓度测定试剂盒(上海生工生物工程股份有限公司);蛋白质亲和色谱介质Ni NTA Bead 6FF(常州天地人和生物科技有限公司);超滤管Amicon Ultra-15(美国默克公司);尿苷-5'-二磷酸葡萄糖二钠盐(uridine 5'-diphosphoglucose disodium salt,UDPG,上海源叶生物科技有限公司);尿苷-5'-二磷酸半乳糖二钠盐(上海麦克林生化科技有限公司);其余试剂为市售分析纯。
1.3 培养基
LB 培养基:NaCl 10 g/L,酵母粉5 g/L,蛋白胨10 g/L,固体培养基须再加入2%的琼脂糖。
1.4 仪 器
Mastercycler PCR 仪(德国Eppendorf 公司);Mupid-2plus 核酸电泳仪(日本Mupid 公司);Mini-PROTEAN Tetra 蛋白电泳仪(美国Bio-Rad 公司);UH-06 高压匀质仪(永联生物公司);1260 高效液相色谱仪(美国Agilent公司)。
2 方 法
2.1 目的基因的合成及验证
UDP-葡萄糖4-差向异构酶与表达载体连接的酶切位点选择NdeI 和EcoR I,并根据大肠埃希菌常用密码子对目的基因进行优化,委托公司进行合成。合成的质粒与大肠埃希菌BL21(DE3)感受态细胞混匀后42 ℃热激90 s 转化,加入LB 培养基800 μL 于37 ℃,220 r/min恒温摇床复苏1 h。复苏后经4000 r/min 离心去上清液600 μL,剩余培养基重悬菌体后均匀涂布到含有25 μg/mL 卡那霉素的LB 固体培养基上,37 ℃倒置培养12 h 后挑取单克隆转接到含有25 μg/mL 卡那霉素LB 液体培养基5 mL 中,同时使用T7 通用引物对单克隆进行菌落PCR 验证并送金唯智公司测序。转接后的5 mL LB液体培养基37 ℃,220 r/min培养12 h后提取质粒,限制性核酸内切酶与质粒反应1 h 后使用1% 琼脂糖凝胶电泳检测酶切结果。PCR 体系和程序以及酶切体系见表1 ~表2。

Table 1 PCR contents of gne1
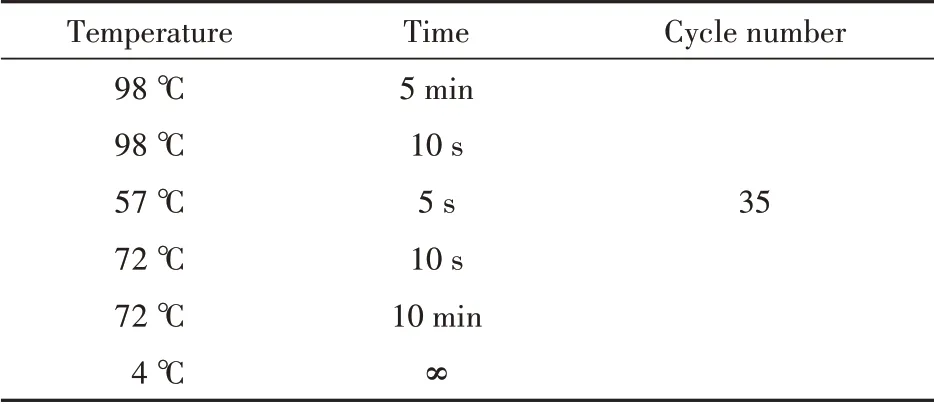
Table 2 Amplification conditions of Gne1

Table 3 Enzymatic digest of recombinant plasmid
2.2 Gne1重组酶的表达纯化
挑取测序正确的单克隆接种于含25 μg/mL 卡那霉素的LB培养基5 mL中,37 ℃、220 r/min培养过夜,将菌液(0.5%接种量)5 mL转接于含25 μg/mL卡那霉素的LB培养基1000 mL中,37 ℃,220 r/min培养至A600为0.6 ~0.8(2 ~3 h),加入IPTG 至浓度为1 mmol/L,20 ℃,诱导20 h。诱导结束后,菌液经5000 r/min 离心20 min 收集菌体,加入Tris-HCl缓冲液(50 mmol/L,pH 8.0,250 mmol/L NaCl)80 mL 重悬,使用高压细胞匀质仪破碎菌体。破碎完成后,4 ℃、10000 r/min、30 min离心2次,收集上清液过Ni 柱2 次。使用洗涤液1(30 mmol/L 咪唑、50 mmol/L Tris-HCl、250 mmol/L NaCl)和洗涤液2(50 mmol/L 咪唑、50 mmol/L Tris-HCl、250 mmol/L NaCl)各150 mL(30 倍Ni 柱体积)以洗脱杂蛋白,使用25 mL(5 倍Ni 柱体积)洗脱液(200 mmol/L 咪唑、50 mmol/L Tris-HCl、250 mmol/L NaCl)洗脱目的蛋白并收集在离心管中。纯化出的酶经10%SDS-PAGE凝胶电泳验证,并转移至截流量为10 kD的超滤管中,5000 r/min 离心20 min,弃滤液,向超滤管中加入Tris-HCl 缓冲液(50 mmol/L,pH 8.0)至最高限,5000 r/min,20 min,重复此步骤5 次,将浓缩液转移至2 mL 离心管中,加入少量甘油。使用Bradford蛋白浓度测定试剂盒测定蛋白质含量。
2.3 Gne1重组酶的活性表征
2.3.1 酶活力检 测 Tris-HCl(50 mmol/L,pH 8.0)缓冲液的100 μL 反应体系中包含5 mg/mL 纯化后的蛋白,2 mmol/L 天然底物UDP-葡萄糖,37 ℃反应1 h,反应结束后沸水浴3 min 使酶变性,12000 r/min 离心30 min,吸取上清液并使用0.22 μm滤膜过滤,滤液使用高效液相色谱仪分析,色谱柱为Agilent SB-C18(4.6 mm × 150 mm,5 μm)分析柱,流速为0.8 mL/min,乙酸三乙胺缓冲液(40 mmol/L,pH 6.0)等度洗脱,柱温25 ℃,进样量5 μL,紫外检测器设置波长为262 nm,分析时间为15 min。
2.3.2 酶活力单位定义 44 ℃,pH 6.0 条件下,每分钟转化1 μmol底物所需要的酶量,即1个酶活力单位,以U 表示。反应体系中的UDP-葡萄糖浓度按照下式计算:y= 2131.558x,R2= 0.99997,y为紫外信号峰面积(mAU×min),x为反应体系中的UDP-葡萄糖的浓度(mmol/L)。酶活力(mU/mg)计算公式为:酶活力=× 106,其中,x0为反应前体系中UDP-葡萄糖浓度(mmol/L);t为反应时间(min),60 min;m为反应体系中酶的质量(mg),0.5 mg;V为反应体积(L),1 × 10-4L。
2.3.3 最适温度探究 在pH 8.0的条件下,反应体系中UDP-葡萄糖的浓度为1 mmol/L,温度梯度选择16 ℃、23 ℃、30 ℃、37 ℃、44 ℃、51 ℃。
2.3.4 最适pH 探究 在温度为44 ℃条件下,反应体系中UDP-葡萄糖的浓度为1 mmol/L,pH 梯度选择5.0、6.0、7.0、8.0、9.0、10.0,其中pH 梯度5.0、6.0、7.0 使用50 mmol/L 磷酸氢二钠-柠檬酸缓冲液配制,pH 梯度7.0、8.0、9.0 使用50 mmol/L Tris-HCl 缓 冲 液 配 制,pH 梯 度9.0 和10.0 使 用50 mmol/L Gly-NaOH缓冲液配制。
2.3.5 动力学测定 在温度为44 ℃,pH 6.0条件下,UDP-葡萄糖的浓度梯度为0.05,0.10,0.15,0.20,0.4,0.7,1.0,2.0,3.0,5.0 mmol/L。 使用Origin 软件对不同底物浓度对应的酶促反应速率进行Michaelis-Menten方程拟合即得到动力学参数KM和kcat。
2.4 Gne1的进化、序列和结构分析
使用MEGA 7.0 软件对KEGG 数据库中选择E.C.number 为5.1.3.2、5.1.3.6 和5.1.3.7 共24条蛋白序列与GalE 序列进行比对,比对参数选择默认值,进化树构建方法选择邻接法,自展值设置为1000,进化距离由p-distance 计算。在NCBI 中使用Batch CD-search 分析该组序列的保守结构域及预测配体的结合位点。将进化关系较近的Gne1的蛋白序列在NCBI中进行Blast分析,数据库选择“PDB protein database”,选择相似度较高5 条蛋白序列与Gne1 在ClustalX2 中进行比对,参数选择默认值,比对结果使用ESPript 3.0 软件进行着色,二级结构模板使用来自大肠埃希菌的同工酶(PDB:1XEL,相似度55.2%)。
2.5 Gne1的同源建模与分子对接
使用Swiss Model 在线网站对Gne1 的蛋白质序列同源建模,使用大肠埃希菌的同工酶(PDB:1XEL,相似度55.2%)作为模板,构建好的模型上传至SAVES v6.0 在线网站进行评估。使用Pymol软件对同源建模的Gne1与含有配体的模板分子进行比对,得到含有配体分子的Gne1,使用Discovery Studio展示配体与Gne1的相互作用。
3 结 果
3.1 目的基因的合成及验证结果
T7 通用引物扩增的片段长度的理论值为1336 bp,菌落PCR 产物经琼脂糖凝胶电泳验证正确(图1,序号1-4)。提取重组质粒经NdeI和EcoR I 双酶切后,得到线性载体片段与目的基因片段(图1,序号5)。菌落PCR 产物经纯化后送公司测序,测序结果显示目的基因成功构建到载体上。
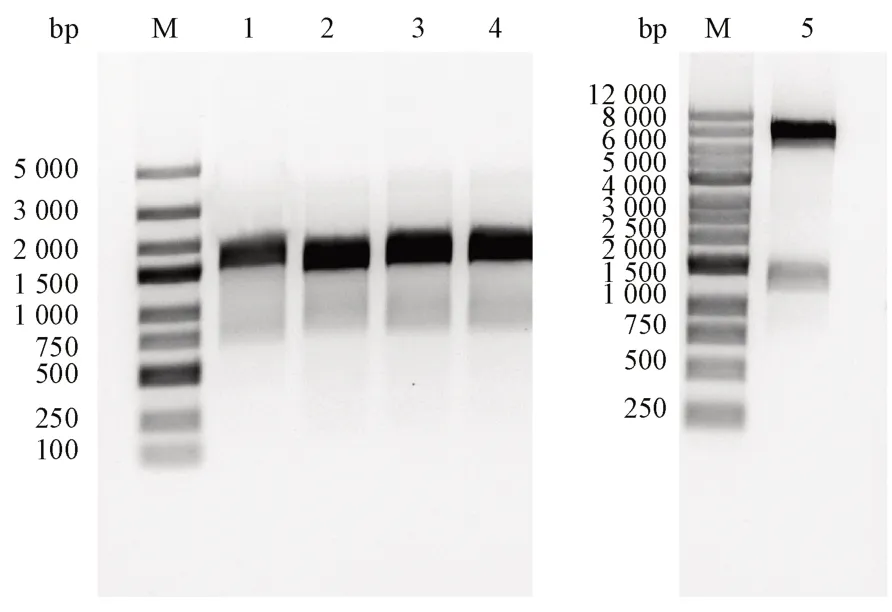
Figure 1 Colony PCR results and enzymatic digest verificationM: DNA ladder; 1-4: Coloy PCR results; 5: Recombinant plasmid digested by restriction enzymes
3.2 重组酶Gne1的表达纯化结果
重组酶在1 L 的LB 培养基中经1 mmol/L IPTG 20 ℃诱导20 h 后,离心去除培养基后得到湿菌体的质量为44.5 g。重组酶质量约为38.9 kD,10%SDS-PAGE 电泳显示(图2),纯化的目标蛋白位于蛋白质分子量标准35 kD 和45 kD 之间,与预测值相符。另外,从细胞破碎液的电泳结果中可看出(图2,序号1),重组酶在细胞内正常表达,分析上清液可知该酶获得了可溶性表达,纯化液中重组酶浓度较高,该酶成功纯化,共获得重组酶85.2mg,重组酶产率为1.91 mg/g。
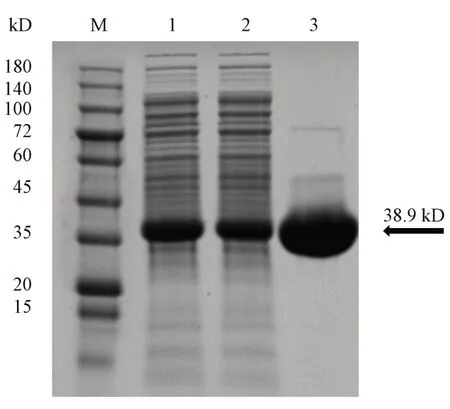
Figure 2 SDS-PAGE analysis of the recombinant enzymeM: Protein marker; 1: Cell lysate; 2: Lysate supernatant; 3: Purified Gne1
3.3 重组酶Gne1性质表征
对重组酶Gne1的天然活性进行验证,以UDP-葡萄糖为底物,其标准品保留时间为13.0 min,与Gne1 反应1 h 后,检测到产物UDP-半乳糖生成,保留时间为11.5 min,与UDP-半乳糖标准品保留时间一致(图3),由此验证天然底物活性。
该酶的最适温度进行研究(图4-A)。设置温度梯度的区间为16 ~51 ℃,7 ℃一个间隔,其在44 ℃时,酶活力达到最大,但是在该温度下,观察发现酶变性也较快,相比而言,37 ℃酶活力虽未达到最大,但在37 ℃下与天然底物反应1 至数小时,均未发现蛋白沉淀产生,故37 ℃下的反应更为稳定。在温度为51 ℃时,活力急剧下降至10%。
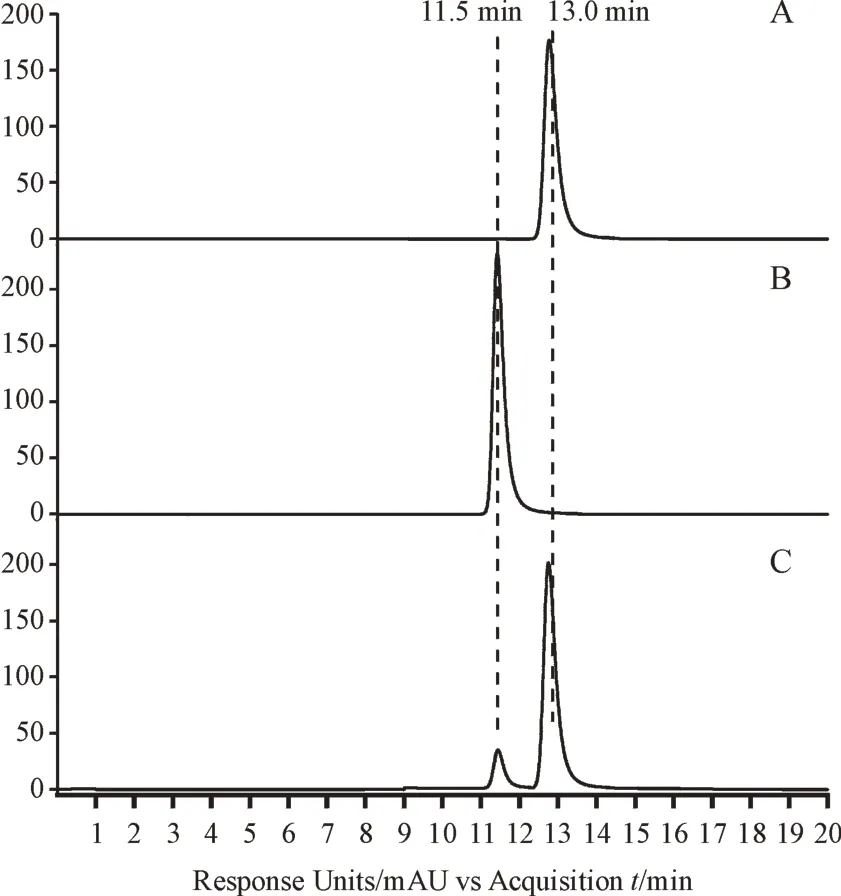
Figure 3 HPLC assay of Gne1 activityA: UDP-glucose; B: UDP-galactose; C: UDP-glucose incubated with Gne1
酶的最适pH 探究发现(图4-B),其活性在pH 6.0时活力达到最大,在pH 5.0时活力急剧下降到50%,在pH 7.0 及pH 8.0 时相对活力分别为75%及65%。

Figure 4 Optimal temperature, pH assay and kinetic parameters of Gne1 (±s,n = 3)A: Optimal temperature assay; B: Optimal pH assay; C: Kinetic parameters assay
根据得出的最适温度44 ℃和最适pH 6.0 为反应条件再次反应,反应体系中底物初始浓度为3.0 mmol/L,计算酶比活力为(1.558 ± 0.0697)mU/mg。
酶促反应动力学研究表明(图4-C),底物亲和常数KM=(1.227 ± 0.0824)mmol/L,最大反应速率vmax=(2.132 ± 0.0919)mU/mg,转化数kcat=82.64 ± 3.562 × 10-3min,催化效率kcat/KM= 61.69 ±4.597 × 10-3min/(mmol·L-1)。
3.4 重组酶Gne1的进化、序列和二级结构
选择来源于鲍曼不动杆菌AB0057 的UDP-葡萄糖4-差向异构酶(Genbank:ACJ39545.1)进行表征,一个重要的原因是其与研究较透彻的且显示出塔格糖催化活性的来自于大肠埃希菌的同工酶(Genbank:NP_415280.3)进化关系较近(图5-B),它们的序列相似性达到55.22%。为了更好地为蛋白质的改造做指导,除了对异构酶进行表征外,进化分析、序列分析和二级结构预测是必不可少的。
进化分析显示(图5-B),Gne1 属于NADB_Rossmann 超家族。NADB 结构域存在于许多代谢途径如糖酵解的脱氢酶当中,也存在于其他许多氧化还原酶中。由于异构酶催化过程中同样涉及到氧化还原,因此也需要NAD 的参与,故一些异构酶具有与NAD 结合的结构域,Rossmann 折叠便是其中一种。该折叠的拓扑结构为,第1 个β 折叠与其后的α 螺旋之间形成的转角处的氨基酸与NAD形成氢键,特征序列为GXGXXG,异构酶Gne1 的序列中同样具有这种特征,如预测的二级结构中,β1 与α1 之间的序列GAGYIG。且序列比对结果(图5-A)显示相应甘氨酸高度保守,这也许是很多异构酶都具有的特征。 此外,Gne1 还分属于UDP_G4E_1_SDR_e 亚家族,该亚家族作为短链脱氢酶家族的一员,序列中含有的特征基序为YXXXK,从多序列比对结果看Y 与K 同样是完全保守的,且被预测为关键催化残基,Gne1中存在的该特征序列为YGYTK。
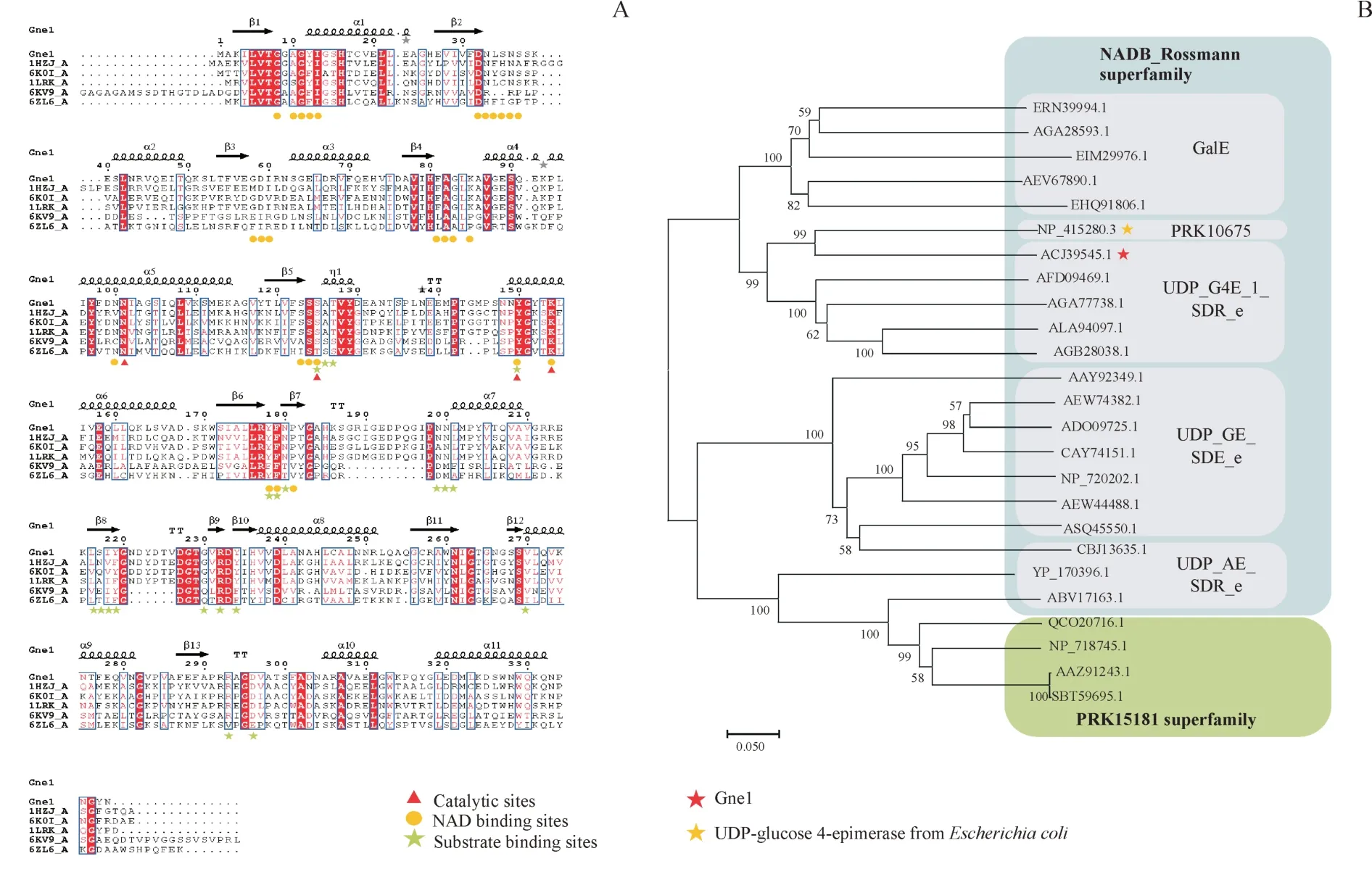
Figure 5 Bioinformatic analysis of Gne1 with its homologsA: Multiple sequence alignments; B: Phylogenetic tree analysis
预测催化活性位点除了Y150和K154外,还包括上游的N101 及S125。预测的NAD 结合位点为G8,A10,G11,Y12,I13,D32,N33,L34,S35,N36,S37,G58,D59,I60,F81,A82,G83,K85,N100,S123,S124,S125,Y150,K154,Y178,F179,P181。预测的底物结合位点为S125,A126,T127,Y150,Y178,F179,N180,N199,N200,L201,L216,S217,I218,Y219,G230,R232,Y234,V270,R293,D296。
二级结构预测结果显示,Gne1 蛋白包含11 个α 螺旋和13 个β 折叠。与NAD 相互作用的二级结构涉及7 个β 折叠与3 个α 螺旋,分布在Gne1 的N端。与底物相互作用的二级结构涉及5 个β 折叠和4个α螺旋,分布在Gne1的C端。关键催化氨基酸靠近序列中间位置,位于与NAD 相互作用位点和与底物相互作用位点的交叠处。
3.5 重组酶Gne1的同源建模及分子对接
除了进化分析、序列分析和二级结构的研究,同源建模及分子对接可以揭示Gne1 的结构特点,从而更加明确蛋白与配体的相互作用,对异构酶的改造作出更明确的指导。
以相似性较高的来自大肠埃希菌的异构酶(序列相似性为55.22%)为模板(PDB ID:1XEL)在Swiss Model 网站对Gne1 进行同源建模,对建模进行评估显示(图6-B),271(90.4%)个氨基酸落在主要允许区,25(8.6%)个氨基酸落在额外允许区,3(1%)个氨基酸落在可用允许区,落在非允许区的氨基酸数目为0。GMQE 指标通常在0 到1 之间,数值越高,表示建模的可靠性越高,结果显示建模的GMQE值较高为0.84。QMEAN指标在0附近表示模型结构与相似大小的实验结构之间具有良好的一致性,小于-4时则表明模型质量较低,建模的QMEAN 值为-1.27,说明与相似大小实验结构的一致性较好。另外Overall quality factor 的数值为95.4128,与高分辨率结构通常产生的数值相当。平均3D-1D score 不低于0.2 的残基比例为90.48%,达到80% 的阈值。综合以上各项评价指标可以说明建模的质量较高,可以用于后续的分析。
同源建模结果显示(图6-A),单体亚基包含两个结构域,一个是靠近N 端的NAD 结合区域,另一个是靠近C端的底物结合区域,在两个区域的表面形成的裂隙成为催化的活性位点。
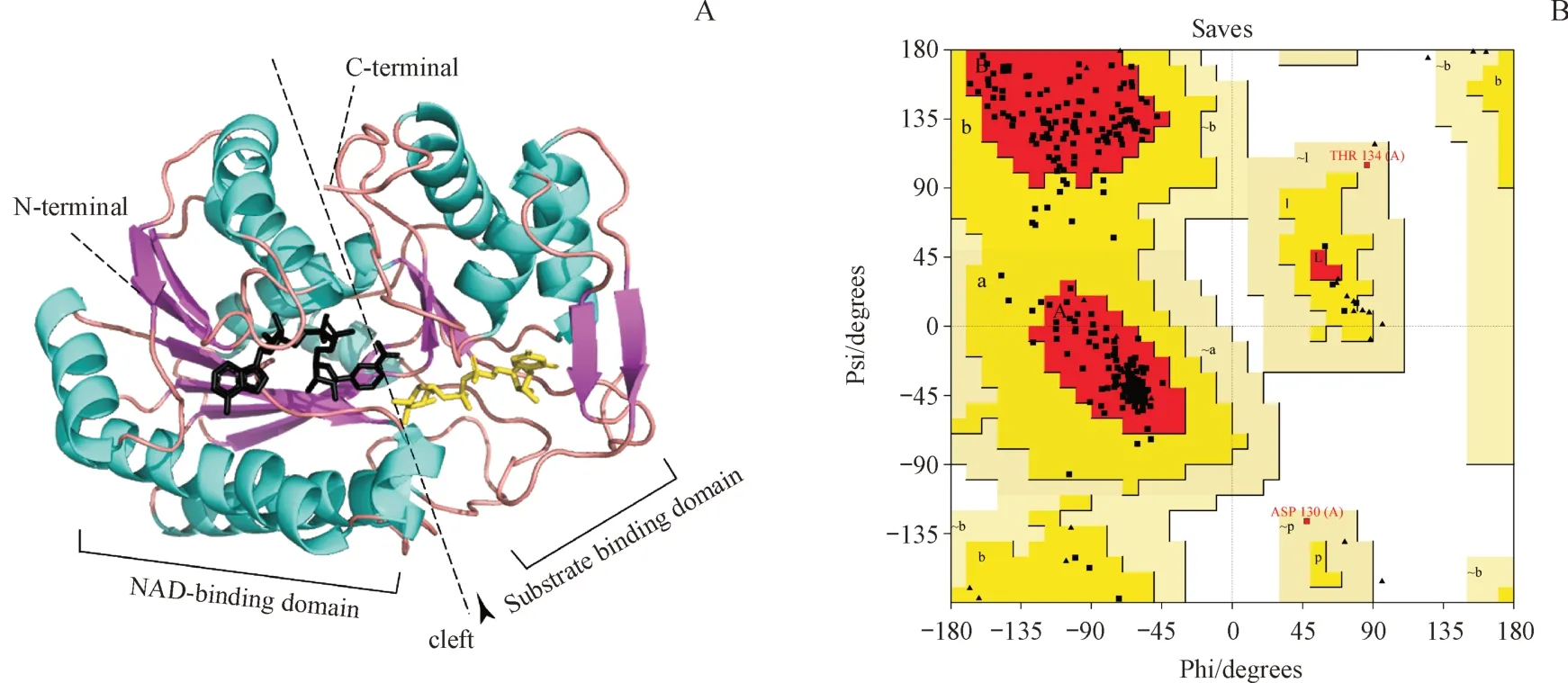
Figure 6 Homologous modelling structure and Ramachandran plotA: Protein structure of Gne1 homologous modelling; B: Ramachandran plot of Gne homologous modelling
酶与配体的相互作用结果显示(图7),与NADH具有氢键相互作用的氨基酸为Tyr12,Ile13,Asp32,Asn33,Ser35,Asn36,Ser37,Asp59,Ile60,Asn100,Tyr150,Lys154。其中,Ile13,与烟酰胺核苷酸的磷氧形成氢键,Asp32,与腺嘌呤核糖同时形成两个氢键,Tyr150 和Lys154 分别与烟酰胺核糖形成氢键,这四个位点在序列比对中显示出完全的保守性。另外,Lys85 与两个磷酸基团分别形成盐桥,帮助锚定NAD,除了6KV9 和6ZL6 这两种分别来自链霉菌和蜡状芽孢杆菌的以UDP-葡萄糖醛酸为底物的C-4 差向异构酶的序列外,在参与比对的UDP-葡萄糖4-差向异构酶的序列中均完全保守。
与底物UDP-葡萄糖的结合具有重要作用的氨基酸包括Ser125,Asn180,Asn200,Leu201,Ser217,Try219,Asp296。Ser125与葡萄糖的4-羟基紧密接触,距离仅为2.55 Å,除了来自蜡状芽孢杆菌里的蛋白,该位点完全保守,推测其为催化关键位点。Asn180 分别与葡萄糖6-羟基和β-磷氧形成氢键,除了链霉菌和蜡状芽孢杆菌的蛋白,该位点完全保守。Arg232 和Arg293,分别β-磷氧与和α-磷氧形成氢键及盐桥,前者完全保守,后者除蜡状芽孢杆菌的蛋白外完全保守。Asp296与腺嘌呤核糖的2-羟基形成氢键,除蜡状芽孢杆菌的蛋白,该位点严格保守。
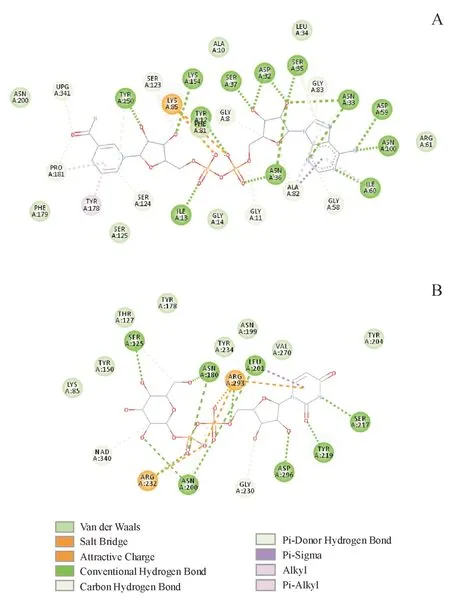
Figure 7 Interaction with ligands in Gne1A: Interaction with NAD; B: Interaction with substrate
4 讨论
本研究对来源于鲍曼不动杆菌的UDP-葡萄糖4-差向异构酶进行了表征并对与配体结合及催化的相关氨基酸进行了探究。Gne1 在大肠埃希菌BL21(DE3)中获得可溶性表达,并显示出对于天然底物UDP-葡萄糖的催化活力,其最适温度和pH分别为44 ℃和pH 6.0,底物浓度为3.0 mmol/L 时测得其酶比活力为(1.558 ± 0.0697)mU/mg,米氏常数KM与催化常数kcat分别为(1.227 ± 0.0824)mmol/L 和(82.64 ± 3.562)× 10-3min,Gne1 虽与来自大肠埃希菌的同工酶具有55.2% 的相似性,然而动力学特征存在差别,后者的动力学参数KM与kcat分别为225 μmol/L 与760 s-1[14-16]。这种亲和力与转换数的较大差距表明Gne1可能更适用于改造提升塔格糖催化活性。因为UDP-葡萄糖与塔格糖在结构上存在差别——UDP 基团,在改造提升对塔格糖的催化活性时,也许需要适当缩小底物口袋或者减小与UDP 的相互作用等,客观上也会造成酶与UDP-葡萄糖亲和力降低的结果。此外,改造还需进一步考量酶与配体NAD 及UDP-葡萄糖的相互作用以及关键催化氨基酸。
异构酶通常与NAD具有非常高的亲和力,纯化出的酶一般都含有完整的NAD,其可在浓盐酸胍中变性而后从酶中分离出来[17]。NAD 在实现异构酶催化活性的过程中非常关键,底物吡喃糖4-羟基氢被催化碱提取并被转移至NAD 形成NADH。Gne1序列分析结果也显示,其属于NADB_Rossmann 超家族,该家族的特点是具有能够与NAD(P)/NAD(P)H 结合结构域,Gne1 也存在这种结构域的特征GXGXXG,序列为GAGYIG,此外,底物对接后相互作用分析显示,与NAD 形成氢键相互作用的氨基酸多达12 个,盐桥2 个,其中还有高度保守的氨基酸Tyr150 和Lys154,这两个氨基酸也属于NADB_Rossmann 超家族中的亚家族——短链脱氢酶家族的特征氨基酸,序列形式一般为YXXXK。Lys154 的ε-氨基通过与烟酰胺核糖核环的4-羟基进行氢键作用,Lys154 在被突变为Met 后,酶与NAD 的结合明显减弱,因而该位点对NAD 的结合做出重要贡献[18],另外Asp32与腺嘌呤核糖2-羟基和3-羟基同时形成2个氢键,且在序列比对中显示完全保守,推测其对于NAD 的结合也是十分重要的。如此多的相互作用和关键位点的高度保守性也解释了NAD 与Gne1 具有高度亲和力以至于无需在反应体系中额外添加辅酶的原因。
Gne1 除了其N 端与NAD 结合的结构域外,还有一个用于与底物UDP-葡萄糖结合的较小的C 端结构域。与NAD 相比,该结构域中与底物相互作用形成氢键的氨基酸仅有7 个,形成盐桥的有2个,其他相互作用均比NAD少。其中,与UDP形成氢键相互作用的氨基酸有6个,而与吡喃糖相互作用的氨基酸仅有2个,与UDP结合作用强而与吡喃糖结合作用较弱,这反映了在催化过程中,UDP 基团对吡喃糖起到重要的定位作用,因此其对吡喃糖4-羟基构型的催化特异性可能是由于UDP 基团的正确定位产生的,同时作用力的减弱也增加了底物的活动性。对大肠埃希菌来源的同工酶晶体结构研究表明,UDP-葡萄糖,UDP-甘露糖,UDP-4-脱氧-4-氟-葡萄糖和UDP-4-脱氧-4-氟-半乳糖在吡喃糖基结合位点中,吡喃糖的取向是不同的[19]。另外在与UDP-半乳糖的晶体结构研究中显示,与UDP-葡萄糖相比,吡喃糖的构象发生了较大的翻转,这些研究均充分证实了在活性位点,羟基氢被催化碱提取接着被转移至NAD 形成NADH 后,形成的4-酮基吡喃糖中间体发生了翻转,使氢从NADH 返回到吡喃糖的另一面,实现吡喃糖4-羟基构型的变化[20]。在Gne1 中,催化构型变化的关键氨基酸极有可能为Ser125,在序列比对中,其与结构功能已知的大肠埃希菌的同工酶活性位点Ser124 相对应,且该位点高度保守。并且Gne1 与配体的相互作用显示,Ser125与葡萄糖的4-羟基形成氢键,距离仅为2.55 Å。
然而,除了Ser125,Tyr150 可能也参与到了催化作用中,在一些研究中表明,Tyr 提供了一般酸碱催化的驱动力,与Ser 在介导质子转移中起着重要作用。 这两个位点的双重突变Tyr149Phe/Ser124Ala-GalE 的最大活性仅为野生型的千分之一,单点突变后的活性为野生型的千分之一以下[16],并且这种突变并未影响到空间结构,因此突变后造成的影响是动力学性质的。Gne1与配体的相互作用显示Tyr150 与烟酰胺核糖2-羟基存在氢键,而与吡喃糖仅存在范德华力,虽然在实际催化过程中其距离吡喃糖4-羟基的距离可能会更近[21],但具体的作用有待通过Gne1 与底物的晶体结构研究进一步阐明。
——以高中化学“氢键”的教学为例

