靶向胰腺癌基质治疗策略研究进展
周新源,刘 楠,张 盼,霍美蓉
(中国药科大学药学院药剂系,南京210009)
胰腺癌是高度致死的实体肿瘤,由于早期诊断困难,绝大多数患者确诊时已是晚期[1],即使小部分确诊为局部可切除的患者,其术后5年存活率也低于20%[2]。纤维结缔组织增生(desmoplasia)是胰腺癌最为主要的病理特征[3],在肿瘤细胞周围构成了致密的基质物理屏障,严重阻碍化疗药物的递送和免疫细胞浸润[4],造成肿瘤细胞对化疗、放疗和免疫治疗均具有高度抵抗性。在胰腺癌纤维化进程中,以肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)和细胞外基质(extracellular matrix,ECM)为主的肿瘤基质扮演着重要角色[5]。胰腺癌细胞通过分泌音猬因子(SHH)、转化生长因子(TGF-β)、血小板衍生生长因子(PDGF)和成纤维细胞生长因子(FGF)[6]激活静息的成纤维细胞大量分化为具有肌成纤维细胞表型的CAFs[7]。激活后的CAFs 大量分泌包括透明质酸、胶原、纤连蛋白和细胞黏合素C 在内的多种ECM(图1)[8],CAFs 还可以自分泌TGF-β 自我维持病理循环[9],使得胰腺癌基质纤维化不断地发生,肿瘤基质占肿瘤体积的比例高达90%[10]。高度纤维化的肿瘤基质极大地升高了间质液压,大幅挤压瘤内血管,严重削弱药物和免疫细胞的杀伤效果[11],使瘤内处于高度乏氧和酸化条件下,瘤内血管新生(angiogenesis)加剧,形成了恶性循环。肿瘤基质内存在多种由CAFs 旁分泌的细胞因子和生长因子,如胸腺基质淋巴细胞生成素(TSLP)、趋化细胞因子5(CCL5)、白细胞介素8(IL-8),促进胰腺癌细胞耐药[12]、生长、侵袭和转移[13-14]。基质中大量三维网状结构的ECM 不仅是物理屏障,同时参与肿瘤细胞的信号转导,整合素α2β1 对1 型胶原有高亲和力[15],二者的结合会显著促进胰腺癌细胞的增殖和迁移[16],此外,ECM 可以被胰腺癌细胞通过巨胞饮的方式摄取,降解成氨基酸和葡萄糖参与三羧酸循环,作为肿瘤细胞增殖的营养物质[17]。本文综述了包括细胞外基质、肿瘤相关成纤维细胞和血管在内的靶向胰腺癌基质治疗策略研究进展,以期为胰腺癌的有效治疗提供新思路。
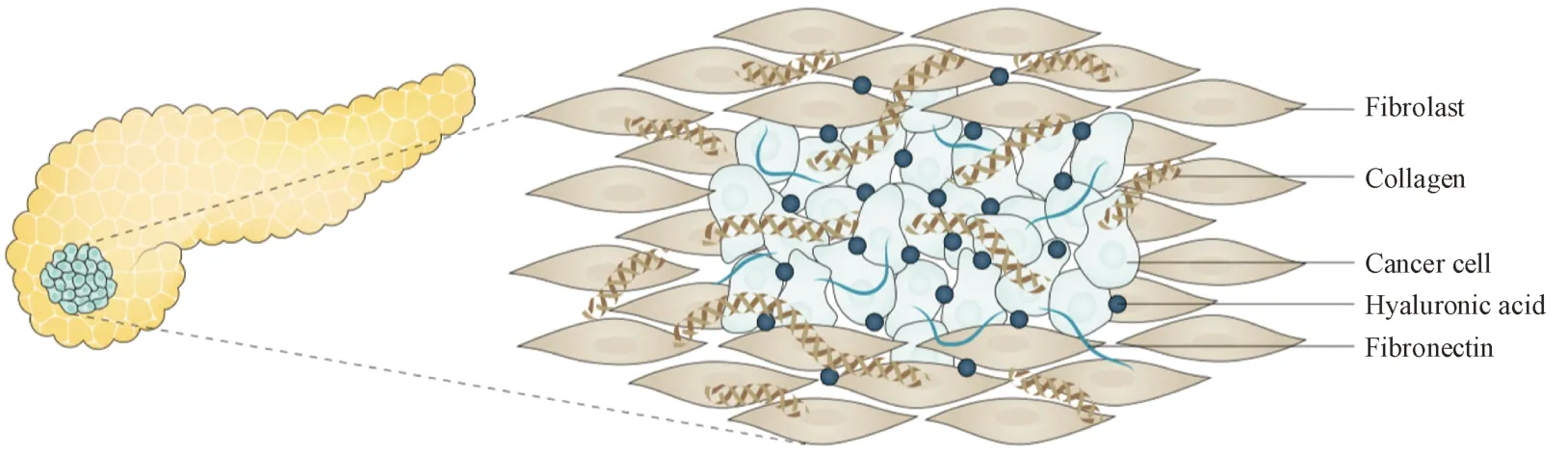
Figure 1 Fibrotic pancreatic cancer stroma[11]
1 靶向细胞外基质
细胞外基质由黏多糖、糖蛋白和胶原构成[18],在肿瘤组织间质中扮演着物理支撑和生物信号的双重角色[19]。正常组织的间质液压等于或小于末梢小动脉(40 ~80 mmHg)和毛细血管内压(15 ~40 mmHg),使得小分子从血管到组织间质的扩散、灌流和对流易于发生。然而,在胰腺癌组织中,由于肿瘤基质高度纤维化,细胞外基质大量沉积,间质液压大幅升高至75 ~130 mmHg[20],化学药物及免疫细胞的渗透分布效果大打折扣。
透明质酸(hyaluronic acid,HA)在大量实体肿瘤中普遍存在,晚期肿瘤中尤甚[21]。HA 是线性大分子黏多糖,能够键合并锁住细胞外基质中的水分子成静止、水化的凝胶状态[22],胰腺癌基质中大量的HA 导致间质液压升高。PEGPH20 是聚乙二醇化(polyethylene glycol,PEG)的重组人透明质酸酶,能够特异性降解肿瘤基质中的HA同时实现了透明质酸酶的体内长效循环。在一项临床前研究中[4],单次静脉注射PEGPH20 即可大幅降低KPC(LSLKrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre)胰腺导管腺癌小鼠瘤内间质液压至与正常生理水平相近(图2),当PEGPH20与吉西他滨联合用于KPC胰腺导管腺癌小鼠模型的治疗时,联用组的肿瘤组织切片分析结果表明其Ki67(核增殖抗原)是单用吉西他滨组的二分之一,caspase-3(真核细胞凋亡剪切蛋白酶)阳性细胞率是单用吉西他滨组的5倍,展现出更大程度的肿瘤组织凋亡,小鼠中位生存期由55.5 d 延长至91.5 d。在一项PEGPH20 和白蛋白结合型紫杉醇纳米粒/吉西他滨联合用于治疗Ⅳ期胰腺癌的Ⅱ期临床试验中[23],较单用化疗,PEGPH20预处理的高表达HA的患者(占入组总人数41%)的无进展生存期(progression free survival,PFS)增加了114%(由4.3 个月提高至9.2 个月),对高表达HA的胰腺癌患者显示出较强的治疗效果改善。

Figure 2 Enhanced chemotherapy with pancreatic cancer stroma targeting PEGPH20[4]A: High interstitial fluid pressure of pancreatic cancer hampers the convection and perfusion of molecues.B: PEGPH20 digests HA to attenuate IFP and impair physical barriers.C: Combined therapy of PEGPH20 and gemcitabine to enhance chemotherapy for pancreatic cancer.(Pi: interstitial fluid pressure; Pv: intravascular pressure)
Zinger 等[24]研究发现,在胰腺癌小鼠模型中,胰腺内胶原的体积高达(12.8 ± 2.3)%,而健康小鼠胰腺内胶原体积仅占(1.4 ± 0.4)%,其开发了一种装载有胶原酶(酶学委员会编号3.4-24.3)的脂质体,该胶原酶是一种水溶性的基质金属蛋白酶,对于胶原纤维有着特异的降解活性,通过将其包裹在脂质体中,极大地延长了半衰期,该研究预先通过尾静脉注射胶原酶脂质体治疗胰腺癌小鼠,再给以紫杉醇纳米胶束进行化学治疗,极大地改善了紫杉醇胶束的瘤内渗透分布,瘤体质量是单用紫杉醇胶束组的13%,显著提升了紫杉醇的化疗效果。
2 靶向基质细胞
胰腺癌基质中的细胞组分由成纤维细胞、胰腺星状细胞(pancreatic stellate cells,PSCs)、血管内皮细胞和淋巴细胞构成[25]。目前,临床(前)研究主要集中在靶向CAFs和血管的治疗。
2.1 靶向肿瘤相关成纤维细胞
2.1.1 化学药物 在胰腺癌细胞分泌的多种细胞因子刺激下,静息的成纤维细胞和胰腺星状细胞大量活化为具有肌成纤维细胞表型的肿瘤相关成纤维细胞,成为纤连结缔组织增生的首要制造者[7]。胰腺肿瘤细胞通过旁分泌配体的方式与CAFs 表面的Hedgehog 受体结合,激活Hedgehog信号通路,引发胰腺癌ECM 的沉积和肿瘤进展[26]。IPI-926 通过抑制肿瘤相关成纤维细胞中的Hedgehog 信号通路,大量杀伤、消融了CAFs 和纤维化的ECM,在临床前研究中显著改善了化疗药物的递送。除IPI-926 外,全反式维甲酸、Galunisertib、吡非尼酮和倒捻子素等化学药物在靶向调控胰腺癌CAFs 也发挥着重要作用,其作用机制和功能见表1。
全反式维甲酸(all-trans retinoic acid,ATRA)是最具活性的维生素A 代谢物,在健康的胰腺中,PSCs 可以存储维生素A 的代谢物维甲酸,而在胰腺炎和胰腺癌患者中,由于分泌功能受损,PSCs受激活后丢失维甲酸呈现激活的肌成纤维细胞样。Chronopoulos 等[27]发现,ATRA 能够通过维甲酸受体-β(RAR-β)/肌球蛋白轻链-2(MLC-2)通路,下调MLC-2基因的转录,大幅降低了PSCs 细胞的机械硬度。此外,研究表明[28]ATRA 可以引发PSCs 的G1期细胞周期阻滞,降低其增殖活性并恢复脂滴的蓄积,维持PSCs 的静息状态。ATRA 已作为胰腺癌基质靶向药物,与化疗药物白蛋白紫杉醇纳米粒和吉西他滨联合用药,正在开展Ⅱ期临床研究,从已经公布的Ⅰ期临床数据看,联用治疗方案的安全性和耐受性良好[28]。

Table 1 Mechanisms and function of chemotheraputics to target CAFs
TGF-β是一种多效的细胞因子,在胚胎发育和组织稳态中起着重要作用。一方面,在正常组织和胰腺癌发生的早期,TGF-β 可以抑制细胞增殖,反映出其抑瘤特性;另一方面,伴随着胰腺癌发展,TGF-β 能够促进肿瘤细胞增殖、自我更新,发生间充质转换进而更加具有侵袭性,同时它是CAFs 最为关键的活化因子。CAFs 细胞膜上TGFβ 受体活化后,会诱导Smad2、Smad3 信号分子磷酸化,并与Smad4 发生寡聚转移至细胞核内,诱导靶标基因转录促进ECM 蛋白分泌[29]。目前,靶向TGF-β/Smad 信号通路的抑制剂是公认的能够有效抑制CAFs 活化重塑胰腺癌纤维化基质的治疗手段。Galunisertib(GAL)是美国礼来制药开发的同类第1 个口服小分子TGF-β1 型受体抑制剂[30],大量临床(前)研究报道了其良好的抗纤维化效果。在2018年公布的Ⅱ期临床试验数据中,GAL和吉西他滨联用治疗晚期胰腺癌患者的总体生存期较单用吉西他滨(总体生存期7.1 个月)延长至8.9 个月[31]。
2014年FDA 批准了TGF-β/Smad 信号通路抑制剂吡非尼酮(perfenidone,PFD)用于特发性肺纤维化的治疗。近年来,越来越多的研究者认识到TGF-β/Smad信号通路抑制剂在基质丰富的胰腺癌治疗中的重要作用,致力于开发高效的纳米药物递送系统改善TGF-β/Smad 信号通路抑制剂的生物相容性。Ji 等[32]通过内插法在脂质体磷脂双分子层中插入基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)响应的肽段构建了MMP-2 响应的脂质体,通过薄膜水化法将PFD 封装在脂质体亲水腔中,并进一步通过挤出法获得了粒径均一的纳米粒,在该研究构建的PSCs/Mia-paca-2 小鼠胰腺癌体内模型中,PFD 原料药(30 mg/kg)及其脂质体制剂均能有效下调ECM 的表达,其中以MMP-2 响应型PFD 脂质体重塑效果最佳,免疫组化结果表明,其对1型胶原和纤连蛋白体内表达抑制水平超过80%,对细胞外基质糖蛋白Versican 和Tenascin C 的抑制率达到60%。MMP-2响应的PFD 脂质体重塑基质极大地提升了小分子化合物的瘤内灌注渗透能力[(972.2 ± 28.3)μm],渗透深度是对照组[(105.3 ± 12.1)μm]的10 倍,在与吉西他滨(20 mg/kg)联合序贯治疗的体内药效学实验中也收获了最大的抑瘤效果。
此外,中药单体化合物在沉默CAFs 方面展现出巨大的潜力,也成为TGF-β/Smad 信号通路抑制的重要筛选对象。倒捻子素(α-mangostin,α-M)是从山竹果皮中分离出的天然黄酮类化合物,在体内外研究中显示出较好的CAFs 沉默效果。Feng等[33]采用聚乙二醇-聚乳酸(PEG-PLA)作为基础载体,在PEG 头部偶联具有纤连蛋白黏附功能的CREKA 肽增强制剂的CAFs靶向性,装载倒捻子素构成胶束,倒捻子素有效敲低TGF-β 活化后NIH-3T3 细胞(CAFs 表型)中TGF-β 下游信号通路磷酸化Smad2、Smad3 的表达,显著抑制细胞外基质的表达,并且在NIH 3T3/Panc-1小鼠胰腺癌模型中也获得了较好的基质重塑效果,血管形态恢复、血流灌注增加,3 次静脉给药(倒捻子素剂量10 mg/kg)后,如图3 所示,DiD 标记的纳米粒瘤内渗透深度达 到(1189.49 ± 67.46)μm,是 生 理 盐 水 组[(284.75 ± 49.82)μm]的4.2 倍,重塑的基质微环境极大地增强了序贯治疗方案中雷公藤甲素化疗纳米粒的抑瘤效果。
2.1.2 基因药物 基因药物通过分子生物学方法将目的基因导入靶细胞以纠正基因异常引发的疾病,其需要选择合适的目标基因和作用靶点,并依托于适合的载体进行有效的递送。伴随着材料科学、生命科学的发展,以小干扰RNA、microRNA为代表的基因药物(表2)已成为胰腺癌治疗中重要的一环。

Figure 3 α-mangostin (α-M) micelles promoting penetration of DiD labelled nanoparticles in pancreatic cancer[33]Orthotopic pancreatic tumor bearing mice treatment of once, twice and thrice α-M (10 mg/kg) micelles and then injection of DiD labelled nanoparticles to investigate the intratumoral penetration and distribution through tail vein(Scale bars: 200 μm)

Table 2 Targets, types and function of gene theraputic agents targeting CAFs
小干扰RNA(siRNA)是双链非编码RNA 分子,长度通常在20 ~25 个核苷酸,siRNA 是基础生命科学领域研究基因功能的金标准,可以经由多种转染技术引入细胞内,与细胞质中RNA 诱导沉默复合物(RISC)结合并解旋,正义链被降解,反义链结合在RISC 上互补地和信使RNA 结合诱发特定基因转录后沉默[34],近来成为胰腺癌基质调控的研究热点。热休克蛋白47(HSP47)是胶原正确折叠和分泌到胞外的必要的分子伴侣,在肝、胰腺纤维化中得到了较为广泛的研究,Han等[35]通过瞄准HSP47 作为ECM 调控靶点,设计合成了靶向PSCs的HSP47编码基因的小干扰RNA(siHSP47),并通过静电吸附的方式负载在PEG 化的PEI-金纳米粒(Au@PP/siHSP47)上,同时荷载全反式维甲酸(ATRA)得到基因/化药联合治疗的金纳米粒(Au@PP/ATRA/siHSP47)。在PSCs 中,Au@PP/si-HSP47纳米粒有效敲低HSP47、胶原和纤连蛋白表达,Au@PP/ATRA/siHSP47 纳米粒则取得了最佳的PSCs 抑制效果,极大地改善了药物分子的瘤内渗透和分布效果,并在体内联合吉西他滨的序贯治疗中达到了近70% 的肿瘤抑制率。聚结合蛋白2能够稳定1型胶原的蓄积表达[36],进一步引发胰腺癌纤连结缔组织增生,Li 等[37]设计合成了能够沉默PCBP2基因(编码聚结合蛋白2)的小干扰RNA,与胆固醇-二硫键-亲水肽在水溶液中通过自组装自发形成纳米复合物,高效沉默CAFs 中聚结合蛋白2 的分泌和胶原的沉积,在Panc-1/NIH3T3多细胞肿瘤球中显著改善了小分子化合物的渗透深度,并在联合吉西他滨的小鼠原位胰腺癌体内模型中取得了72.3%的瘤重抑制效果。
MicroRNA(miRNA)是内源性非编码单链RNA,通常长度在21 ~23 个核苷酸,miRNA 是信使RNA 的互补序列,能够调控基因表达、细胞周期。在胰腺癌进程中,miRNA 广泛参与CAFs 的激活[38]。例如,胰腺癌高度乏氧的基质环境会诱导miR-210 的过表达,通过多种信号通路调节细胞适应严重缺氧的环境[39],对于CAFs 中miR-210 的沉默可以使CAFs 功能失活有效调控胰腺癌基质微环境。如图4 所示,Xie 等[40]设计合成了靶向作用于miR-210 的互补配对抑制剂(anti-miR-210)用于中和PSCs 中miR-210,通过静电吸附的方式将anti-miR-210 负载在课题组此前报道的胆固醇修饰的聚合物纳米粒(PCX)上,实现靶向沉默PSCs调控基质的目标,同时负载KRASG12D小干扰RNA(siKRASG12D)实现胰腺癌细胞的杀伤。在小鼠原位胰腺癌模型中,腹腔注射同时荷载anti-miR-210 和siKRASG12D的纳米粒,靶向敲低PSCs 中miR-210 表达,α-SMA 和1 型胶原表达抑制率达到60%,通过重塑基质CD8+T 细胞瘤内浸润效果提升近5 倍,取得了良好的肿瘤生长抑制效果,与生理盐水组相比瘤重抑制率达到60%,且显著延长了胰腺癌小鼠34% 的生存期,并有效抑制了肿瘤向肝脏转移,肝脏转移结节数量为0。此外,在CAFs 中还存在抗纤维化作用的miRNA(如miR-29)。当PSCs 被TGF-β 活化后,miR-29 的表达水平急剧降低,而当在PSCs 中重新引入miR-29 后,ECM 基质蛋白表达得到了显著的抑制。PSCs 中miR-29 的过表达可以通过旁分泌效应抑制肿瘤细胞活力,表明其在调控胰腺癌基质增生和肿瘤进展方面具有关键作用。伴随着对于非编码RNA 机制研究的深入,未来通过生物医学工程手段提高PSCs中类似miR-29抑纤维化表达的基因将具有良好的治疗前景。

Figure 4 Anti-miR-210 inhibiting PSCs to enhance gene therapy and immune infiltration[40]
2.1.3 抗体药物 整合素α11β1 是CAFs 表面高表达的胶原受体[41],Zeltz 等[42]开发了特异性阻断CAFs 表面整合素α11β1 受体的单克隆抗体mAB 203E1,有效阻断了胰腺癌CAFs 和胶原之间的黏附、抑制成纤维细胞介导的胶原重塑和肿瘤侵袭。CAFs 不仅严重削弱药物向肿瘤深部渗透,同时抑制免疫监视并促进肿瘤细胞进展[43]。具有标志性和特定功能的CAFs 表面蛋白的挖掘,有望成为靶向胰腺癌基质抗体药物的开发对象。成纤维细胞激 活 蛋 白(fibroblast activation protein,FAP)是CAFs 膜表面最具特征的标志物,其特征性强于α-SMA 和波形蛋白[44],在正常组织和健康器官中几乎不表达,而在基质重塑的组织如伤口和肿瘤组织中高度表达,越来越多临床证据表明高表达FAP 的胰腺癌患者临床预后往往较差[45]。表达FAP 的CAFs 细胞(FAP+CAFs)与肿瘤免疫抑制微环境高度相关[46],FAP+CAFs 能够分泌CXCL12 键合到肿瘤细胞上,消除CD8+T 细胞[47],使得由于致密的基质物理屏障造成的免疫细胞浸润困难局面“雪上加霜”。目前,靶向胰腺癌CAFs 表面功能蛋白的抗体药物仍然报道较少,抗体药物在胰腺癌基质治疗中的有效性有待更多的研究支撑。
2.1.4 细胞药物 嵌合抗原受体T 细胞(chimeric antigen receptor T cells,CAR-T)疗法是指通过基因工程方法将具有特异性抗原识别结构域融合到T 细胞受体信号域上,同时导入T 细胞协同刺激分子的遗传物质[48]。CAR 的细胞外部分负责抗原的特异性识别,随后信号分子激活刺激T 细胞增殖、细胞因子分泌以溶解、消灭靶细胞[49]。
Wang 等[50]开发了一种靶向小鼠成纤维细胞FAP 的CAR-T,该FAP-CAR-T 细胞可以分泌干扰素γ 并特异性识别、杀伤表达FAP 的NIH3T3 细胞且其体内安全性良好,治疗期间小鼠体重、骨骼肌功能和主要器官均未出现明显变化。Lo等[51]通过MigR1 质粒将FAP 抗体(73.3)、CD8α 铰链区和跨膜区作为单链Fv 片段,4-1BB 和CD3ζ 作为信号域克隆入逆转录病毒载体用以构建靶向FAP 的CAR-T细胞。以4662胰腺癌细胞小鼠皮下肿瘤模型和KPC 小鼠自发性胰腺癌模型为研究对象,每隔1 周每只小鼠静脉注射1×107个FAP-CAR-T 细胞(共两次)。肿瘤组织中FAP+CAFs 数量分别下降62% 和91%,SMA 阳性细胞数量均下降超过70%,表明FAP-CAR-T 细胞对于FAP+CAFs 的有效消融。在KPC 小鼠自发胰腺癌模型中,胶原、透明质酸和蛋白聚糖在治疗后表达水平分别下降70%、52% 和74%,同时通过获得性免疫抑制了肿瘤生长,在此基础上,该研究进一步联用吉西他滨进行化疗,获得了显著增强的抑瘤效果,为靶向胰腺癌CAFs 的CAR-T 治疗提供了新的希望。目前,靶向包含胰腺癌在内等多种恶性实体肿瘤相关成纤维细胞FAP 的CAR-T 正在进行Ⅰ期临床试验(NCT03932565)[52],其临床治疗效果值得期待。
2.2 靶向血管
胰腺癌基质高度纤维化,微血管密度高,高间质液压使瘤内血管皱缩,加剧了低血流灌注的局面,造成肿瘤组织高度乏氧和酸化。乏氧状态下,缺氧诱导因子-1(HIF-1)能保持稳定并诱导下游一系列基因的转录,刺激血管内皮生长因子(VEGF)和血小板衍生生长因子(PDGF)的表达,进一步促进非正常的血管新生。早在1970年,Folkman[53]就证明肿瘤的生长是血管新生依赖性的,实体肿瘤血管高度异质,根据肿瘤类型、发展阶段的不同而变化[54],形态扭曲,表现为不充分、不规律地分岔,在肿瘤基质中纵横交错地构成了一张杂乱的“网”(图5),血管壁高度渗漏。Folkman 提出抗血管生成的治疗策略即通过“饥饿肿瘤细胞”的方式抑制肿瘤生长,在随后的几十年中,大量抗血管新生药物的临床(前)研究如火如荼地进行。
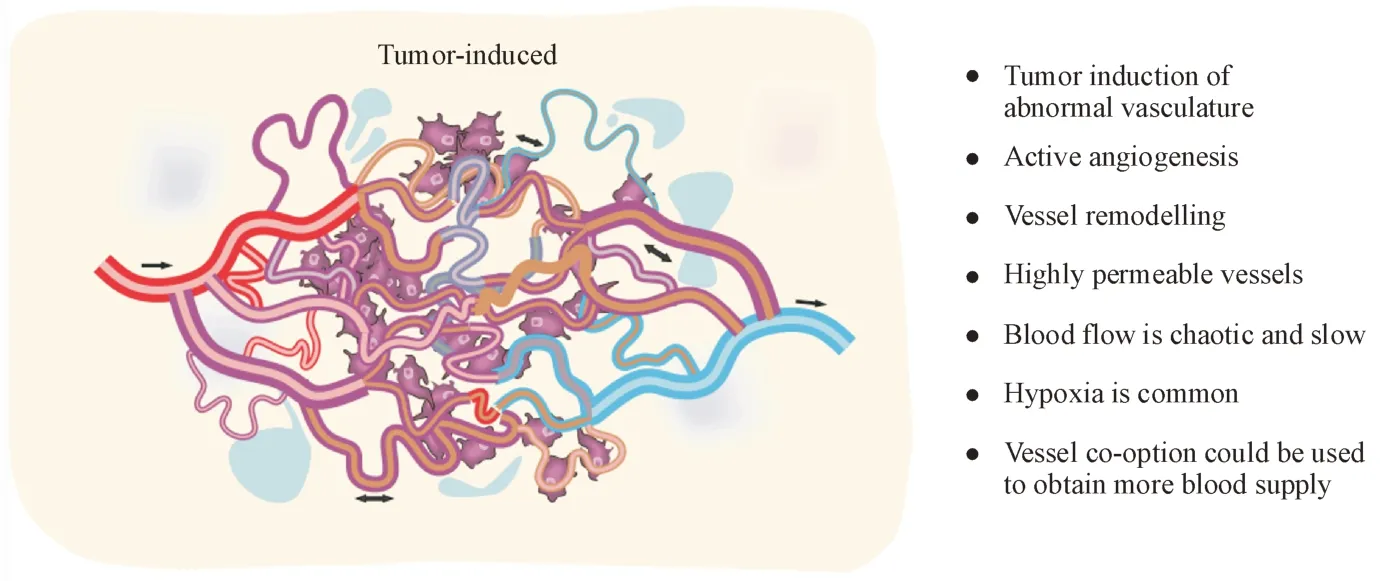
Figure 5 Heterogeneous tumor vessels[55]
然而,抗血管新生治疗策略在胰腺癌治疗一直是一个具有争议的话题[56]。Gaustad 等[57]分别在裸鼠BxPC-3 和Capan-2 胰腺癌皮下移植肿瘤模型中研究了舒尼替尼(VEGF和PDGF受体抑制剂)对于肿瘤血管和氧气的影响,通过背部视窗观察发现舒尼替尼选择性地消除了肿瘤内细径血管,降低了血液供应并大幅加剧了瘤内缺氧程度。事实上,多项针对胰腺癌抗血管新生的临床试验结果均令人失望,如索拉非尼、阿帕西普和elpamotide等抗血管生成剂和吉西他滨联用的Ⅲ期临床试验中,患者的总体生存期和无进展生存期均未得到有效延长,甚至出现了恶化,给胰腺癌抗血管新生治疗蒙上了一层阴影[58]。乏氧会促使肿瘤细胞变得更具侵袭性,且通过克隆选择存活下的肿瘤细胞往往更为耐受乏氧等极端条件,非正常新生血管由于形态渗漏给肿瘤细胞提供了向远端转移、逃逸的通道。此外,乏氧会阻碍免疫细胞对肿瘤细胞的识别杀伤并且直接阻碍包含放疗在内的需氧治疗手段的疗效。这里似乎存在一个悖论,抗血管生成剂如何在破坏血管的同时能保证化疗药物有效递送到肿瘤部位而改善其治疗疗效。
近期,Katsuta 等[59]利用肿瘤基因图谱(The Cancer Genome Atlas,TCGA)中的RNA 序列数据,以CD31(血管内皮细胞标志物)表达量为指标将胰腺癌患者分为高、低表达组,CD31高表达的患者展现出总体生存期显著延长,且激活的记忆CD4+T细胞、CD8+T 细胞、γδ T 细胞和初始B 细胞浸润量更高,该研究认为CD31 表达增强能够改善胰腺癌的免疫细胞浸润和免疫应答。上述研究结果表明,靶向胰腺癌基质抗血管生成治疗策略不能单纯地以摧毁血管为终点,而应该将血管正常化作为目标——通过抗血管生成剂的使用,暂时地修复血管的异常形态和功能,利用血管正常化的窗口期,肿瘤的氧气含量和药物递送均能得到有效提升。
3 总结与展望
由于胰腺癌基质高度纤维化的特殊性,靶向肿瘤基质在改善抗肿瘤药物递送和延长患者生存期仍然是极具效力的策略。目前,以CAFs 和ECM为靶标的胰腺癌基质治疗是较为热门且成熟的研究方向。从传统的靶向药物到免疫治疗如CAR-T都有CAFs 的身影,其在胰腺癌治疗中的地位至关重要。越来越多的研究表明,对于CAFs 的直接杀伤会使得胰腺癌细胞更具侵袭性且不利于患者生存期的改善[60],因而靶向胰腺癌CAFs 的治疗策略应当注意避免使用过于极端的治疗手段,需要将重点放在对CAFs 功能的调控以重塑纤维化胰腺癌基质,增强化疗、放疗和免疫治疗疗效。作为肿瘤基质不可或缺的组分,血管是肿瘤营养物质的必要通道,也是化学药物、免疫细胞发挥作用的必经之路。然而,抗血管生成策略在胰腺癌治疗中收效甚微。2001年,也是在抗血管生成剂应用的30年后,血管正常化的概念才为大家所了解,实际临床研究中,由于测量设备、有效分子生物标志的缺乏,患者血管正常化窗口的界定仍然是横亘在临床前研究转化的一大鸿沟,相信在未来胰腺癌进展中关键基因、标志蛋白得到更为透彻的研究后,靶向胰腺癌基质的治疗会迎来更为宽广的发展空间。

