季戊四醇四油酸酯合成反应的热力学分析
张 建,王 伟,钱文珍,刘 曦,刘宝勇*
(1. 兰州交通大学 化学化工学院,兰州 730070;2. 兰州交通大学 环境与市政工程学院,兰州 730070;3. 兰州交通大学 材料科学与工程学院,兰州 730070)
润滑油在现代工业生产中发挥着必不可少的作用,被用于各种行业,如航空、汽车、金属高温加工等领域[1-2].因此,润滑油性能的提升和更新换代受到了广泛的关注.目前润滑油大致分为植物润滑油、矿物润滑油和合成润滑油三大类.季戊四醇油酸酯作为多元醇脂肪酸酯类合成润滑油,其分子结构中含有较多高活性的酯基,不仅具有优异的热稳定性和氧化稳定性,而且兼具良好的水解稳定性、低温流动性、润滑性能以及生物降解性和环境友好性,是重要的合成润滑油[3-4].同时,随着人们对于环境问题的愈发关注,具有良好的生物降解性的季戊四醇油酸酯将会受到越来越广泛的使用[5].
目前,其合成方法多以酯化法[6]为主,但是该工艺生产过程中缺乏热力学数据的指导;热力学分析是化学反应发生的可能性和反应限度的重要判据,可以为反应的操作条件、反应装置设计及催化剂选用等提供参考;热力学计算可以给出化学反应的理论极限转化率,对工艺过程具有重要指导意义.基团贡献法是估算化合物物理化学性质的一种准确性高、适用范围广、计算过程简便、通用性强的经典热力学方法[7].王丽娇等[8]利用基团贡献法对大豆油中的三油酸甘油酯和碳酸二甲酯进行酯交换制取脂肪酸甲酯和碳酸甘油酯反应进行了热力学计算与分析.马鸿宾等[9]采用基团贡献法对三油酸甘油酯与甲醇酯交换反应进行了热力学计算与分析.马楷等[10]通过基团贡献法对庚酸与季戊四醇酯化反应进行了热力学数据计算与分析.但关于季戊四醇四油酸酯的合成体系热力学分析的研究尚未见报道.同时,该反应体系中所涉及中间反应的基础热力学数据也鲜有报道.
本文通过基团贡献法对各物质进行热力学数据估算,并将估算数据与文献中数据进行对比.在反应温度范围内分析了常压下合成季戊四醇四油酸酯液相反应体系的标准摩尔反应焓变、标准摩尔反应吉布斯自由能变、反应平衡常数以及与温度的关系,进而为该体系反应条件的优化和应用提供一定的理论依据和参考.
1 反应过程及估算路径设计
由于油酸分子基团较大,在以季戊四醇和油酸为原料合成季戊四醇四油酸酯的反应中,季戊四醇的邻位酯化反应具有较大的空间位阻效应,反应活性低,邻位酯化反应要比对位酯化困难的多.正是由于该反应空间位阻的特殊性才避免了无效副产物(邻位季戊四醇二油酸酯)的生成.根据相关文献[11-12],季戊四醇和油酸酯化反应得到季戊四醇四油酸酯是通过“四步”反应来实现的,其化学反应方程式如下所示:
分步反应


根据计算需求,采用逆分析法对热力学计算路径进行梳理,详细计算路径设计如图1所示.

图1 季戊四醇四油酸酯合成反应的计算路径设计
2 过程分析与计算
对于不同化学反应体系而言,化学平衡常数Kθ是评价化学反应进度的重要指标,在工业生产上具有重要作用.不同温度下的化学平衡常数Kθ,其值可以通过范特霍夫方程(1)来计算,表达式为
(1)
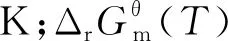
温度T下液相反应体系标准摩尔反应Gibbs自由能变化量计算公式为
(2)

(3)
(4)


(5)
(6)

(7)
(8)


(9)
(10)

(11)

2.1 气态条件下组分生成焓和熵的估算


表1 该反应体系中各物质在298 K下气态的标准摩尔生成焓和标准摩尔熵

2.2 组分蒸发焓和蒸发熵的估算
(12)

(13)
式(13)为Watson方程[17]、n通常为0.375或0.38,本文n取值为0.38.
(14)
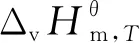
(15)
(16)
(17)
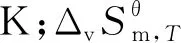
2.3 组分临界温度和沸点的估算
对于反应体系各组分的临界温度Tc和沸点Tb的计算,采用Marrero-Pardillo(M-P)[17]方法计算,计算公式如式(18)和(19)所示.
(18)
(19)
以Marrero-Pardillo(M-P)[17]方法计算反应体系各物质的Tc和Tb,这种方法也被称作是基团相互作用贡献法/键贡献法.M为相对分子质量;Nk为k类原子数;k类原子贡献值表示为tcbk和tbbk.
该反应体系中各组分的沸点、临界温度、标准摩尔蒸发焓和标准摩尔蒸发熵的具体计算结果如表2所列.

表2 反应体系各物质的热力学数据
以Marrero-Pardillo(M-P)[17]基团相互作用法估算该反应体系各物质的沸点Tb和临界温度Tc的数值相对可靠,其最大相对误差为9.26%,其余相对误差均在2%以下.
2.4 各组分液态热容的估算
(20)
(21)
(22)
(23)
式中:R是气体摩尔常数,数值为8.314 5 J/(mol·K);A、B、D为相对应的参数,其值依据基团贡献法求得,具体计算方法如式(21)~(23)所示,ni为i类基团的个数;k为不同种类基团的总数.

(24)
(25)
(26)

表3 反应体系各物质的热力学数据
2.5 季戊四醇四油酸酯合成反应中以及Kθ的计算
(27)
(28)
(29)
3 季戊四醇四油酸酯合成反应热力学数据分析
3.1 四步分反应的以及Kθ随温度的变化如下
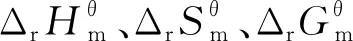

图2 分步反应和Kθ与温度T的关系

在实际反应生产过程中,反应平衡常数Kθ是衡量反应转换率的重要参数.图2(d)表明四步反应的Kθ随着温度T的升高而升高,说明在计算温度范围内,温度升高,有利于各步反应的进行.一般情况下将Kθ数值<10-5的视为反应无法进行,将Kθ>105的反应认为反应较为完全,可作为不可逆反应对待,且数值越大,反应越完全[24].以季戊四醇和油酸合成季戊四醇四油酸酯的四步连续分反应的Kθ均远大于105,其计算数值均在1.787×1012~3.772×1014范围内,说明各分步反应较为完全.
3.2 总反应中温度对以及Kθ的影响

图3 总反应的以及Kθ随温度T的变化 and Kθ of the total reaction as a function of temperature T

4 结论

1) 以季戊四醇和油酸为原料合成季戊四醇四油酸酯的总反应和四步分反应过程是一个能自发进行的吸热反应,在计算温度(403~493 K)范围内升高温度有利于正反应的进行;
2) 总反应和四步分反应的吉布斯自由能变均<0,在反应温度范围内,温度越高,吉布斯自由能变越小,表明升高温度,有利于正反应的进行;
3) 总反应和四步分反应的平衡常数均>105,表明各反应在热力学角度进行的都很完全;
4) 通过估算得到的有关热力学数据不仅可以为季戊四醇四油酸酯的合成开发以及规模生产提供依据,更是为各季戊四醇油酸酯(油酸一酯、油酸二酯和油酸三酯)的工业生产提供了热力学数据.

