二维B、N 掺杂炭片的电化学氧化及其赝电容性能
胡友仁, 董晓玲, 侯 璐, 庄洪坤, 李文翠*
(大连理工大学 化工学院,辽宁 大连 116024)
1 前言
超级电容器由于其高功率密度、长循环寿命等方面的显著优势,可作为电子设备、动力汽车和轨道交通的辅助电源[1–3]。多孔炭电极材料因其良好的导电性、稳定的物理化学性质、丰富的微观结构与可控的表面化学性质是应用广泛的超级电容器电极材料,但基于表面离子吸/脱附的双电层电容储能机制使炭基电极材料的比电容通常不超过300 F·g−1[4–5]。与高比电容的金属氧化物构建复合电极可提高炭基超级电容器的比容量,但会降低电极反应动力学和稳定性。如何在不牺牲电极功率密度和循环寿命的前提下提升炭基电极的能量密度,拓宽超级电容器的应用场景,是当前的研究热点。
在炭基材料中引入杂原子可以改善电极浸润性,增加可接触比表面积,提升双电层电容,并且部分官能团可以与电解质离子发生氧化还原反应提供额外的赝电容[6–8]。目前,包括硼、氮、氧在内的多种杂原子已被应用于炭基电极材料的掺杂改性,其中硼、氮元素在碳骨架中的掺杂可以提供额外的电子和导电空穴,改善炭基电极的导电性[9–10]。而特定种类的氮、氧官能团如吡啶氮、吡咯氮和醌基氧则可以提供丰富的氧化还原赝电容[11–13]。其中醌基官能团因具有良好可逆性和快速动力学的两电子转移反应,是公认的理想赝电容基团[14–15]。虽然特定含氧官能团可以大幅提升炭基电极的比电容,但过量引入会不可避免地降低导电性,因此对炭基材料中含氧官能团含量与种类进行设计和优化,以促进氧化还原赝电容的高效发挥,是制备高性能炭基超级电容器电极材料的关键。
传统的氧掺杂炭制备方法如前体继承[16–18]、化学氧化[19–20]往往伴随着高温、强腐蚀性酸等反应条件。近年来,更加温和、可控的电化学氧化法逐渐引起关注[21–22]。相较于传统方法,电化学氧化可通过改变氧化电压、电流、时间等氧化条件对氧化过程进行精准调控[23–24],并且相对温和的反应条件也有助于保持电极材料的多孔结构和导电性能[25–26]。鉴于硼、氮元素的掺杂可以改变碳骨架电子云密度分布并提高炭材料导电性能,将硼、氮掺杂炭与电化学氧化过程相结合,利用B、N 掺杂提升炭基电极电化学氧化效果并改善氧化电极的导电性能,是获得兼具高比电容和高倍率性能的先进炭基电极材料的极具潜力的途径。
本研究以高比表面积B、N 掺杂二维炭纳米片(BNCS)为电极材料,通过原位电化学氧化过程,引入丰富的电化学活性含氧官能团提供额外赝电容。本文对比了不同电化学氧化方法对氧化电极的表面组成与性能的影响。相较于持续高电位下的恒压氧化,循环伏安氧化中反复的氧化与还原有利于电极氧化的深入和总氧含量的增加,并且能够选择性引入以电化学活性醌基基团主导的氧物种,实现含氧官能团含量和种类的调控与优化,从而得到兼具高赝电容和快速动力学的炭基电极材料。
2 实验
2.1 材料和仪器
硼酸、2-甲基咪唑、间苯二酚和甲醛购自国药集团化学试剂公司,炭纸购自日本东丽公司,氧化石墨烯(GO)分散液是通过改良的Hummer法制备的。电化学氧化实验在上海辰华公司CHI 660E 电化学工作站进行。
2.2 BNCS 的合成
在9.13 mg GO 分散液(1.8 mg·mL−1)中依次加入213.4 mg 2-甲基咪唑、250 mg 间苯二酚、160 mg 硼酸和335 μL 甲醛,搅拌至完全溶解后转移至密封石英管,置于90 ℃鼓风干燥箱老化24 h。将得到的树脂前驱体干燥后,于氩气气氛下800 ℃炭化2 h,升温速率为3 ℃·min−1。将得到的样品研磨后于80 ℃水洗2 h,干燥后即为B、N 掺杂炭纳米片,记为BNCS。此外将未添加硼酸和2-甲基咪唑的酚醛树脂炭化得到的样品作为对比样,命名为CS。
2.3 电极片的制备
将得到的样品作为活性物质,按照活性物质∶黏结剂(聚偏氟乙烯,PVDF)∶导电剂(科琴黑)=8∶1∶1 的质量比进行混合,在N-甲基吡咯烷酮(NMP)溶剂中配成浆液,搅拌过夜。将浆液涂覆于炭纸集流体上,100 ℃真空干燥过夜。电极片活性物质负载量为1.8 mg·cm−2。
2.4 电极片的电化学氧化
将电极片置于1 mol L−1H2SO4中,在真空下浸润24 h。之后以电极片作为工作电极,铂片为对电极,Hg/Hg2SO4电极为参比电极,1 mol L−1H2SO4为电解液组装三电极体系。使用上海辰华公司CHI 660E 电化学工作站,采用循环伏安氧化和恒压氧化两种方法对BNCS 电极进行电化学氧化。循环伏安氧化中选用的氧化电压区间为−0.65~2 V(vs. Hg/Hg2SO4参比电极,下同),氧化扫速为5/10/20 mV·s−1,氧化次数为3 圈,制备的氧化电极命名为BNCS-CV-x,x 表示氧化扫速。恒压氧化中选用的电压为2 V,氧化时间为10/30 min,所得氧化电极命名为BNCS-CP-y,y 表示氧化时间。此外,在多次高电位恒压氧化间穿插低电位循环伏安扫描的氧化方法也被应用于对电极片的氧化处理,其中高电位恒压氧化采用的电压为2 V, 低电位循环伏安扫描则在−0.65~0.35 V 电压区间内以5 mV·s−1扫速下扫描3 次。制备的电极命名为BNCS-CB-y*z,其中y 表示高电位恒压氧化的时间,z 表示反复高电位恒压氧化和低电位区间循环伏安扫描的次数。
2.5 电极片的电化学测试
采用上述三电极体系在电化学工作站上对氧化电极进行电化学性能测试。其中,在−0.65~0.35 V 的电压窗口内测试电极片的循环伏安(CV)曲线和恒流充放电(GC)曲线。在0.01~100 000 Hz 的频率范围内采集电极片的电化学阻抗(EIS)谱,测试振幅为0.005 V。使用电极的GC 曲线计算电极材料的比电容C,计算公式如下:
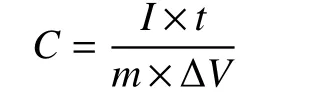
其中I为电极恒流放电电流,t为放电时间,m为电极活性物质质量,ΔV为电极放电电压区间。
2.6 电极的表征
使用美国FEI Quanta 450 场发射扫描电子显微镜(SEM)和美国FEI Tecnai F30 透射电子显微镜(TEM)观察了电极材料的微观形貌结构。使用美国Micromeritics 公司TriStar 3000 型物理吸附仪测试了电极材料的比表面积。使用赛默飞世尔科技有限公司Nicolet 6700 红外光谱仪(FTIR)表征了氧化前后电极材料的官能团变化。通过德国Element Vario EL 元素分析仪测定了电极材料的元素组成。采用美国Thermo VG ESCALAB 250 X-射线光电子能谱仪(XPS)对电极材料表面的元素组成和价态进行表征。
3 结果与讨论
3.1 BNCS 的合成
B、N 掺杂纳米炭片的合成是基于GO 诱导的酚醛聚合过程。如图1a 所示,GO 在反应体系中作为结构导向剂,通过氢键作用诱导间苯二酚在其表面富集,随后甲醛的加入使得酚醛树脂原位聚合于GO 基底表面,自组装成二维片状结构。SEM(图1b-c)和TEM(图1d)表明材料具有典型的二维片状结构,尺寸分布在0.5~2 μm 之间,厚度约为80 nm,进一步证明了GO 模板的作用。硼酸和2-甲基咪唑分别作为硼源和氮源,通过氢键和静电作用力均匀掺杂于聚合物前驱体中,并在后续的热解过程中掺杂于碳骨架中。这种二维片状结构可以有效地提高电极材料的可接触比表,降低离子的传输距离。氮吸附测试表明BNCS 材料为典型的微孔材料,比表面积为614 m2·g−1,其中微孔比表面积为520 m2·g−1(vs.CS 材料334 m2·g−1)。BNCS 材料丰富的微孔为炭电极的电化学氧化过程和电极反应提供了充分的反应相界面。综合而言,BNCS 电极作为电化学氧化炭电极具有良好的潜力。
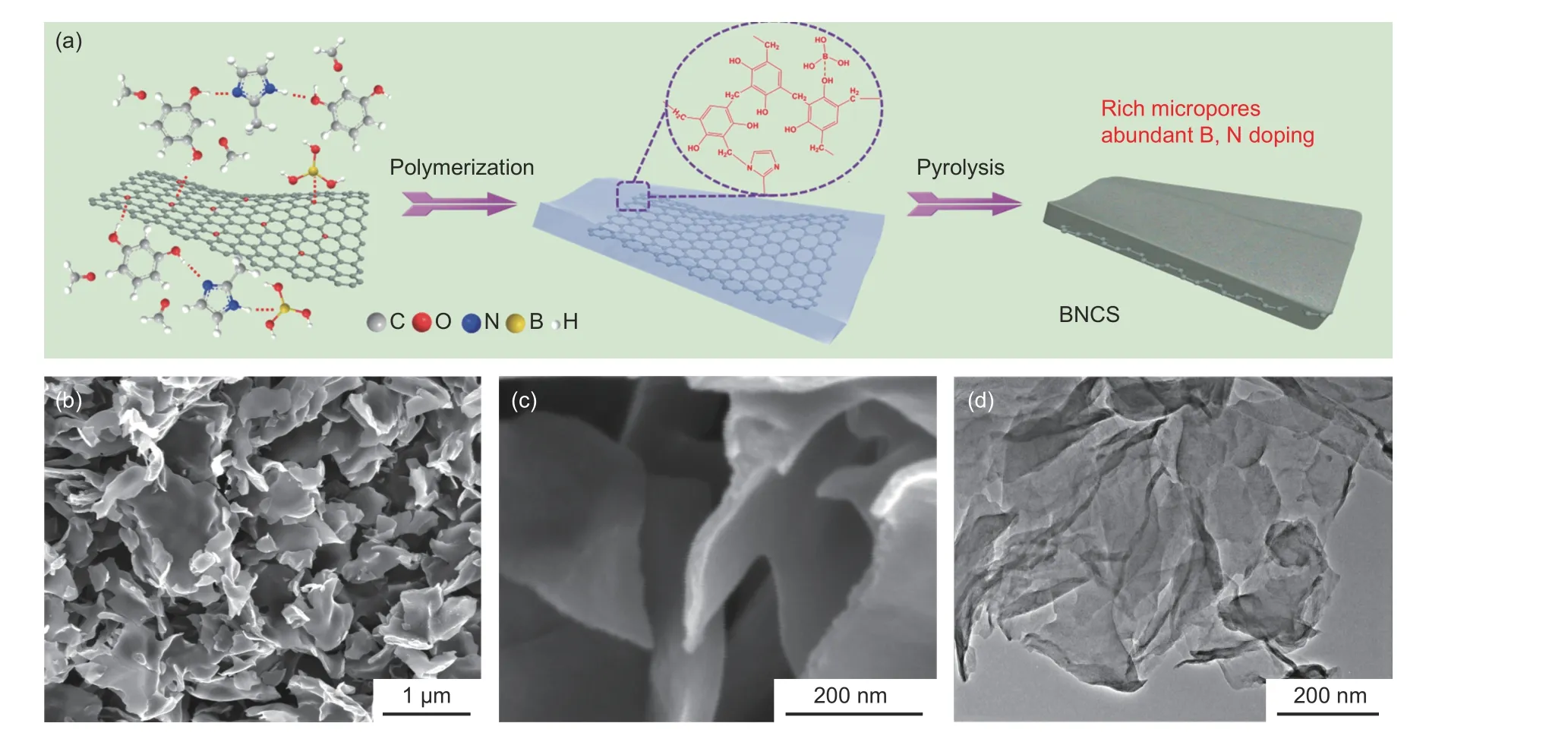
图 1 BNCS 的(a)合成示意图及(b-c)SEM、(d)TEM 照片Fig. 1 (a) The schematic diagram of synthesis and (b-c) SEM, (d) TEM images of BNCS.
3.2 BNCS 电极的电化学氧化模式研究
氧化电极的电化学性能高度相关于电化学氧化过程的工艺条件,因此选用适宜的电化学氧化方法并进行工艺优化是获得具有特定含氧官能团和优良电容性能的炭基电极的关键途径。使用不同氧化方法氧化电极片的E-t 曲线和I-t曲线如图2 所示。在循环伏安氧化过程(图2a)中,炭电极在高低电位间进行反复扫描,在高电位出现约500 mA 的氧化峰电流,表明炭电极上发生了剧烈的氧化反应。而在低电位时出现还原峰,表明氧化形成的部分不稳定含氧官能团会在低电位下被还原,这有利于提升引入的氧物种的稳定性。在多次反复的氧化与还原中,电极的氧化逐渐由表面深入内部,氧化峰电流值也发生一定的衰减。而在恒压氧化过程(图2b)中,电极始终处于高氧化电位下,在氧化初始阶段,炭电极上出现极高的氧化电流(800 mA),但随氧化时间迅速衰减,并在10 min 内基本衰减至零,表明此时电极的氧化已接近饱和。为探究循环伏安氧化与恒压氧化的区别,在多段的恒压氧化之间增加低电位循环伏安扫描,过程如图2c 所示。从图中可以看出,恒压氧化达到饱和的氧化电极在低电位循环伏安扫描过程出现还原峰,并且在后续的恒压氧化中重新出现明显的氧化电流峰,表明低电位区间循环伏安扫描的部分还原过程有利于后续过程中氧化过程的进一步深入。
3.3 BNCS 氧化电极的电容行为
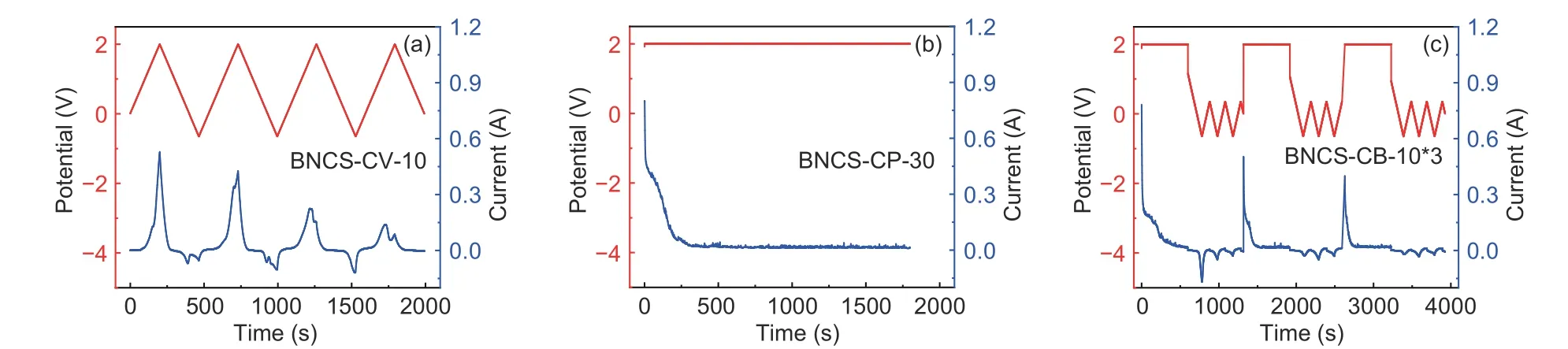
图 2 (a)循环伏安氧化、(b)恒压氧化、(c)恒压-循环伏安组合氧化的E-t 曲线和I-t 曲线Fig. 2 E-t curves and I-t curves of (a) cyclic voltammetry oxidation, (b) constant potential oxidation and(c) combination of constant potential and cyclic voltammetry oxidation.
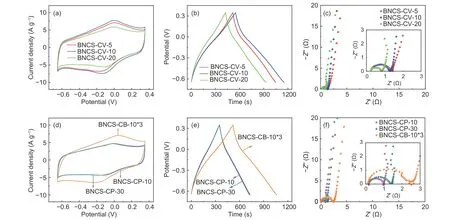
图 3 不同氧化条件制备的BNCS氧化电极在三电极体系下的1molL−1 H2SO4 中的电化学测试:BNCS-CV-5、BNCS-CV-10、BNCS-CV-20氧化电极(a)在10mV·s−1 下的CV曲线、(b) 1A·g−1 下的GC曲线和(c)电化学阻抗谱;BNCS-CP-10、BNCS-CP-30和BNCS-CB-10*3氧化电极(d) 在10 mV·s−1 下的CV 曲线和(e) 1 A·g−1 下的GC 曲线和(f) 电化学阻抗谱Fig. 3 Electrochemical evaluation of oxidized BNCS electrodes prepared under different oxidation conditions measured in a three-electrode system in 1 mol L−1 H2SO4: (a) CV curves at 10 mV·s−1, (b) GC curves at 1 A·g−1 and (c) EIS curves of BNCS-CV-5, BNCS-CV-10 and BNCS-CV-20 electrodes;(d) CV curves at 10 mV·s−1, (e) GC curves at 1 A·g−1 and (f) EIS curves of BNCS-CP-10, BNCS-CP-30 and BNCS-CB-10*3 electrodes.
首先使用三电极体系考察循环伏安氧化方法不同氧化扫速下制备的氧化电极的电化学性能,结果如图3a-c 所示。CV 曲线(图3a)表明,不同氧化扫速下制备的氧化电极均显示出明显的氧化还原峰,表明电化学氧化过程能够有效引入氧化还原赝电容。不同氧化扫速制备的循环伏安氧化电极中,BNCS-CV-10 表现出了最大的CV 积分面积和最长的充放电时间,表明其具有最佳的比电容性能。通过GC 曲线(图3b)计算可知,BNCS-CV-10 电极在1 A·g−1下显示出601.5 F·g−1的高比电容,这可能归因于在10 mV·s−1的氧化扫速下制备的氧化电极具有适中的氧化程度,氧化还原赝电容得以充分发挥。为探究电化学氧化过程对于电极动力学的影响,采用电化学阻抗谱(图3c)对氧化电极进行了分析。如图3c 所示,氧化电极的阻抗谱呈现出超电电极材料典型半圆弧与倾斜直线的组合形状,其中半圆弧与x轴的截距表示电极的等效串联电阻Rs,而半圆弧的直径则表示电极界面反应的电荷转移阻抗Rct,倾斜直线的斜率则代表电解质离子的扩散速率。得益于B、N 掺杂对于电极本征导电性能的改善,EIS 谱中不同扫速下制备的氧化电极内阻Rs基本保持不变(0.2 Ω)。但氧化电极的电荷转移阻抗Rct随氧化扫速降低而增加,表明过低的氧化扫速会显著降低氧化电极的反应动力学。适宜的氧化扫速不仅有助于电化学氧化的充分进行,提升氧化还原赝电容,同时也避免低扫速下长时间氧化对于炭电极导电性能的严重破坏,维持了快速的电子传导和电荷转移,从而促进氧化电极赝电容的高效发挥。综合而言,10 mV·s−1的适中氧化扫速下制备的BNCS-CV-10 电极具有最优的性能表现。
恒压氧化不同时间制备的氧化电极的电化学性能如图3d-f 所示。如图3d-e 所示,BNCSCP-10 电极与BNCS-CP-30 电极的CV 曲线和GC 曲线几乎重合,即两者氧化还原赝电容接近,在1 A·g−1下的比电容分别为378.8 F·g−1和369.9 F·g−1。结合电极的恒压氧化曲线可以得出,恒压氧化过程使炭电极的氧化在一定的时间后接近饱和。此外,氧化更长时间的BNCS-CP-30电极电荷转移阻抗明显增加(图3f),说明在后续的恒压氧化过程中仅发生炭电极表面含氧官能团持续的生成和分解,随氧化时间增加氧化电极的比电容未进一步提升,并且其导电性能和反应动力学持续降低。由于恒压氧化下电极的氧化快速达到饱和,氧化深度有限,恒压氧化方法制备的氧化电极比电容普遍偏低。
为探究恒压氧化与循环伏安氧化在炭电极氧化过程中的差异,在高电位连续恒压氧化之间添加低电位循环伏安扫描过程,得到的BNCSCB-10*3 电极的电化学性能也显示于图3d-f。该氧化电极在1 A·g−1下的比电容可达到539 F·g−1,接近循环伏安氧化方法制备的氧化电极比电容。证明了低电位还原过程可以促进后续的高电位氧化过程的深入,进而大幅提升氧化电极的氧化还原赝电容,因此循环伏安氧化相较于恒压氧化在提升电极氧化深度上具有显著的优势。但长时间的高电位恒压氧化也影响了BNCS-CB-10*3 电极的电子传递和电荷转移,其电荷转移阻抗Rct大幅增加(图3f)。
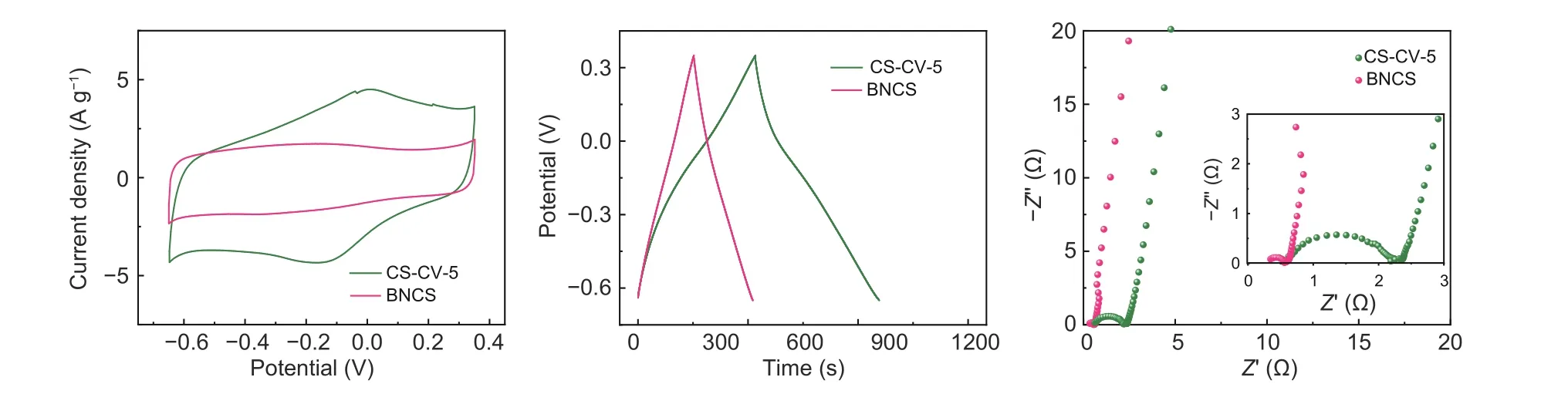
图 4 CS-CV-5 氧化电极和BNCS 电极在三电极体系下1 mol L−1 H2SO4 中的电化学测试:(a) 10 mV·s−1 的CV 曲线;(b) 1 A·g−1 下的GC 曲线;(c) 电化学阻抗谱;Fig. 4 Electrochemical evaluation of CS-CV-5 and BNCS electrodes measured in a three-electrode system in 1 mol L−1 H2SO4:(a) CV curves at 10 mV·s−1, (b) GC curves at 1 A·g−1, (c) EIS curves.
未氧化的BNCS 电极的电化学性能如图4所示。不同于氧化电极,BNCS 电极呈现出典型的矩形CV 形状和对称三角形的GC 曲线(图4a-b),表明其为典型的双电层电容材料。由GC 曲线计算可知,BNCS 电极在1 A·g−1下的比电容仅为160 F·g−1,也证明了电化学氧化引入的氧化还原赝电容对于电极比电容的大幅提升。此外,EIS 曲线(图4c)表明BNCS 电极的内阻Rs约为0.2 Ω,与氧化BNCS 电极接近,证明BNCS 电极在电化学氧化过程中内阻基本保持不变,这归因于B、N 掺杂提供的额外电子和导电空穴对于氧化电极导电性能的提升。
为验证B、N 掺杂的作用,实验测定了循环伏安氧化CS 电极的电化学性能,结果如图4 所示。CV 曲线(图4a)表明无B、N 掺杂的CS 氧化电极的CV 积分面积明显减小。由GC 曲线计算可知其在1 A·g−1下的比电容为337.4 F·g−1(图4b),表明B、N 掺杂对于电极电化学氧化效果的明显提升。B、N 掺杂位点的引入不仅提高了碳骨架的缺陷密度,同时也影响了碳骨架上的电荷密度均匀分布,有利于水分解过程中产生的强氧化性含氧中间体进攻碳骨架,从而显著提高氧化电极的氧化还原赝电容。此外,由阻抗谱(图4c)可知,相较于BNCS-CV-5 电极,CS-CV-5电极的内阻Rs和电荷转移阻抗Rct相较于相同氧化条件下的BNCS-CV-5 均有明显的增加,分别为0.6 Ω 和1.7 Ω。说明B、N 的掺杂可以有效改善电极材料的电子传递和电荷转移,不仅提高了氧化电极的本征导电性能,并且也有效促进电极的反应动力学。
3.4 氧化电极的表面化学分析
为明确BNCS 氧化电极高比电容的来源,对其进行了组成结构的表征分析。如图5a 所示,电极的FTIR 图谱中出现4 个含氧官能团相关特征峰,依次为C=O 键(1 720 cm−1)、C―OH 键(1 480 cm−1)、C―O―C 键(1 390 cm−1)和C―O 键(1 190 cm−1)。在电化学氧化后,含氧官能团相关的红外特征峰强度增加,尤其循环伏安氧化电极的增幅更为明显,初步证实了电化学氧化过程中含氧官能团的引入。元素分析(表1)也得到了相似结论,未氧化的BNCS 电极氧含量为7.4%(质量百分数),而氧化后的电极氧含量均有不同程度的提升。其中BNCS-CV-10 电极氧质量百分数相较于BNCS-CP-30 电极提升幅度更大,达到14.9%(vs.12.6%),表明循环伏安氧化方法更有利于电极总氧含量的提高,与循环伏安氧化方法制备的氧化电极具有更高的比电容一致。
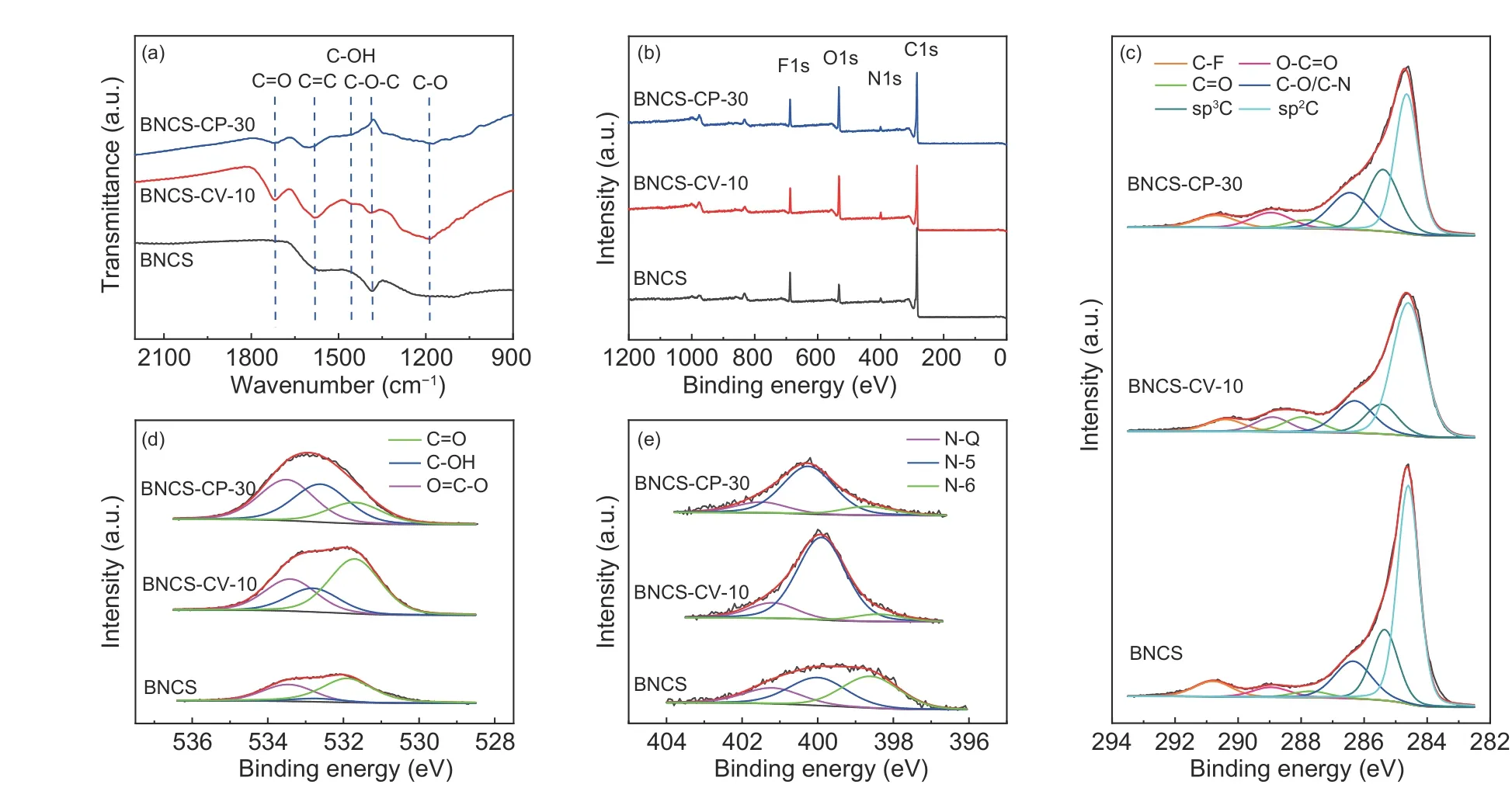
图 5 BNCS、BNCS-CV-10 和BNCS-CP-30 的(a) FTIR、(b) XPS 全谱和XPS (c) C 1s、(d) O 1s、(e) N 1s 分峰拟合图谱Fig. 5 (a) FTIR spectra, (b) XPS spectra, as well as high-resolution XPS spectra of (c) C 1s, (d) O 1s and(e) N 1s of the BNCS-5, AC-2-5-5, AC-2-20-5 and AC electrodes.
通过XPS 分析氧化电极表面的元素组成和价态,如图5b 所示。BNCS 电极中含有C、B、N、O、F 元素,其中B、N 的原子百分比分别为1.45%和3.41%,证实了B、N 元素在BNCS 电极材料中的掺杂,而F 元素则来源于电极材料表面涂覆的PVDF 粘结剂。氧化后的BNCS 电极表面氧含量相较于未氧化电极同样大幅度增加,并且XPS 结果中氧化电极的氧含量增幅高于元素分析结果,表明电极的氧化是由表面向内部逐渐进行的。值得注意的是,氧化电极中B 的含量有一定减少,这可能归因于BNCS 电极在电化学氧化过程中部分B 原子被氧化生成B2O3并溶解于电解液中。
进一步对C 1s 峰、O 1s 峰和N 1s 峰进行分峰拟合,确定官能团组分变化,结果如图5c-e 和表2所示。电极的C 1s 峰显示出6 个特征峰,分别对应于C―F(290.5 eV)、―COOH(289 eV)、C=O(287.8 eV)、C―O/C―N(286.4 eV)、sp3C(285.4 eV)和sp2C(284.6 eV)。相较于未氧化的BNCS 电极,氧化电极的sp2C 峰强度明显降低,同时氧官能团相关特征峰强度显著增加,表明在氧化过程中电极官能化程度的提升。由表2中的分峰拟合数据可知,在电化学氧化后,BNCSCV-10 电极的C=O 基团含量从2.7%大幅提升至7.4%(vs. BNCS-CP-30 电极4.2%),说明其为循环伏安氧化引入的主导基团。而BNCS-CP-30 电极的―COOH 基团含量则由3.8% 大幅提升至7.6%(vs. BNCS-CV-10 电极6.6%)。表明循环伏安氧化更有利于醌基官能团的选择性生成,而恒压氧化则更倾向于形成会剧烈破坏电极导电碳骨架的―COOH 基团。此外,对电极的O 1s 峰的分峰拟合也显示出相似的结果。电极O 1s 峰的3 个特征峰分别对应于―COOH(533.4 eV)、C―OH(532.8 eV)和C=O(531.8 eV)基团,其中BNCS-CV-10 电极显示出以C=O 主导的含氧官能团组分,其相对含量达到49.6%;而BNCS-CP-3 0 电极的C =O 相对含量仅为2 0.1%,且―COOH 的相对含量达到了40.9%。再次证明了循环伏安氧化可以实现电极含氧官能团种类的优化,选择性地生成具有高电化学活性和快速反应动力学的醌基基团,从而实现了高比电容和良好的动力学。

表 1 BNCS、BNCS-CV-10 和BNCS-CP-30 电极元素分析与XPS 表征测定的元素含量Table 1 Elemental contents of the BNCS, BNCS-CV-10 and BNCS-CP-30 electrodes obtained by elemental analysis and XPS.
电极的N 1s 峰则显示出分别位于401.2 eV、400.0 eV 和398.6 eV 的三个峰,对应于石墨氮(NQ)、吡咯氮(N-5)和吡啶氮(N-6)。其中石墨氮可以促进氧化电极的电子迁移,吡啶氮和吡咯氮则可以作为发生氧化还原反应的活性位点,提供部分赝电容。在电化学氧化前后,电极中的总氮含量变化不明显,但吡啶氮含量大幅下降而吡咯氮含量明显提升。这表明电极在电化学氧化过程中存在吡啶氮结构向吡咯氮结构的转变,这可能与吡啶氮位点上六元环结构的断裂与重连有关。
3.5 氧化电极的倍率性能和稳定性测试
超级电容器电极材料对高功率密度和长循环寿命具有较高的要求,因此进一步在三电极体系下测试了BNCS-CV-10 氧化电极倍率性能及长循环稳定性。结果表明BNCS-CV-10 电极显示出良好的倍率性能,在20 A·g−1的高电流密度下依然保持了450 F·g−1的高比电容,为1 A·g−1电流密度下比电容的74.8%(图6a)。这可以归因于循环伏安氧化过程中氧化电极导电碳骨架的良好保持和引入的醌基活性基团快速的动力学,并且B、N 掺杂对于电极材料导电性能的提升也改善了电子传输和电荷转移。此外,采用恒流充放电法测试氧化电极的长循环性能,结果如图6b 所示。BNCS-CV-10 电极在5 A·g−1的电流密度下循环8 000 次后保持了初始容量的92.6%。这种优良的循环稳定性可以归因于循环伏安氧化中低电位区间的部分还原过程可以提高氧化电极中氧物种的稳定性。
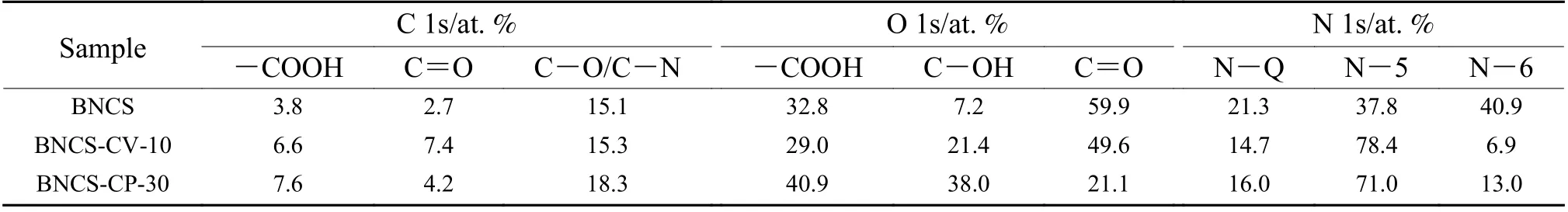
表 2 BNCS、BNCS-CV-10 和BNCS-CP-30 电极C 1s、O 1s、N 1s 分峰拟合结果中各类官能团相对含量Table 2 The relative contents of functional groups of the BNCS, BNCS-CV-10 and BNCS-CP-30 electrodes calculated by the XPS C 1s, O 1s, N 1s fitting peak area.
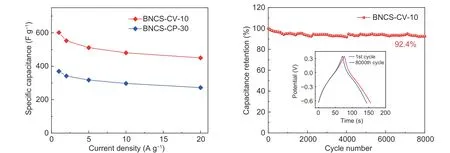
图 6 氧化电极在三电极体系下1 mol L−1 H2SO4 中的倍率与循环测试:(a) BNCS-CV-10 和BNCS-CP-30 电极0.5~20 A·g−1 下的倍率性能测试;(b) BNCS-CV-10 电极在5 A·g−1 下的循环稳定性测试Fig. 6 Rate and cycling tests of oxidized electrodes measured in a three-electrode system in 1 mol L−1 H2SO4:(a) Rate performances of BNCS-CV-10 and BNCS-CP-30 electrodes from 0.5 to 20 A·g−1. (b) Cycling performance of BNCS-CV-10 electrode at 5 A·g−1.
4 结论
采用电化学氧化法在B、N 掺杂炭电极上原位引入电化学活性的含氧官能团,得到具有高比电容的富氧炭基超电电极材料。材料的二维片层结构和丰富微孔比表为电极反应提供了快速的离子传输和充足的反应相界面。而丰富的B、N 掺杂不仅促进了电极在电化学氧化中含氧官能团的高效引入,并且有利于氧化电极保持快速的电子传导和电荷转移,提高反应动力学。此外,相较于持续高电位恒压氧化,循环伏安氧化方法反复的氧化与还原过程被证明有助于提升电极的氧化深度,促进氧化电极总氧含量的提高。更重要的是,循环伏安氧化能够优化引入的含氧官能团种类,选择性地生成以活性醌基基团主导的氧组分。由于良好保持的导电性能和引入的大量高电化学活性醌基官能团,氧化电极在1 A·g−1下显示出601.5 F·g−1的高比电容,并在20 A·g−1的高电流密度下保持了450 F·g−1。同时由于循环伏安氧化方法对于含氧官能团稳定性的提升,氧化电极在5 A·g−1下循环8 000 次保持了初始比电容的92.6%。
致谢
感谢国家自然科学基金(222075038,21875028);辽宁省兴辽英才计划(XLYC1902045).
- 新型炭材料的其它文章
- 基于碳化钽涂层改性碳基材料的研究进展
- Two-dimensional layer materials for highly efficient molecular sensing based on surface-enhanced Raman scattering
- Coating a Na3V2(PO4)3 cathode material with carbon to improve its sodium storage
- Preparation of a N-P co-doped waste cotton fabric-based activated carbon for supercapacitor electrodes
- High-surface-area porous carbons produced by the mild KOH activation of a chitosan hydrochar and their CO2 capture
- Preparation of a porous carbon from Enteromorpha prolifera with excellent electrochemical properties

