甘草幼苗响应干旱胁迫的光合、抗氧化特性及转录组分析
关思静,王 楠,徐蓉蓉,葛甜甜,高 静,彭 亮,张 岗,陈 莹
(1. 陕西中医药大学药学院 / 陕西省秦岭中草药应用开发工程技术研究中心, 陕西 咸阳 712046;2. 陕西中医药大学 / 陕西中药资源产业化省部共建协同创新中心, 陕西 咸阳 712083)
乌拉尔甘草(Glycyrrhiza uralensis)为豆科多年生草本植物,其根及根茎富含黄酮类、三萜类以及多糖等活性物质,具有抗炎、抗癌、抗病毒、抗氧化等药理作用,是一种常用的中草药[1-2]。甘草不仅具有较高的药用价值,而且具有很强的固沙能力,是西北干旱地区重要的植物资源[3]。但是,近年来随着人们对甘草需求的日益增长,导致其野生资源逐渐枯竭,人工栽培成为解决甘草资源危机的可能途径之一。然而有研究表明,人工栽培甘草其抗逆性低于野生甘草[4],且质量参差不齐。因此,提高甘草抗旱性及品质是目前甘草种植产业亟待解决的问题。
干旱是一种外界的逆境胁迫,已经成为药用植物生产力的主要限制因素之一。干旱胁迫会导致植物体内活性氧(reactive oxygen species, ROS)的积累,引起膜脂的广泛过氧化和去酯化,并使蛋白质变性和核酸突变[5]。在生物进化过程中,植物形成了一套减少或消除ROS 的保护酶系统,包括过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxide, POD)等[6]。研究表明,植物遭受干旱胁迫时还会提高抗氧化酶基因的转录水平,如小麦(Triticum aestivum)根系中ROS 代谢相关基因谷胱甘肽过氧化物酶(glutathione peroxidase 7, GPX7)、抗坏血酸过氧化物酶3 (ascorbate peroxidase 3,APX3)、谷胱甘肽S -转移酶(glutathione transferases 8, GST8和Glutathione S-transferase 18,GST18)和GSTU11(Glutathione S-transferase 11)在干旱胁迫下均显著上调[7]。
土壤干旱会导致植物根部产生脱落酸(abscisic acid, ABA),根源信号ABA 到达叶片,进而促进气孔关闭,减少CO2的进入,抑制光合作用[8]。除此之外,干旱胁迫也能通过叶绿素降解、光化学系统损坏等造成光合速率下降[9]。Gleason 等[10]在研究玉米(Zea mays)对干旱胁迫的反应时发现,其光合特性、水力传导以及气孔导度(stomatal conductance, Gs)均大幅降低。雷蕾和张彦妮[11]研究发现,干旱胁迫降低了黄连花(Lysimachia davurica)的净光合速率(net photosynthetic rate, Pn)、蒸腾速率(transpiration rate, Tr)和Gs,同时提高了胞间CO2浓度(intercellular CO2concentration, Ci)。
植物适应逆境胁迫的响应包含形态、生理生化和分子上的改变,这些改变又是众多基因表达改变而引起的。参与抗旱的重要基因一般分为两大类:功能基因和调节基因,前者编码重要的代谢蛋白和酶,直接保护植物细胞免受干旱胁迫的侵害;后者则编码调控蛋白,如转录因子、蛋白激酶等,这些蛋白主要在胁迫响应中进行信号转导和综合调控下游应答基因[12]。值得注意的是,其中转录因子可以通过ABA 依赖/独立的途径被激活,参与调控下游基因的转录表达,在植物抵御干旱胁迫中扮演着重要角色[13]。随着高通量测序技术的不断发展,研究药用植物在转录组水平上与抗旱性相关的特定基因表达和分子机制已十分普遍。如李铂等[14]研究结果表明,以聚乙二醇(polyethylene glycol, PEG)模拟干旱胁迫下半夏(Pinellia ternata)茎中编码植物激素与信号转导、氧化还原相关酶等基因表达水平显著上升;李晓艳等[15]利用转录组数据揭示了在适度干旱胁迫下,bHLH (basic-helix-loop-helix)、bZIP(basic leucine zipper)、MYB (v-myb avian myeloblastosis viral oncogene homolog)、WRKY 类转录因子在丹参(Salvia miltiorrhiza)根和叶中差异表达均显著,且可能参与调控萜类基因的表达,这为研究中药材对环境胁迫的应答机制提供了丰富的基因信息。本研究旨在对干旱胁迫下甘草光合生理、抗氧化酶活性的变化进行分析,并利用转录组高通量测序方法,分析干旱胁迫对甘草不同部位基因表达的调控特征,以期为进一步筛选抗旱相关基因、提高甘草干旱胁迫耐受性奠定基础。
1 材料与方法
1.1 试验材料及处理条件
乌拉尔甘草种子购自峰华农业有限公司。挑选健康饱满的种子浸泡在体积比为1 ꞉ 3 的30%过氧化氢 ꞉ 纯净水溶液中消毒30 min,洗净后,放入铺有两层滤纸的培养皿中,适量加水后于25 ℃恒温气候箱中进行催芽萌发。待子叶完全展开,挑选生长一致的幼苗移至塑料水培盆中,以纯净水浇灌幼苗培养24 h,更换后采用Hoagland 全营养液水培4 周。随后处理组用Hoagland 全营养液配制15%聚乙二醇(polyethylene glycol 6000, PEG-6000)溶液模拟干旱胁迫[16],以不加PEG-6000 的Hoagland 全营养液培养的幼苗为对照组。处理时间均为7 d。各处理设3 次生物学重复。
1.2 生理指标测定方法
分别于胁迫处理0 (CK)、1、3、5、7 d 时,选取各处理植株完全展开叶用CIRAS-3 光合仪测定叶片Pn、Gs、Tr、Ci4 项光合作用参数,设定叶室面积1.7 cm2,光强[1 200 μmol∙(m2∙s)−1];相对叶绿素(soil and plant analyzer develotrnent, SPAD)值采用TYS-3N 型植物营养测定仪测定;SOD、POD、CAT 活性分别采用氮蓝四唑(nitroblue tetrazolium, NBT)光还原法、愈创木酚-分光光度法和紫外吸收法测定[17]。测定结束后,取剩余幼苗地上和地下部分用液氮速冻于− 80 ℃冰箱中。
1.3 转录组测序分析
将保存于-80 ℃冰箱中的幼苗样本做好标记,委托杭州景杰生物科技有限公司利用Illumina HiSeq 2000 测序平台进行转录组高通量测序分析。去除原始数据中含有接头和低质量的序列,并根据碱基质量值进行修剪,得到clean reads。与甘草参考基因组进行比对后,使用RPKM (Reads Per Kilobase per Million mapped reads)法对reads counts 进行均一化处理,进而评估基因的表达量。差异表达基因(differentially expressed genes, DEGs)的筛选标准为P< 0.05、|log2FC| > 1。同时对筛选得到的DEGs 进行基因本体(gene ontology, GO)功能注释和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)代谢途径分析。利用美国国家生物技术信息中心(National Coalition Building Institute,NCBI)网站Blastp 在线工具,对差异表达倍数最高的前10 个DEGs 进行比对分析,并根据结果进行功能注释。
1.4 转录调控网络预测分析
根据基因注释信息,分别从甘草地上和地下部分的DEGs 中筛选出次级代谢产物合成相关基因,并利用植物转录调控预测网站(http://plantregmap.cbi.pku.edu.cn/)鉴定DEGs 中潜在的转录因子,对鉴定的转录因子与次级代谢相关基因的转录调控关系进行预测。
1.5 数据处理
使用Excel 2013 进行数据统计与整理,利用SPSS 21 对生理指标进行方差分析和显著性检验,并使用Origin 2017 绘图,采用Cytoscape 3.7.1 软件绘制转录调控网络图。
2 结果与分析
2.1 干旱胁迫对甘草光合生理特性的影响
2.1.1 光合参数变化
正常供水条件下,甘草的Pn为9.55 μmol∙(m2∙s)−1,随着干旱胁迫时间的延长,甘草的Pn呈持续降低趋势,胁迫处理7 d 时降到最低[0.56 μmol∙(m2∙s)−1],显著低于其他处理时间(P< 0.05) (图1)。甘草的Ci变化波动较大,在干旱胁迫1 d 时,降到最低(208.38 μmol∙mol−1),至干旱胁迫7 d 时,Ci上升并达到最大(304.00 μmol∙mol−1)。甘草的Gs在处理7 d 时降到最低,显著低于其他处理时间,仅为正常供水组的10%。甘草的Tr变化趋势同Gs相一致,在处理结束时降至最低[0.28 mmol∙(m2∙s)−1]。

图1 干旱胁迫对甘草光合参数的影响Figure 1 Effects of drought stress on the photosynthetic parameters of Glycyrrhiza uralensis
2.1.2 相对叶绿素含量变化
甘草SPAD 值在干旱胁迫1 d 时显著上升(P<0.05),达到最大(39.72),之后趋于平稳,干旱胁迫1、3、5 d 时,各处理间无显著差异(P> 0.05),至干旱胁迫第7 天时显著下降至36.58 (图2);各胁迫处理均显著大于正常供水对照。

图2 干旱胁迫对甘草相对叶绿素含量的影响Figure 2 Effects of drought stress on the relative chlorophyll content of Glycyrrhiza uralensis
2.2 干旱胁迫对甘草叶片和根中CAT、POD、SOD 活性的影响
干旱胁迫1 d 时,甘草叶片中CAT 活性显著上升并达到最大(P< 0.05),胁迫3 d 时降低,但之后随胁迫时间延长呈逐步升高的趋势;根中的CAT 活性在干旱胁迫1 d 时显著下降至最低,之后呈现先上升后下降的趋势,在干旱胁迫7 d 时CAT 活性降低,但与正常供水对照相比无显著差异(P> 0.05)(图3)。甘草叶片中的POD 活性在干旱胁迫1 d 时下降至最低值,之后随着胁迫时间的延长总体呈现逐步升高的趋势,并在干旱胁迫7 d 时达到最高;根中POD 活性在干旱胁迫7 d 时显著高于正常供水对照(P< 0.05),但与干旱胁迫1、5 d 之间无显著差异(P> 0.05)。甘草叶片中SOD 活性变化平稳,总体呈上升趋势,在处理3 和7 d 时SOD 活性显著高于正常供水对照(P< 0.05);根中SOD 活性总体呈现先上升后下降的趋势,但与正常供水对照相比,处理1、3、5 d 之间的SOD 活性并无显著差异(P> 0.05),至干旱胁迫7 d 时显著下降(P< 0.05),为正常供水对照的42.49%。

图3 干旱胁迫对甘草叶片和根中抗氧化酶活性的影响Figure 3 Effects of drought stress on antioxidant enzyme activities in the leaves and roots of Glycyrrhiza uralensis
2.3 转录组测序结果
2.3.1 测序质量结果
将对照组和干旱胁迫处理组甘草地上部分、地下部分进行转录组测序,每个样本设置3 次重复,获得地上部分3 组对照组的平均clean reads 为43 119 552,Q20大于98.00%,Q30大于95.00%,GC 碱基比例大于45.00%;干旱胁迫组的平均clean reads 为45 638 526,3 组重复处理的Q20大于98.00%,Q30大于94.00%,GC 碱基比例大于46.00%。地下部分3 组对照组的平均clean reads 为43 037 220,Q20大于98.00%,Q30大于94.00%,GC 碱基比例大于46.00%;干旱胁迫组的平均clean reads 为42 059 404,3 组重复处理的Q20大于98.00%,Q30大于94.00%,GC 碱基比例大于47.00%。样本的测序数据Q30满足标准,同时GC 含量接近,可以进行后续生物信息分析。
2.3.2 地上部分和地下部分DEGs 表达分析
以|log2FC| > 1、P< 0.05 为DEGs 的筛选标准,与对照组相比,干旱胁迫下甘草地上部分共检测出7 500 个DEGs,其中上调表达基因数量3 649 个(48.65%),下调表达基因3 851 个(51.35%) (图4A)。甘草地下部分共检测出5 298 个DEGs,其中上调表达基因3 087 个(58.27%),下调表达基因2 211 个(41.73%) (图4B)。分别有5 258 (49.81%)和3 056 个(28.95%) DEGs 是甘草地上和地下部分特异性表达的,2 242 个(21.24%) DEGs 是二者共有差异表达的(图5)。在这2 242 个DEGs 中,共诱导表达283 个(12.62%),抑制表达407 个(18.15%),在地上部分和地下部分相反表达1 552 个(69.22%)。

图4 干旱胁迫下甘草地上部分(A)和地下部分(B)差异表达基因火山图Figure 4 Volcanic diagram of differentially expressed genes (DEGs) in aboveground part (A) and underground part (B) of Glycyrrhiza uralensis under drought stress

图5 差异表达基因韦恩图Figure 5 Venn diagram of differentially expressed genes (DEGs)
2.3.3 差异表达基因的GO 分类和显著性富集分析
为探究干旱胁迫下甘草响应基因的功能,对转录组数据进行GO 功能富集分析,发现甘草地上和地下部分分别有6 008 和4 117 个DEGs 在GO 数据库中得到注释,其中地上部分的DEGs 分布于生物过程、细胞组分、分子功能三大类的52 个亚类中,地下部分的DEGs 分布于三大类的50 个亚类中。地上和地下两部分的DEGs 在三大类的分布基本一致,均被显著富集到细胞过程、代谢过程、单一生物过程、刺激响应、细胞、细胞部分、细胞器、膜、结合、催化活性、转导活性等类别(图6)。
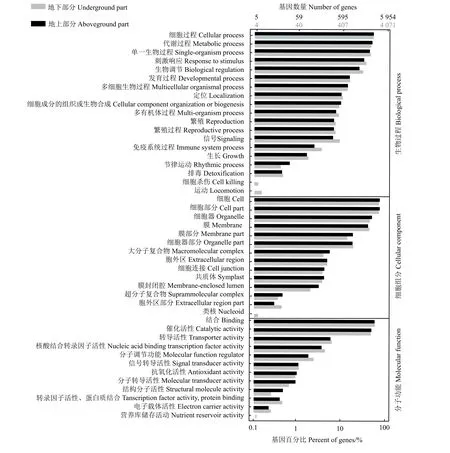
图6 差异表达基因基因本体富集分析Figure 6 Gene ontology (GO) enrichment analysis of the differentially expressed genes (DEGs)
通过Blastp 筛选出上调和下调基因中表达显著的DEGs (表1),比对分析发现甘草地上部分参与干旱胁迫应答的基因主要有具有SOD 活性的胚样蛋白(可能的)基因(Glyur000570s00022984)、在植物防御反应中产生最多的蛋白之一致病相关蛋白1 基因(Glyur000270s00013309)、具有氧化还原活性的小檗碱桥酶8 基因(Glyur000005s00001103)、非生物胁迫反应相关的FAR1 相关序列(Glyur000132s00015956)和UPF0481 蛋白相关基因(Glyur000936s00037090)、与植物激素和次生代谢具有密切关系的UDP-糖基转移酶88B1 基因(Glyur001034s00029013)以及控制胞浆离子浓度的阳离子/ H + 反向转运蛋白基因(Glyur000160s00019165)等。地下部分参与干旱胁迫应答的基因主要是增强蛋白质多样性的U1 小核核糖核蛋白A 基因(Glyur002700s00036100)、调节细胞分裂分化的ADP-核糖聚合酶基因RCD1(Glyur000341 s00020158)、能够在细胞表面识别病原体和激活细胞内防御信号的抗病蛋白RPP8基因(Glyur005334s00 043878)、调节茉莉酸激素信号的细胞色素P450 94B3基因(Glyur001736s00033407)以及控制植物生长发育过程的同源基因SBH1(Glyur000259s00016757)等。

表1 样品中差异倍数前10 名基因Table 1 Top 10 genes with multi-fold differentiation in the specimens
2.3.4 差异表达基因的KEGG 途径富集分析
为研究参与干旱胁迫响应的DEGs 生物学行为,对其进行了KEGG 代谢途径分析,将P≤0.05 的通路定义为DEGs 显著富集的通路。地上部分共有2 094 个DEGs 注释到KEGG 代谢途径中,其中最显著富集的通路为转运蛋白(transporters),共有196 个DEGs,上调117 个,下调79 个;其次为转录因子(transcription factors),共有139 个DEGs,上调68 个,下调71 个;再次为蛋白激酶(protein kinases),共有83 个DEGs,上调17 个,下调66 个(表2)。其他通路主要涉及生物合成,如苯丙烷类生物合成(phenylpropanoid biosynthesis)、类黄酮生物合成(flavonoid biosynthesis)等;代谢途径如淀粉和蔗糖代谢(starch and sucrose metabolism)、牛磺酸和亚牛磺酸代谢(taurine and hypotaurine metabolism)。甘草地下部分共385 个DEGs 注释到KEGG 代谢途径中,其中最富集通路为转录因子,共124 个DEGs,上调表达80 个,下调表达44 个;其次为蛋白激酶,共57 个DEGs,上调表达47 个,下调表达10 个;再次为植物激素信号转导(plant hormone signal transduction,上调表达32 个,下调表达23个。其余代谢途径包括甘草根中有效成分相关的代谢途径苯丙烷类生物合成以及二萜类生物合成(diterpenoid biosynthesis)。进一步分析相关代谢途径之后发现保护酶系统重要成分谷胱甘肽代谢酶、过氧化物酶、抗坏血酸氧化酶相关基因在甘草地上、地下部分均有显著响应,其中尤以谷胱甘肽代谢酶为主,分别有6 和8 个相关DEGs 在干旱胁迫下显著上调。

表2 差异表达基因显著富集的京都基因与基因组百科全书代谢途径Table 2 Significantly enriched Kyoto encyclopedia of genes and genomes (KEGG) pathways of differentially expressed genes (DEGs)
2.3.5 干旱胁迫对甘草次级代谢相关基因表达的影响
对甘草转录组中的DEGs 分析发现,干旱胁迫影响了甘草萜类、黄酮类等次级代谢产物合成途径中相关基因的表达(表3)。包括萜类生物合成的关键酶1-脱氧-D-木酮糖-5-磷酸合酶、1-脱氧-D-葡萄糖-5-磷酶还原异构酶、11-氧-β-淀粉酶30 氧化酶;黄酮类生物合成限速酶查尔酮合酶、查尔酮异构酶等。相关基因在地上部分上调表达28,下调表达17 个,在地下部分上调表达15 个,下调表达6 个,表明适度干旱胁迫促进了甘草次级代谢途径基因的表达。

表3 甘草中受干旱胁迫调控的次级代谢相关基因Table 3 Secondary metabolism-related genes regulated by drought stress in Glycyrrhiza uralensis
2.3.6 干旱胁迫下转录调控网络分析
转录因子在植物响应逆境胁迫中扮演着重要角色。在转录组数据中,地上和地下部分总共有264和226 个DEGs 被鉴定为转录因子,并分别属于32和34 个转录因子家族。两个组织部位中差异表达较多的转录因子类型主要是ERF (ethylene responsive transcription factors)、bHLH、C2H2 (C2H2-zinc-finger protein transcription factor)、Dof (DNA binding with one finger)、bZIP (basic leucine zipper)、MYB_related 等,其中ERF 的DEGs 数目最多(图7)。地上部分WRKY、NAC (NAM/ATAF/CUC)、 TCP (teosinte branched I/Cycloidea/proliferating cell factor)等DEGs 的数量几乎是地下部分的2 倍,地下部分中bHLH、MYB_related以及LBD (lateral organ boundaries domain)的DEGs 数目高于地上部分。在地上和地下部分中,有95 个共同差异表达的基因被鉴定为转录因子,分别有169和131 个特异性表达的转录因子,如EIL (ethylene insensitive3-like)、VOZ (vascular plant one-zinc-finger)、BES1 (BRI1-ethylmethylsulfone-suppressor 1)等在地上部分特异性表达,而在地下部分特异性表达的转录因子有RAV (related to ABI3/VP1)、WOX (WUSCHELrelated homeobox)以及SRS (SHI-related sequence)等。

图7 干旱胁迫下差异表达转录因子Figure 7 Differentially expressed transcription factors in Glycyrrhiza uralensis under drought stress
利用转录调控关系预测网站,对甘草次级代谢产物合成相关基因与差异表达转录因子之间的调控关系进行了预测分析,结果发现地上和地下部分分别有19 和14 个差异表达的转录因子与次级代谢产物合成相关基因存在共表达网络。根据转录因子家族分类,地上部分包括ERF(AT5G25390、AT2G 40340、AT5G67190、AT3G23240)、TCP (AT3G47620、AT1G53230、AT3G02150 )、MYB (AT1G79180、AT4G 38620、AT5G14340)、bHLH (AT2G22750)、bZIP (AT3G 30530)、NAC (AT1G71930)等转录因子(图8A)。地下部分则是MYB (AT5G10280、AT5G08520、AT4G 38620)、C2H2 (AT5G04390)、TCP (AT3G47620、AT5G 51910)、bZIP (AT3G30530、AT3G62420)、WRKY (AT5G 52830、AT5G13080)等转录因子(图8B)。

图8 甘草地上部分(A)和地下部分(B)次级代谢途径相关基因的转录调控网络Figure 8 Transcriptional regulatory network of genes related to secondary metabolic pathway in the aboveground part (A) and underground part (B) of Glycyrrhiza uralensis
3 讨论与结论
干旱胁迫会抑制植物光合作用的进行,严重影响植株的正常生长发育。几乎所有的植物在遭受干旱胁迫时的第一反应都是关闭气孔以防止水分蒸发[18]。有研究认为,由于气孔的关闭和叶肉细胞光合能力的降低,导致干旱胁迫下大豆(Glycine max)的Pn、Gs降低,Ci升高[19]。经转录组分析发现9-顺式环氧类胡萝卜素双加氧酶(NCED)基因在地上部分显著上调,有研究表明NCED基因受干旱胁迫诱导,在过表达的转基因植物中会上调内源ABA 水平[20]。ABA 在植物抵御干旱胁迫的机制中作为一种化学信号,通过诱导气孔关闭从而保存水分。此外,干旱胁迫下叶片的衰老加速了光合色素的降解,这也导致了Pn的下降[13]。在本研究中观察到SPAD 值在不同干旱胁迫时间下呈现先上升后下降的趋势,干旱胁迫初期SPAD 值的增加可能是由于植物生长速率降低引起的集中效应[21],随着胁迫持续时间的延长最终导致SPAD 值下降。以上结果表明,甘草Pn下降可能是由于气孔关闭以及叶绿素含量的降低共同导致的。
光合能力的下降可能会降低光合电子的传递速率,这有利于电子流向分子氧,从而导致植物产生超氧自由基,打破植物体内ROS 的平衡[21]。干旱等非生物胁迫破坏植物细胞的代谢平衡,导致ROS 的含量增高,植物可以感知和评估体内ROS 的水平,并调控相应的基因表达,使ROS 和保护酶活性之间存在动态平衡以响应干旱胁迫。转录组分析结果显示,干旱胁迫对甘草地上和地下部分的多种保护酶基因均具有双向调控作用,尤以谷胱甘肽代谢酶相关DEGs 表达最为显著。谷胱甘肽代谢酶不仅是一种重要的ROS 清除剂,还发挥各种内源和外源物质的解毒作用[7,22]。本研究中也观察到干旱胁迫结束时,甘草叶片中SOD 活性显著增加,而根中CAT 活性无显著差异,POD 活性显著上升,SOD活性显著降低。CAT 和POD 是清除H2O2分子的主要酶类[23]。CAT 主要负责分解H2O2,并与SOD 协同清除超氧自由基,而POD 则具有双重作用,在清除H2O2的同时,将初期的过氧化物氧化为丙二醛,以便于保护酶将其彻底清除[24]。甘草叶片和根中3 种保护酶对水分亏缺的响应不一致,表明在植物不同器官中,起保护作用的酶可能不同,不同器官对同一胁迫的反应也有差异。
众多研究表明,转录组测序技术能从mRNA 水平全面地反映物种基因功能及特定的生物学过程,利用转录组测序技术研究干旱胁迫下植物的基因表达水平,有利于揭示植物的抗旱应答机理[25]。本研究对干旱胁迫下甘草地上和地下部分转录组进行了测序和DEGs 表达分析,结果发现,两种组织中分别检测出7 500 和5 298 个DEGs,其中共有2 242个DEGs 差异表达,1 552 个DEGs 相反表达。这些结果表明,甘草地上部分对干旱胁迫的响应比地下部分更敏感,并且在响应干旱胁迫过程中两种组织可能具有不同的发育轨迹,但功能注释发现,地上和地下部分DEGs 在GO 功能部位中的分布基本一致,这与干旱胁迫下豌豆(Pisum sativum)转录组分析结果相似[12]。在分析显著表达的DEGs 时,发现甘草地上、地下部分显著表达的DEGs 主要涉及到植物防御、抗氧化酶活性、植物激素、植物生长发育等生物过程,这表明甘草可能主要通过这些生物过程抵御干旱胁迫。对地上、地下两部分中DEGs 的KEGG 途径分析表明,干旱胁迫促进逆境防御基因的表达,并且二者均在转录因子、蛋白激酶、细胞色素P450 等代谢途径中显著富集。有研究结果表明在适度干旱胁迫下,甘草有效成分合成相关的途径中,一些关键酶基因在甘草根中上调表达[26],这与本研究结果类似,DEGs 在有效成分合成途径中得到了显著富集并明显上调表达,这可能是干旱胁迫促进甘草活性成分积累的基础。
转录因子是许多胁迫响应基因的主要调控因子,可以增强植物对非生物胁迫的耐受性。本研究结果表明干旱胁迫可以调控甘草多种转录因子的表达,其中ERF、bHLH、C2H2、MYB、TCP、WRKY等在地上和地下部分表达均较显著。已有研究证实包括bZIP、AP2 / ERF(APETALA2/ethylene-responsive element binding factors)、NAC、bHLH、WRKY 和MYB等在内的多个转录因子家族参与干旱胁迫响应[27-28]。其中,鉴定的差异表达转录因子数目最多的属于AP2 /ERF 家族,有近85%的ERF 家族成员在地下部分中上调表达,75%的ERF 家族成员在地上部分中上调表达。有研究表明,ERF 转录因子可以作为正向调节剂,参与大豆逆境胁迫响应基因的表达,从而提高植株的耐旱性[28]。另一类差异表达数目较多的转录因子为MYB 家族。研究证实拟南芥(Arabidopsis thaliana)中的AtMYB2作为ABA 信号的主要转录激活因子,在干旱胁迫下发挥重要作用[29]。在本研究结果中,有1 个共同表达的DEGs(Glyur000144s00012217)被鉴定为MYB2 转录因子,且在地上和地下部分中均被显著上调,这表明MYB2 转录因子可能正向调节甘草干旱胁迫响应。此外,C2H2、Dof 等锌指转录因子在植物的发育以及抵抗非生物胁迫中同样也具有重要意义[30]。不仅如此,转录因子还广泛参与中药次生代谢产物合成基因的调控[31]。目前已成功分离、鉴定了多个调控药用植物次级代谢产物合成的WRKY、MYB、ERF、bHLH 类转录因子[32]。本研究结果中,干旱胁迫下,ERF、bHLH、NAC、MYB、WRKY 等转录因子在甘草地上和地下部分中均表现出诱导型表达,并与差异表达的次级代谢相关基因形成共表达网络,表明它们在干旱胁迫下参与调控甘草干旱胁迫应答机制,可能是促进干旱胁迫下甘草有效成分合成的调节因子。
综上所述,干旱会导致甘草Pn、Tr和Gs降低。叶片和根部通过诱导保护酶基因的表达以调节抗氧化酶活性的方式来清除ROS。干旱诱导了ERF、bHLH、NAC、MYB、WRKY 等转录因子的表达,影响了次级代谢产物的合成途径,为进一步在分子水平上深入研究提高甘草抗旱性及发掘相关耐旱基因提供了参考资料。

