基于CRISPR-Cas9构建树突状细胞相关C型凝集素-1基因敲除小鼠模型
陈 洁 谢叶文 潘 洁 丁 骏
江苏省常州市第二人民医院中心实验室,江苏常州 213000
树突状细胞相关性C型凝集素-1(dendritic cellassociated C-type lectin-1,Dectin-1)是属于ⅡC 型凝集素受体 (C-type lectin receptors,CLR) 家族成员之一,由CLEC7a基因编辑。主要表达于巨噬细胞、树突状细胞、中性粒细胞等多种细胞表面[1],同时在肺、胸腺等多个器官中也高表达,其主要作用是模式识别受体,Dectin-1可通过识别CD4+、CD8+T细胞表面的内源性受体,从而促进T细胞的增值[2],Dectin-1在免疫预防与免疫监视中均起到重要的作用。
树突状细胞(dendritic cell,DC)是机体功能最强的抗原递呈细胞(antigen-presenting Cell,APC),现已被应用到多种肿瘤治疗中[3]。Dectin-1是最早发现在DC 上的模型识别受体,Dectin-1 可以识别 β-(1,3)-葡聚糖与其结合刺激树突状细胞诱导Th1和Th17细胞分化[4-5],启动机体的获得性免疫,同时也能通过识别真菌细胞壁上的β-葡聚糖,驱动宿主细胞对真菌吞噬和黏附,并以这种方式开启机体的天然免疫。这明确了Dectin-1在肿瘤免疫中的机制,同时也是把Dectin-1作为肿瘤免疫治疗的新靶点的依据。
CRISPR-Cas9是古细菌和细菌在演化过程中产生的一种适应性免疫防御[6],其作用是抵御外界侵入细菌的DNA或外源DNA,CRISPR-Cas9基因编辑系统是基因敲入技术中最高效的一种方法,其能够准确识别外来的DNA,并将其双链进行特异性切割,应用CRISPR-Cas9系统,通过设计靶向目的基因的sgRNA实现Cas9蛋白对DNA双链的特异性切割。哺乳动物中,DNA双链断裂后会发生非同源末端连接介导的非同源末端连接修复,DNA双链在重新连接的同时引入随机的碱基缺失或增加,造成基因序列移码突变,蛋白功能缺失(图1,封三)[7-9]。本研究通过CRISPRCas9技术敲除小鼠体内Dectin-1基因,进一步研究Dectin-1对β-葡聚糖抗肿瘤的影响,为Dectin-1在肿瘤免疫中的作用机制研究提供实验基础。
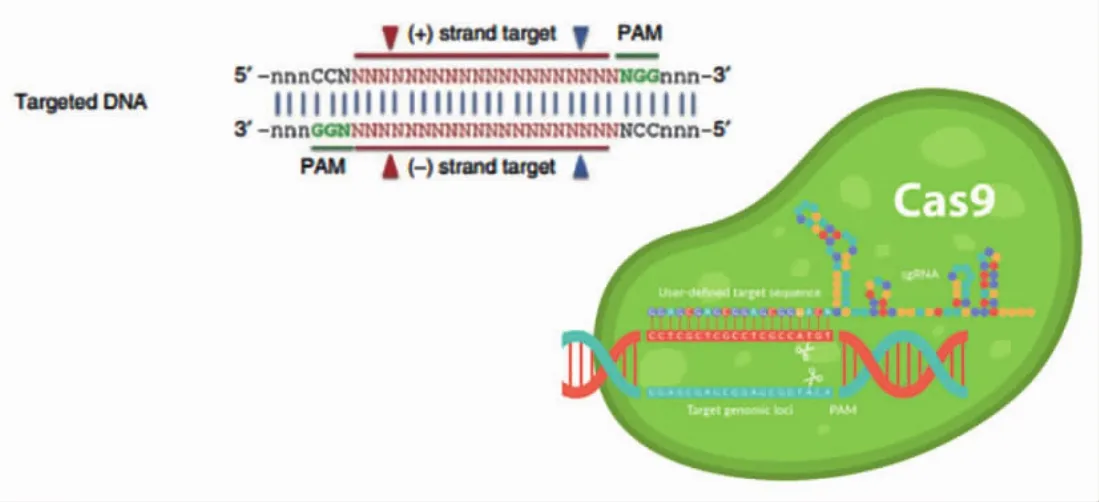
图1 CRISPR-Cas9基因编辑技术图(见内文第41页)
1 材料与方法
1.1 材料
1.1.1 实验动物 3~4周龄的C57BL/6野生型小鼠;购买于常州卡文斯实验动物有限公司[SCXK(苏)2016-0010],并饲养于此公司。饲养环境为SPF级,湿度(55±10)%,温度(22±4)℃,饲养 1 周。
1.1.2 实验试剂及仪器 二甲基亚砜(fimethyl sulfoxide,DMSO),来自sigma 公司(D2650);mMESSAGE mMA CHINE T7 kit(AM1344)和 MEGAclear kit(AM1908)均购自Life Technologies公司;QIAQuick PCR纯化试剂盒购自 Qiagen 公司(28104);T7-Cas9(39994)和T7-sgRNA(68463)均购自Addgene公司;人绒毛促性腺激素(human chorionic gonadotropin,HCG),KSOM,血清促性腺激素(pregnant mare serum gonadotropin,PMSG)。SZX7 立体显微镜(Olympus,SZX7),二氧化碳培养箱(英国 Thermo,3111)和倒置荧光显微镜(Olympus,IX71)。
1.2 方法
1.2.1 引物设计 从NCBI基因组查询数据得到C57BL/6野生型小鼠的Clec7a基因总长为11189bp,在6号染色体上有6个外显子,在外显子2的功能区前端和后端分别设计两对引物,上游引物和下游引物见表1。
1.2.2 Cas9 mRNA及sgRNA的体外转录和纯化 引物序列通过PCR进行扩增,将T7启动序列添加到Cas9的编辑区域中(表1)。用TEA缓冲液配置1%的琼脂糖凝胶,进行PCR实验用来检测T7-Cas的特异性和长度(T7-Cas大小约为4.3 kB)。使用QIAQuick PCR纯化试剂盒,对T7-Cas9 PCR产物进行纯化。使用mMESSAGE mMACHINE T7试剂盒,把纯化后的产物作为模板,进行Cas9mRNA体外转录。使用MEGA-clear试剂盒,用50 μl洗脱缓冲液进行洗脱,根据试剂盒操作步骤对Cas9 mRNA进行纯化。纯化后,用无RNase的水将Cas9 mRNA稀释至500 ng/μl,并用TEA缓冲液配置2%的琼脂糖凝胶,进行质量检测。
引物通过PCR进行扩增,将T7启动序列添加到sgRNA的模板中。用TEA缓冲液配置2%的琼脂糖凝胶,进行PCR实验用来检测sgRNA的特异性和长度,PCR检测其长度为100 pb。使用QIAQuick PCR纯化试剂盒,根据其操作步骤,对T7-sgRNA PCR产物进行纯化。
1.2.3 受精卵准备 选取12~15只(3~4周龄)的C57BL/6小鼠,在第1天给小鼠注射PMSG,剂量为5 U,48 h后向C57BL/6雌小鼠腹腔注射HCG,剂量为每只5 U。HCG注射之后将雌性小鼠与C57BL/6雄性小鼠过夜。在第4天,收集带有栓的雌性小鼠,并将没有栓的雌性小鼠实施安乐死,进行受精卵制备。HCG注射后20~21 h,对见栓的雌性小鼠实施安乐死,从输卵管处收集卵丘细胞复合体。将卵丘细胞复合体移入HTF+Hy培养基中,然后在HTF培养基中洗涤几次后将胚胎置于KSOM培养基(加矿物油覆盖)中,放置37℃,5%CO2的培养箱中培养。将受精卵转移至HTF+CB培养基中,放置于显微镜下用显微注射针向原核胚胎内注射混合物[注射混合:Cas9(50 ng/μl)+sgRNA(50 ng/μl)+ssDNA(100 ng/μl);混合液成分:加入 0.5 μl Cas9、0.5 μl sgRNA、0.5 μl ssDNA 以及0.5 μl无核酸酶水;目的:使HDR点突变]。观察细胞质是否肿胀,肿胀证明注射成功,将胚胎继续培养24 h至产生2个细胞胚胎。
1.2.4 胚胎移植及Dectin-1小鼠的获得 注射当天将发情的ICR雌性小鼠和结扎的雄性小鼠交配来准备假孕代孕母鼠。隔天选择见栓0.5 d的雌鼠,将胚胎移植到代孕母鼠的输卵管中,或者交配后2.5 d之后将胚胎直接移植到代孕母鼠的子宫内,代孕母鼠在交配19.5 d之后生下F0小鼠。出生后3周,将雌性F0小鼠和雄性F0小鼠分笼饲养。
1.2.5 体内实验及分组情况 构建野生型小鼠及Dectin-1敲基因小鼠的乳腺癌模型,待皮下肿瘤可触及时,给予口服β-葡聚糖(beta-gulcan)治疗并分为野生型小鼠组、野生小鼠+beta-gulcan组、Dectin-1敲基因小鼠组、Dectin-1敲基因小鼠+beta-gulcan组。首次治疗时开始测量肿瘤大小,每2天测量1次,并绘制肿瘤生长曲线,待肿瘤达到规定大小体积时(最长直径不大于15 mm),处死小鼠。
1.3 观察指标及评价标准
剪取出生后三周的小鼠尾巴0.5~1 cm并编号,并将其剪碎放置1.5或2 ml的离心管中。加入试剂对样本进行酶解反应,离心吸取上清液,获得小鼠的基因组DNA。用PCR技术对基因敲除情况进行验证,验证序列见表2,PCR扩增体系见表3,PCR反应条件为95℃,预变性 5 min;按照循环程序(95℃ 30 s;58℃30 s;72℃ 30 s) 进行 40 个循环,72℃延伸 5 min,根据说明书使用QIAQuick PCR试剂盒纯化PCR产物。使用TA Cloning试剂盒来测试序列验证突变。将成功敲除Dectin-1基因的雌性和雄性小鼠进行交配获得下代小鼠,对下代小鼠进行基因鉴定,删选继续交配直到F3代小鼠,用PCR技术对F3代小鼠进行基因鉴定,验证序列见表4,以确定建立Dectin-1敲除小鼠。

表2 基因引物序列

表3 PCR扩增体系
1.4 统计学方法
采用Graph prism 8.0软件进行数据分析,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 F0代小鼠获得
本研究通过显微镜操作向原核胚胎内注射混合物,成功种植的胚胎移植到代孕母鼠体内,代孕母鼠在交配19.5 d之后生下F0小鼠。据观察F0代小鼠状态良好,外观与C57BL/6野生型小鼠无差异。
2.2 Dectin-1小鼠基因鉴定结果
DNA测序结果显示F0代小鼠中Dectin-1基因的部分序列缺失并产生移码突变(-13bp)(图2,封四)。通过设计位于移码缺失区外的引物(P1-P2)和移码缺失区内的引物(P3-P4),PCR检测发现,仅P1-P2引物可以扩增出目的条带(图3),提示从F3开始,已获得Dectin-1敲基因小鼠。
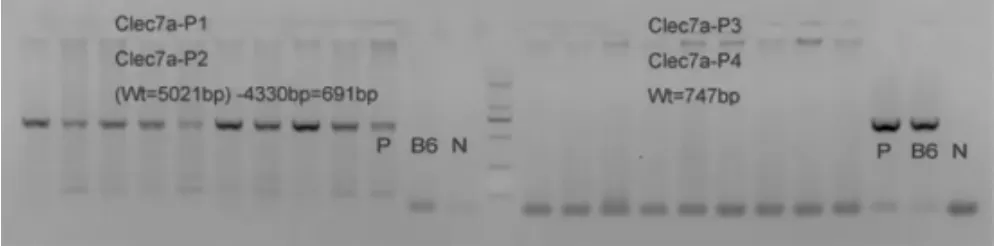
图3 PCR扩增琼脂糖凝胶电泳结果
2.3 Dectin-1缺失抑制β-葡聚糖诱导的小鼠抗肿瘤能力
本研究构建野生型小鼠及Dectin-1敲基因小鼠的乳腺癌模型,口服β-葡聚糖进行治疗,观察其肿瘤生长情况,结果发现在第14天Dectin-1敲基因小鼠肿瘤体积大于野生型小鼠,差异有统计学意义 (P<0.05)(图4,封四)。体内实验表明Dectin-1缺失可抑制β-葡聚糖诱导的抗肿瘤能力,同时证明Dectin-1敲基因小鼠构建成功。

3 讨论
伴随着分子生物学、免疫学、肿瘤学的不断发展和相互深入研究,肿瘤免疫治疗应运而生[10]。随着对人体免疫机制研究的不断深入,肿瘤免疫治疗也被越来越多的人所关注[11],肿瘤免疫治疗就是利用再次启动免疫循环来清除体内没有被正常免疫系统所识别的肿瘤细胞[12],来达到清除和控制肿瘤的目的。近几年,肿瘤免疫治疗在非小细胞肺癌、黑色素瘤等多种实体瘤治疗中,疗效显著,但是目前肿瘤免疫治疗的各种方法还不够完善。本实验通过构建免疫相关基因的敲除鼠,研究其在肿瘤免疫中的作用,从而为更多的临床试验提供动物模型。
自1973年Siteinman[10]发现DC以来,树突状细胞是目前机体中最强的抗原递呈细胞,而Detin-1是最早在树突状细胞上被发现的,目前对于研究树突状细胞在肿瘤免疫中的应用和机制,大部分相关研究报道都集中在Dectin-1受体和Dectin-2受体上[4-5]。但由于Dectin-2在树突状细胞上并没有像Dectin-1一样高表达,所以目前相关研究以Dectin-1为主。有文献报道发现Dectin-1可以通过不同途径,激活机体的特异性免疫和非特异性免疫进行肿瘤免疫[12]。因此,本实验通过构建Dectin-1基因敲除小鼠,研究Dectin-1在抗肿瘤免疫中的作用。
在基因敲除方法中,CRISPR-Cas9技术因其操作简单、高效率、成本低等优点被科研工作者作为基因编辑的首选方法[13],在肿瘤免疫治疗中也发挥着重要的作用[14-15]。所以本研究利用CRISPR-Cas9技术对小鼠Dectin-1基因进行敲除,经过培养、手术、鉴定获得F0代小鼠,并通过PCR扩增及测序鉴定的阳性F0代小鼠与C57BL/6J小鼠交配获得6只阳性F1代小鼠。
β-葡聚糖是一种天然碳水化合物,它主要存在于植物、细菌、真菌的细胞壁上,是Dectin-1的特异性识别受体,Dectin-1通过识别β-葡聚糖,从而诱导免疫受体酪氨基酸活化基序 (immunoreceptor tyrosinebased activation motif,ITAM)激发细胞内的信号转导,使自身免疫细胞产生一系列的细胞反应,如产生多种炎性因子、趋化因子,这些因子可以促进B细胞、T细胞的体液免疫应答和细胞免疫应答加强[17],从而增强机体抗肿瘤[18]及抗感染[19-20]能力。本研究通过β-葡聚糖来检测Dectin-1敲基因小鼠的抗肿瘤能力,结果显示,Dectin-1敲基因小鼠口服β-葡聚糖后,其抗肿瘤生长能力低于对照组,差异有统计学意义(P<0.05)。由此证明Dectin-1敲基因小鼠构建成功,为肿瘤免疫治疗临床试验提供动物模型,同时有助于临床更好的研究Dectin-1在肿瘤免疫中的作用机制。
综上所述,利用CRISPR-Cas9技术构建Dectin-1敲基因小鼠模型建立动物模型有利于肿瘤免疫治疗方法的完善,同时对Dectin-1在免疫肿瘤治疗中的影响及作用奠定了一定的实验基础。

