毛白杨果胶甲酯酶PtoPME34-1调控植物抗旱性研究
邓艾汶, 李青遥, 杨 文, 肖朝文
(四川大学生命科学学院, 成都 610064)
1 引 言
虽然拟南芥作为模式植物在植物界应用广泛,但其经济价值缺乏.多年生木本杨树在研究木本植物发育调控、生物与非生物胁迫应答和物种进化等生物学问题中起着重要作用,并且具有重要的经济价值[1].随着我国经济的发展,杨树优良育种的需求大大增加,但由于育种资源缺乏、栽培体系不健全等因素限制了我国林木育种发展.近年来,基因工程技术的发展和分子生物学的应用为杨树抗逆育种改良提供了新思路.
细胞壁作为植物细胞外界的第一层屏障,对植物细胞起到至关重要的保护作用.细胞壁结构由初生细胞壁、次生细胞壁和胞间层组成,其中初生壁主要成分为果胶,纤维素和半纤维素[2].对于高等植物而言,细胞壁不仅作为细胞的重要结构组成单元,根据不同细胞壁组分的理化性质,细胞壁在植物生长过程中起多种调控作用[3].细胞壁具有对植物提供机械支持、介导物质运输、抵御病原体和逆境胁迫、调控生长速度和传递外界信号等一系列重要的生物学功能[4].
果胶是一类存在于植物细胞壁中富含半乳糖醛酸(Galacturonic Acid,GalA)的多糖生物大分子,在双子叶植物和非禾本科单子叶植物中约占初生细胞壁的35%,在调控细胞粘附、气孔开闭和防御响应等方面起重要作用[5].根据果胶分子主链和侧链结构的不同,主要分为以下四类结构单元:同型半乳糖醛酸聚糖(Homogalacturonan,HG),鼠李半乳糖醛酸聚糖I型(Rhamnogalacturonan I, RG I),鼠李半乳糖醛酸聚糖Ⅱ型(Rhamnogalacturonan Ⅱ,RG Ⅱ),木葡糖半乳糖醛酸聚糖(Xylogalacturonan,XG)[6].其中,同型半乳糖醛酸聚糖HG在果胶中最为丰富,约占60%.HG是由α-1,4糖苷键连接的线形聚合物,在它的C-6位羧基处可被甲基酯化修饰,在O-2或O-3位可被乙酰化修饰[7].研究表明,HG的不同理化状态影响细胞粘附性和组织完整性,也影响细胞间的信号传递[8].在果胶HG合成过程中,HG的主链通过果胶甲基转移酶在高尔基体合成并在C-6位置被甲基酯化后,以约70%-80%的高酯化形式沉积在细胞壁上[9].这种高度甲酯化状态的HG随后会被果胶甲基酯化酶(Pectin Methylesterase,PME)去甲酯化而使其甲酯化程度降低.低甲酯化的果胶在不同pH和不同质子浓度条件下,一方面可与钙离子(Ca2+)发生交联,产生“蛋盒”(egg-box)的构象,从提高细胞壁刚性;另一方面可被多聚半乳糖醛酸酶(Polygalacturonase,PG)剪切成为小片段,使其可塑性增加[8].所以,果胶修饰酶可通过改变HG的状态影响果胶的构象和重塑性而调控植物生长发育.植物果胶甲酯酶PME可以通过修饰果胶的甲酯化状态参与细胞壁果胶的代谢和重塑.因此,PME与植物的生殖和发育密切相关,影响植物的多个生理过程[10].近年来,果胶甲酯酶PME的功能被逐步揭示,其主要表现在细胞壁柔韧性与硬化、细胞粘附和细胞分离[11],果实成熟[12],木材生长与发育[13],茎秆生长[14],叶片气孔发育[15],种子萌发[16]和花粉管伸长[17]等方面.另外,由于细胞壁作为外界环境与植物细胞内环境的一道屏障,细胞壁修饰过程与植物防御响应密切有关[18].拟南芥微阵列数据库预测显示,植物在响应多种生物与非生物胁迫时,有约75%的PME基因表达水平发生明显变化.然而,无论是在拟南芥还是杨树中,PME在干旱胁迫中的作用机制都鲜有报导.
在本研究中,生物信息学预测表明,拟南芥AtPME34和毛白杨PtoPME34-1基因在茎组织中的表达量都很高[17].通过转录组数据库和序列比对,我们从毛白杨中筛选并克隆出拟南芥AtPME34的同源基因PtoPME34-1,并进行组织特异性表达分析和蛋白亚细胞定位观察.进一步研究发现,PtoPME34-1基因的过量表达和敲除都有效提高了杨树抗旱性.这些研究结果证实了毛白杨果胶甲酯酶PtoPME34-1在调控植物生长发育和抗旱胁迫中的重要作用.
2 材料和方法
2.1 材料和试剂
野生型毛白杨(Popilustrichocarpa),植物总RNA提取试剂盒(Bioflux),反转录试剂盒(Takara),高保真DNA聚合酶(Vazyme),qPCR TB green Taq Ⅱ酶(Takara),限制性内切酶(NEB),T4 DNA连接酶(NEB),质体提取纯化试剂盒(Omega),大肠杆菌DH5α,根癌农杆菌GV3101,亚细胞定位载体pBI121-GFP,植物过量表达载体pCXSN,基因敲除载体pYLCRISPR/Cas9.
2.2.1PtoPME34-1基因的克隆和进化树构建 取野生型毛白杨第三到第四茎节幼嫩叶片,液氮迅速研磨成粉末,使用Biospin多糖多酚植物总RNA试剂盒提取植物总RNA,使用 Takara 公司的反转录试剂盒去除基因组DNA,并反转录合成cDNA.采用Phanta Max高保真 DNA 聚合酶进行PtoPME34-1基因的PCR扩增,并测序验证.比对PtoPME34-1在其他物种中的同源基因,使用MEGA7软件(https://www.megasoftware.net/)进行氨基酸序列比对,构建NJ进化树(neighbor-joining phylogenetic tree),重复值设置为1 000,比对结果用GeneiousPrime软件(https://www.geneious.com/prime/)显示.
2.2.2PtoPME34-1基因组织特异性表达分析 取三个月大约8 cm高的野生型杨树组培苗,将其分成根、基部茎(植株中间以下的茎段)、上部茎(中间以上)、老叶(植株中间以下叶片)、新叶(中间以上)和叶柄部分.另取一生长状态相似的杨树茎段,用刀划开表皮并剥开,外部为韧皮部,内部为木质部.随后立即将8个不同组织的材料放入液氮中充分研磨,按照方法2.2.1进行总RNA的提取和cDNA的合成.使用qPCR TB green Taq Ⅱ酶进行实时荧光定量PCR(qPCR)反应,每组样品含3个重复,所得样品cq值用CFX Manager软件导出,以最小值为基础,以毛白杨UBQ为内参基因,根据2-△△Ct法计算PtoPME34-1基因在不同组织中的相对表达量.
2.2.3 PtoPME34-1蛋白亚细胞定位分析 使用Phanta高保真酶和基因特异引物扩增PtoPME34-1基因的开放阅读框并回收PCR产物.T4连接酶连接目的基因和限制性内切酶KpnⅠ酶切的pBI121-GFP线性载体,构建重组质粒.对于亚细胞定位观察,培养带有重组质粒的农杆菌,当菌液OD600= 0.8时,注射3 w大的烟草叶片,并标记注射位置.注射完成的烟草在黑暗下继续培养48 h和光照条件下培养12 h之后,使用激光共聚焦显微镜,在488 nm下的观察荧光.pBI121-GFP空载体作为阳性对照.质壁分离使用0.3 g/mL的蔗糖溶液处理烟草叶片.
2.2.4 基因过量表达植株的构建 PCR扩增PtoPME34-1基因的编码序列,通过同源重组,将基因片段重组到植物过量表达载体pCXSN上.完成重组反应后,使用热激法转化重组质粒到大肠杆菌DH5α感受态中,随后进行阳性菌株的鉴定和农杆菌的转化,获得带有阳性克隆的农杆菌.毛白杨苗的转化采用叶盘法,将叶片在农杆菌重悬液中浸染10 min,取出清洗后在置于共培养基上,暗培养2 d.然后依次在选择培养基、生芽培养基和生根培养基中培养至约8 cm的幼苗后移栽到土里.利用潮霉素抗性筛选获得阳性的转基因植株.
2.2.5 基因敲除Crispr植株的构建 在网站(http://cbi.hzau.edu.cn/cgi-bin/CRISPR2/CRISPR)中输入gDNA 序列,选择1~3个靶位点并添加对应靶位点的接头.本载体系统采用Golden Gate cloning方法进行Cas9载体和多个gRNA表达盒片段的一次连接组装.先构建gRNA表达盒, 随后将其与pYLCRISPR/Cas9连接,然后进行载体的阳性克隆筛选检测和打靶效果检测.植物转化和阳性植株筛选如前所述.
2.2.6 干旱胁迫 在杨树中,选择74日龄和108日龄植株进行干旱处理.停止浇水5 d,当杨树分生组织干燥3 cm,叶尖下垂,土壤完全干旱时,在托盘中浇水约3 L,直到土壤表面浸透,清除多余的水分,使植株恢复生机.36 h后拍照并记录表型.
2.2.7 植物果胶甲酯化程度的测定 果胶的甲酯化程度是甲基酯化的同型半乳糖醛酸与总同型半乳糖醛酸的比值.测量甲酯化程度方法主要参考文献[19].
2.2.8 半乳糖醛酸含量测定 称取1 mg 植物细胞壁到玻璃试管中,每样5个重复,加水混匀.加入40 μL 4 mol/L氨基磺酸钾(pH = 1.6),再加入2.4 mL浓硫酸使其剧烈反应,涡旋震荡摇匀.沸水浴10 min,冰上迅速降温.最后加入80 μL含有0.15%苯基苯酚的0.5%的NaOH溶液,室温下显色反应5 min.利用分光光度计下测量OD525波长下的吸光值,根据表1所示的半乳糖醛酸标准品与吸光值得到的标准曲线计算样品半乳糖醛酸的含量.
2.2.9 甲醇含量测定 称取1 mg 植物细胞壁加到1.5 mL离心管中,每样5个重复.加入400 μL 0.5 mol/L的NaOH溶液反应1 h,期间剧烈震荡4次左右.加200 μL浓度为1 mol/L的HCl溶液并混匀,室温离心10 min.取200 μL上清液加入300 μL浓度为20 mmol/L的HEPES 缓冲液(pH=7.5).加入500 μL含乙醇氧化酶的20 mmol/L的HEPES 缓冲液,反应后快速离心,加入500 μL的反应液,充分混匀后在60 ℃反应15 min.利用分光光度计下测量OD412波长下的吸光值,根据表2所示的甲醇标准品吸光值得到的标准曲线计算出反应液所含有的甲醇含量.本研究中所有的引物序列见表3.
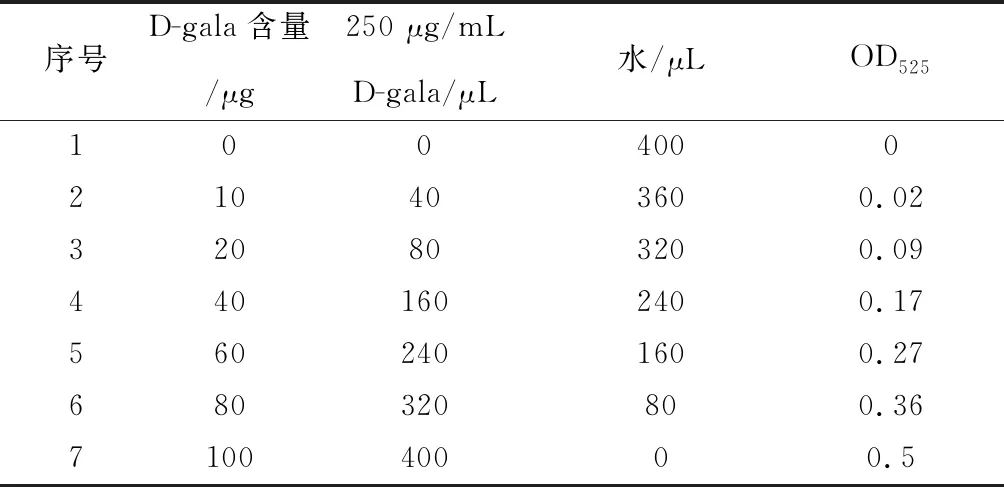
表1 半乳糖醛酸标准品与吸光值
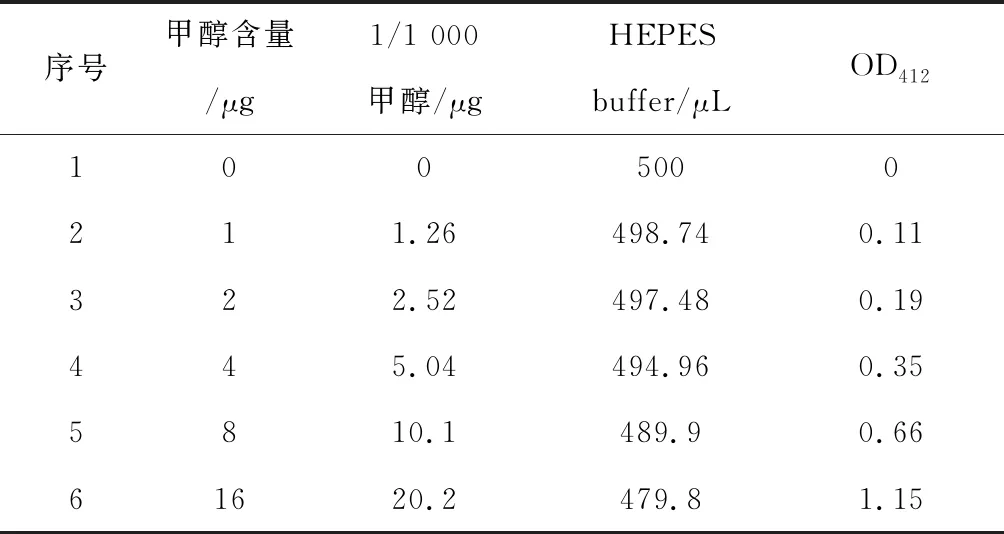
表2 甲醇标准品与吸光值

表3 引物序列
3 结果分析
3.1 毛白杨PtoPME34-1基因的克隆和同源性分析
毛白杨(Populustomentosa)属于杨属,在中国北方广泛应用于造林绿化,因此对毛白杨的基因功能研究对于中国本土林业育种具有十分重要的经济和生态意义.由于毛白杨的全基因组数据库缺少,而模式树种毛果杨(Populustrichocarpa)已经获得全基因组测序,可以利用毛果杨的数据库,同源克隆毛白杨的目标基因,进行基因功能分析.
如图1(a)所示,在不同植物中比对毛白杨PtoPME34-1及其同源蛋白的序列,灰线和黑线分别表示预测的PMEI结构域和PME结构域的氨基酸位置.序列比对结果说明,包括PtoPME34-1在内的所有氨基酸序列都包含前后两个结构域:PMEI结构域和PME结构域,属于第一类(Type I)PME亚家族蛋白.通过氨基酸序列同源性比对分析,我们发现拟南芥AtPME34和毛果杨的PtrPME34与毛白杨PtoPME34有较高的同源性.为了进一步分析同源性和进化关系,我们使用氨基酸序列对其进行了多序列比对和进化树构建.图1(b)所示为毛白杨和拟南芥PME基因家族的系统发育关系,蓝色、灰色、绿色分别表示Ⅰ型、ⅡA型和ⅡB型的PME基因家族.图1(c)所示为PtoPME34-1及其同源蛋白的系统进化树.毛白杨PtoPME34-1与毛果杨PtrPME34-1 (Potri.012G014500.1)位于同一染色体.毛白杨PtoPME34-1与毛果杨PtrPME34-1序列相似性高达100%,与拟南芥AtPME34序列相似性为93%,与毛白杨PtoPME34-2序列相似性也达100%.系统发育进化树的结果表明, PtoPME34-1及不同物种中的同源蛋白在进化过程中非常保守,意味着果胶甲酯酶PME在植物生长发育过程中的重要作用.
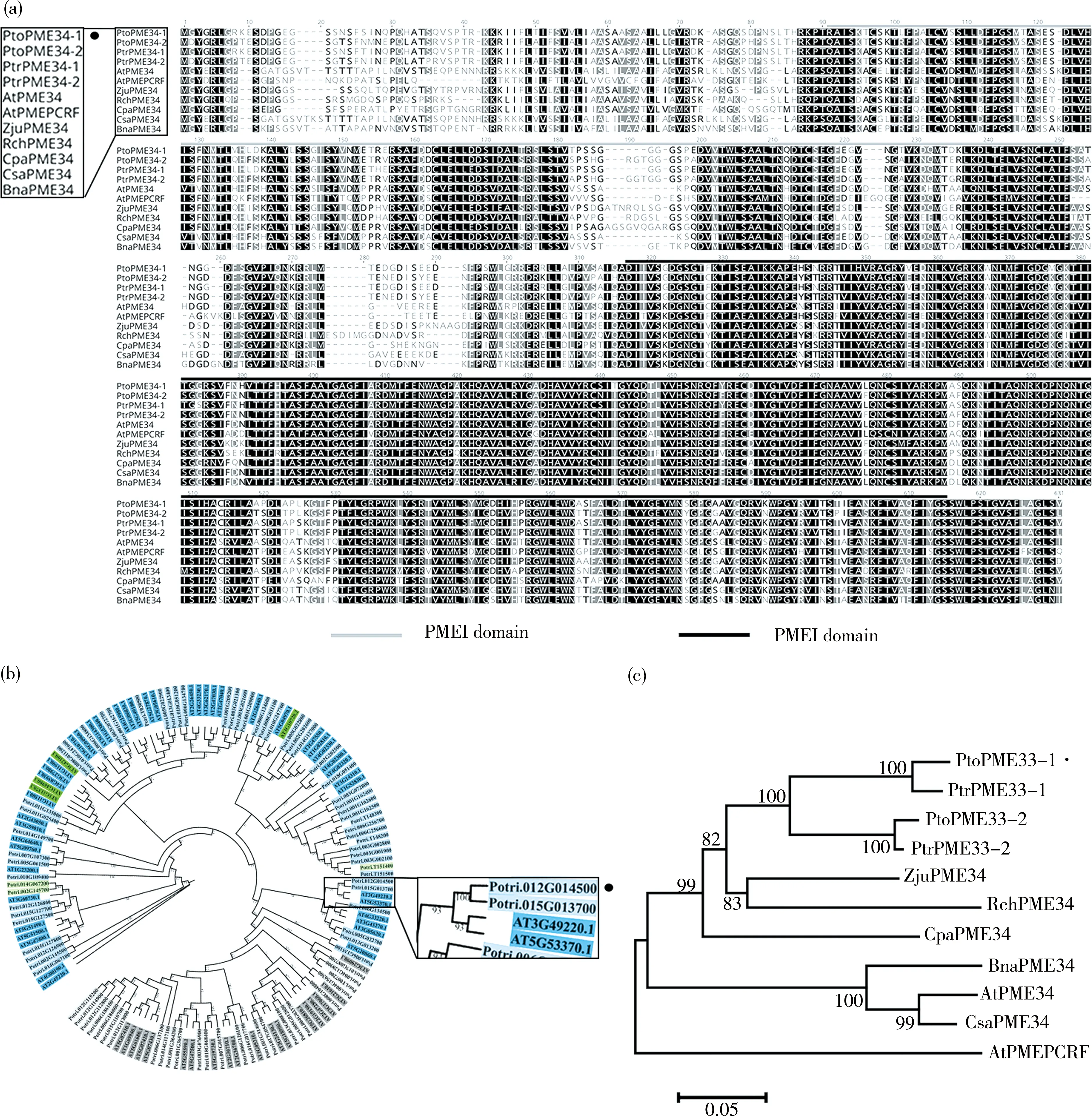
图1 PtoPME34-1的氨基酸序列同源性比对和系统发育进化树
果胶甲基酯酶(PME,EC3.1.1.11,第八类碳水化合物酯酶[20])主要源于植物或微生物细胞壁,可以催化线性同聚半乳糖醛酸结构域中半乳糖醛酸GalA残基C-6处的甲基,从而调控甲酯化程度并释放甲醇和质子.通过网站(http://www.cbs. dtu.dk/services/TargetP)预测显示PtoPME34-1蛋白可能在细胞壁中表达.为了验证PtoPME34-1蛋白的亚细胞定位,我们构建了绿色荧光蛋白GFP标记PtoPME34-1的植物表达载体,通过农杆菌介导的方法瞬时转化烟草叶片,利用激光共聚焦显微镜观察GFP荧光信号.如图2(a)所示,阳性对照组pBI121-GFP在烟草叶肉细胞中的膜、质、核区域均有荧光信号,而PtoPME34-1-GFP在烟草叶肉细胞中的信号只出现在细胞边界部位.质壁分离处理发现,PtoPME34-1-GFP在烟草叶肉细胞中的信号仍然在细胞边界部分(红色箭头所示为细胞膜).结果表明,PtoPME34-1蛋白在植物细胞的细胞壁中表达,与其果胶修饰酶功能的亚细胞作用位置一致.
为分析基因的组织特异性表达,我们利用qPCR检测了杨树不同组织包括幼叶(YL)、老叶(OL)、木质部(X)、韧皮部(PH)、叶柄(P)、基部茎(BS)、上部茎(US)和根(R)中PtoPME34-1的基因表达水平.图2(b)所示,PtoPME34-1在所有组织部位中均有表达,在老叶中表达最少,在韧皮部、叶柄和根中表达较多,在木质部和基部茎中表达量最高.这些结果表明,PtoPME34-1倾向于在营养运输部位表达,它可能参与调节植物生长发育中养分和水分的运输过程.
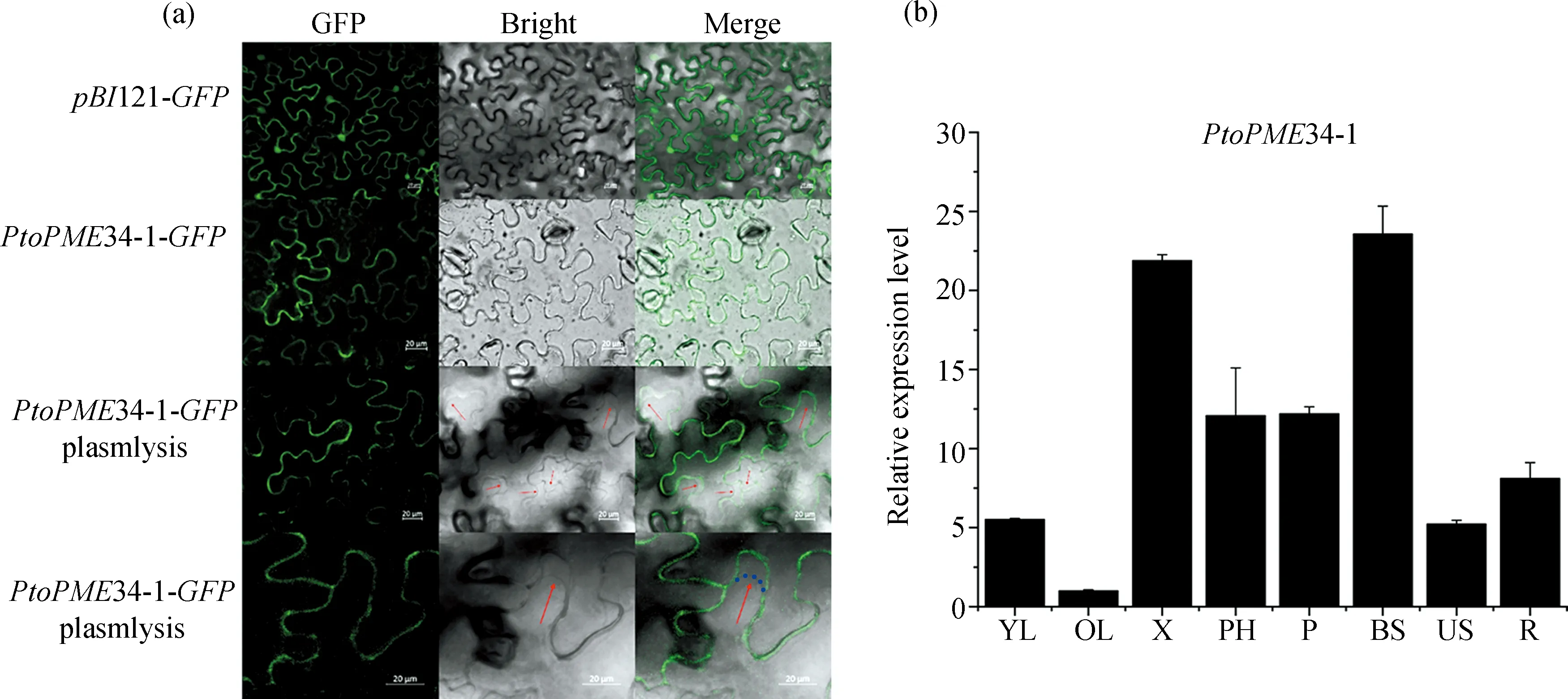
图2 PtoPME34-1蛋白的亚细胞定位和基因组织特异性表达
如图3(a)所示,我们获得了8个独立的阳性杨树PtoPME34-1的转基因植株.qPCR检测结果证实PtoPME34-1在转基因株系1,3,8中的表达量显著提高(图3(b)).图3(a)为正常浇水情况下的植株,图3(c)为停止浇水5天至萎蔫并再次加水36小时后的植株.结果显示,过表达PtoPME34-1植株经干旱胁迫并复水后可恢复绿叶,而野生型的叶片依然干枯.这说明PtoPME34-1基因过量表达提高了植物的耐旱性.
为避免基因功能冗余,我们利用CRISPR/Cas9系统获得了PtoPME34-1和其同源基因PtoPME34-2的双突变体株系.选择其中4个突变体株系,利用生化方法测定杨树细胞壁提取物中果胶的甲酯化程度.如图4(a)所示,四个突变株系果胶含量均出现显著下降.如图4(b)所示,与野生型相比,突变体的果胶甲酯化程度显著升高.这说明,突变体中PtoPME34-1和PtoPME34-2基因表达水平的下降使其编码的果胶甲酯酶活性下降,去果胶甲酯化的能力减弱,最终导致果胶甲酯化程度升高.此外,Crispr突变体植株干旱复水后也能恢复绿叶,表现出一定程度的耐旱性(图4c).

图3 PtoPME34-1基因过量表达提高毛白杨的抗旱性
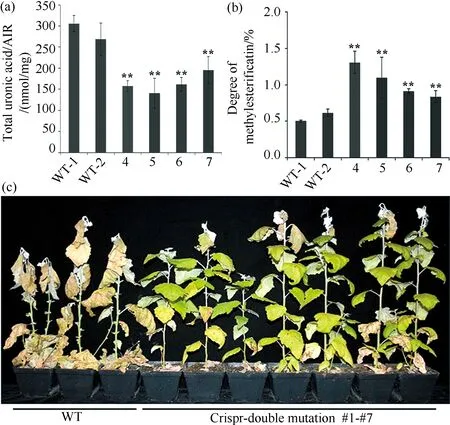
图4 PtoPME34-1和PtoPME34-2基因的缺失降低果胶甲酯化程度且提高植物抗旱性
杨树作为我国在经济和环境方面具有重要贡献的树种之一,其遗传育种研究早已相继展开.细胞壁作为支持保护细胞的结构,其细胞壁合成修饰酶的基因功能和逆境响应机制在杨树物种中却鲜有报道.一方面,杨树遗传相关研究主要集中在生物学功能强大的转录因子;另一方面,细胞壁修饰酶基因多为比较保守的基因家族,存在基因功能冗余的现象,为其研究造成了困难.本研究首次在毛白杨中分离鉴定了果胶甲酯化酶基因PtoPME34-1并测序得到了完整的CDS序列.通过基因序列比对和进化分析,毛白杨PtoPME34-1氨基酸序列与毛果杨中PtrPME34-1相似性高达100%,并且该序列与多个物种中的同源蛋白相比差异性较小,均包含PMEI和PME两个结构域,归属于第一类(Type I)PME亚家族蛋白.
我们分别进行了PtoPME34-1组织特异性表达分析及蛋白亚细胞定位分析.RNA表达水平检测结果表明,PtoPME34-1表达量最高的组织位于营养物质运输部位,比如基部茎、木质部等,说明PtoPME34-1可能参与杨树生长中物质的运输,尤其是在次生细胞壁中[15].从细胞水平来看,含GFP标记的PtoPME34-1-GFP融合蛋白定位在烟草叶片细胞壁,与PtoPME34-1蛋白作为果胶修饰酶的功能作用位点一致.这些分析结果表明,PtoPME34-1蛋白在毛白杨细胞壁中行使果胶甲基酯化酶的功能,对植物的生长发育有重要调节作用.
为了研究PtoPME34-1基因在植物体中的生物学功能,本实验采用模式植物毛白杨作为植物材料构建了过量表达转基因植株,发现过量表达PtoPME34-1后毛白杨抗旱性增强.此外,我们构建了PtoPME34-1和PtoPME34-2双基因敲除突变体植株,敲除的植株中果胶甲酯化程度显著高于野生型,且抗旱性也明显提高.以前的研究发现,拟南芥PME34可以控制气孔运动和调节保卫细胞壁的灵活性,从而响应热胁迫[21].因此,我们推测PtoPME34-1调控植物抗旱性是否也与气孔开放程度相关,还需进一步验证.由于过表达果胶甲基酯酶基因PtoPME34-1,其表达水平变化引起酶活水平的变化,导致果胶酯化程度的改变.我们猜测这种干旱信号响应的变化可能会体现在渗透响应基因的表达水平上,从而影响ABA等信号通路,作用于气孔运动的变化,最终使植株或叶片的失水率与野生型出现差异,改变植物体的干旱耐受能力,但其具体分子机制尚待进一步探索.

