重组人生长激素替代治疗对矮身材儿童非对称性二甲基 精氨酸水平的影响
梁 祎 刘 晶 冷丽娜,3 宋婷婷,4 霍佳慧 马慧娟
1.河北省人民医院代谢病重点实验室(河北石家庄 050000);2.河北医科大学(河北石家庄 050000);3.河北北方学院(河北张家口 075000);4.华北理工大学(河北唐山 063000)
生长激素缺乏症(growth hormone deficiency,GHD)和特发性身材矮小症(idiopathic short stature,ISS)是临床上最常见的儿童矮身材原因。由于生长激素缺乏,儿童早期就已出现动脉粥样硬化斑块[1-2],成年GHD者还常表现出与代谢综合征相似的代谢异 常[3],心脑血管疾病的发生风险大大增加。重组人生长激素(recombinant human growth hormone,rhGH)替代治疗可以逆转成年GHD患者早期的颈动脉粥样硬化,并在一定程度上改善心功能[4]。非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)是一种蛋白质代谢产物,通过减少血管内皮细胞NO的合成,引起血管内皮功能失调[1,5]。研究发现血浆ADMA,可能参与致动脉粥样硬化的过程,被认为是早发性动脉粥样硬化、心脑血管疾病的一个独立预测指标[6]。
有研究认为无论儿童或成年GHD 患者,ADMA水平均较相匹配的正常人群增高,rhGH治疗可使其降低[7-8],但也有相反的结果[9]。本研究通过观察GHD及ISS 患儿rhGH 治疗前后血浆ADMA 的水平,评估矮身材儿童早期动脉粥样硬化及心血管疾病发生风险,探索rhGH治疗对ADMA水平的影响。
1 对象与方法
1.1 研究对象
以2018 年12 月至2020 年12 月就诊于河北省人民医院内分泌科的矮小症患儿作为研究对象。纳入标准:①年龄5~13岁;②符合GHD和ISS诊断标准[10]。排除标准:①患有营养不良或肥胖;②合并心肝肾功能障碍、脑血管病或其他慢性器质性疾病;③染色体异常;④小于胎龄儿;⑤软骨发育不良;⑥除GHD外其他内分泌异常;⑦严重心理、情感障碍、摄食异常;⑧使用可以影响测量指标的药物或GH治疗。
以同期就诊于河北省人民医院内分泌科矮小门诊,经检查判定为健康的儿童作为健康对照组。
本研究获得河北省人民医院伦理委员会批准通过,取得家属同意并签署知情同意书。
1.2 方法
1.2.1 临床资料采集 收集受试者的基本信息、母亲妊娠史、出生史、喂养史、生活习惯、生长发育史、既往史、个人史、家族史等。所有患儿由同一组操作人员使用同一量具于上午进行身高、体质量的测量,连续测量两次取平均值。性发育分期采用Tanner分期 法[11]。
1.2.2 诊断标准 GHD诊断标准:①身高低于同种族、同年龄、同性别健康儿童平均身高2 个标准差或第3百分位数;②身高增长速度缓慢,增长率<4 cm/a;③智力发育与年龄相符;④身材匀称;⑤骨龄落后实际年龄;⑥两次生长激素激发试验(左旋多巴激发试验和低血糖激发试验)GH 峰值均μ <10 ug/L。ISS 诊断标准:①身高低于同种族、同年龄、同性别健康儿童平均身高2 个标准差或第3 百分位数;②身高增长速率正常或偏慢;③智力发育与年龄相符;④出生时身长和体质量正常,身材匀称;⑤骨龄正常或延迟;⑥至少一项生长激素激发试验结果示GH峰 值≥10 μg/L。
1.2.3 治疗和随访 GHD患儿的rhGH治疗剂量为0.10~0.15 IU/(kg·d),ISS患儿治疗剂量为0.15~0.20 IU/ (kg·d),睡前皮下注射。治疗和随访周期为1年,GHD组30例完成随访,ISS组治疗后6个月32例完成随访,12个月29例完成随访。
1.2.4 随访及主要观察指标 所有患儿禁食8~12小时,次日清晨抽取静脉血,并留存空腹血标本,检测血常规,肝、肾功能,血脂包括总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C),空腹血糖(fasting blood glucose,FBG),空腹胰岛素(fasting insulin,FINS),胰岛素样生长因子(insulin-like growth factor-1,IGF-1)等指标。ADMA水平采用ELISA法测定,ADMA的酶联免疫试剂盒(武汉华美Cusabio生物技术有限公司,货号CSB-E09298h)的灵敏度为1.95ng/mL;批内精密度变异系数(CV,%)<8%,批间精密度CV<10%。分别检测健康儿童及矮小症儿童治疗前、rhGH治疗6个月以及12个月的上述指标。
1.2.5 生长及代谢参数计算 身高标准差积分(the standard deviation score of height,HtSDS)=(患儿实测身高-同性别、同年龄正常儿童身高的中位数)/同性别、同年龄正常儿童身高的标准差[12];动脉硬化指数(atherogenic index,Ai)=(TC-HDL -C)/HDL-C;胰岛素抵抗指数的稳态模型评估(homeostatic model assessment for insulin resistance index,HOMAIR)=[FINS(mmol/L)×FBG(µU/mL)]/22.5;定量胰岛素敏感性检测指数(quantitative insulin sensitivity check index,QUICKI)=1/[lgFBG (mg/dL)+lgFINS (µU/mL)]。
1.3 统计学分析
应用SPSS 22.0 统计软件进行分析。符合正态分布的计量资料以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般特征及临床指标
GHD组30例,ISS组33例,对照组27例。治疗前三组之间性别、年龄、体质量和BMI的差异均无统计学意义(P>0.05)。三组之间身高、HtSDS的差异有统计学意义(P<0.05),GHD组及ISS组均低于对照组,差异有统计学意义(P<0.05)。ISS组的GH峰值高于GHD组,差异有统计学意义(P<0.05)。见表1。
表1 rhGH治疗前三组儿童临床指标比较[M(P25~P75)],()

表1 rhGH治疗前三组儿童临床指标比较[M(P25~P75)],()
注:1)与对照组比较,P<0.05;2)与GHD组比较,P<0.05
治疗前三组之间IGF-1、LDL-C、Ai、ADMA 水平的差异有统计学意义(P<0.05);GHD 组LDL-C、ADMA高于对照组,GHD组、ISS组的Ai水平均高于对照组,而IGF-1 水平均低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 GHD组rhGH治疗前后临床指标比较
GHD 组rhGH 治疗前,治疗6 个月、12 个月之间患儿的身高、体质量和HtSDS 差异均有统计学意义(P<0.05),治疗6 个月和12 个月后GHD 患儿的HtSDS均较治疗前升高;治疗12个月后GHD患儿的身高、体质量较治疗前明显增加,差异有统计学意义(P<0.05)。见表2。
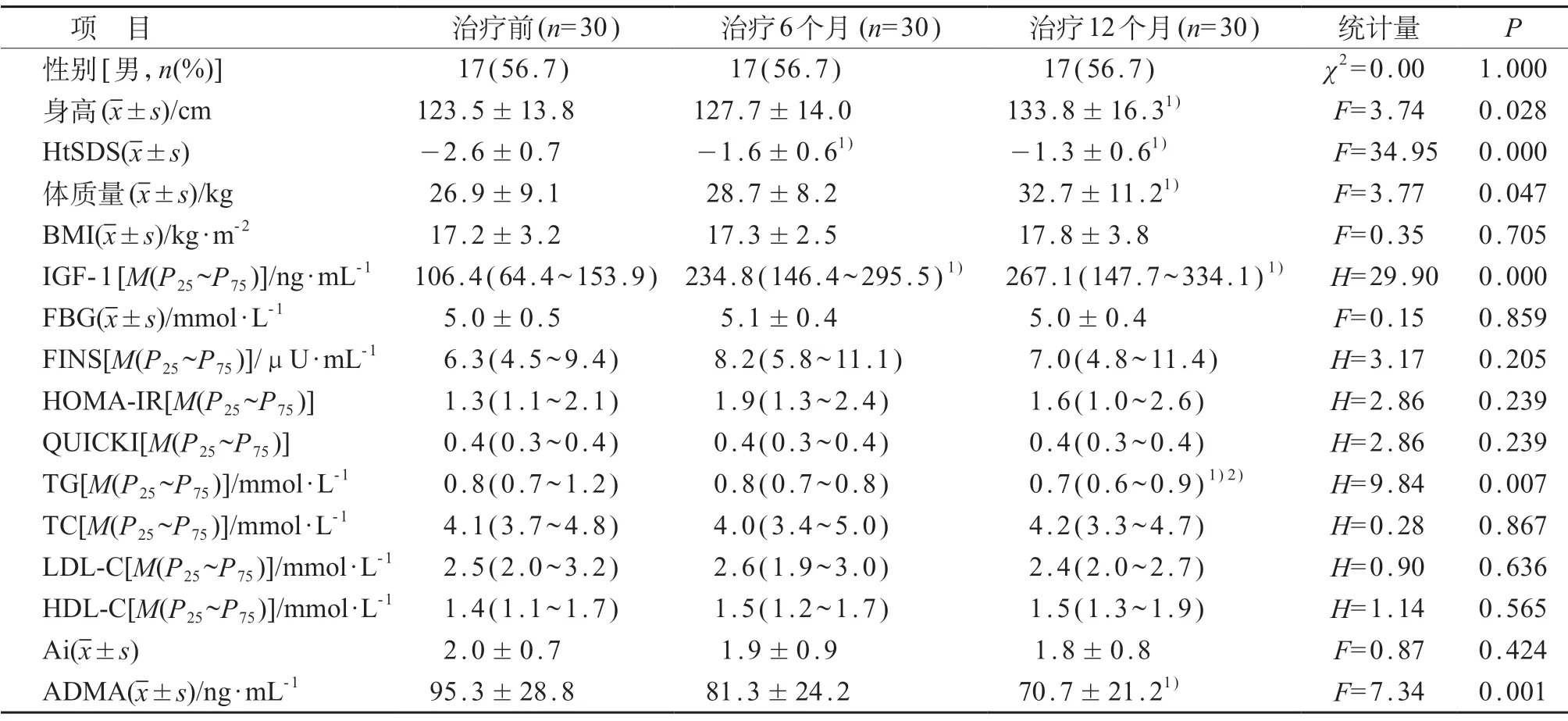
表2 rhGH治疗前后GHD组临床指标比较
治疗前,治疗6 个月、12 个月之间IGF-1、TG、ADMA水平的差异均有统计学意义(P<0.05);治疗6个月及12个月的IGF-1水平均高于治疗前,治疗12个月的TG 水平低于治疗前及治疗6 个月,治疗12 个月血浆ADMA水平低于治疗前,差异均有统计学意义(P<0.05)。见表2。
2.3 ISS组rhGH治疗前后临床指标的比较
ISS 组rhGH 治疗前,治疗6 个月、12 个月之间患儿的身高、体质量和HtSDS 差异均有统计学意义(P<0.05)。治疗6个月和12个月的HtSDS均高于治疗前,治疗12个月的HtSDS高于治疗6个月;治疗12个月后ISS患儿的身高、体质量均高于治疗前,差异有统计学意义(P<0.05)。见表3。
治疗前,治疗6 个月、12 个月之间IGF-1 和ADMA水平的差异均有统计学意义(P<0.05),治疗6个月及12个月的IGF-1水平均高于治疗前,治疗12个月ADMA水平均低于治疗前和治疗6个月,差异有统计学意义(P<0.05)。见表3。
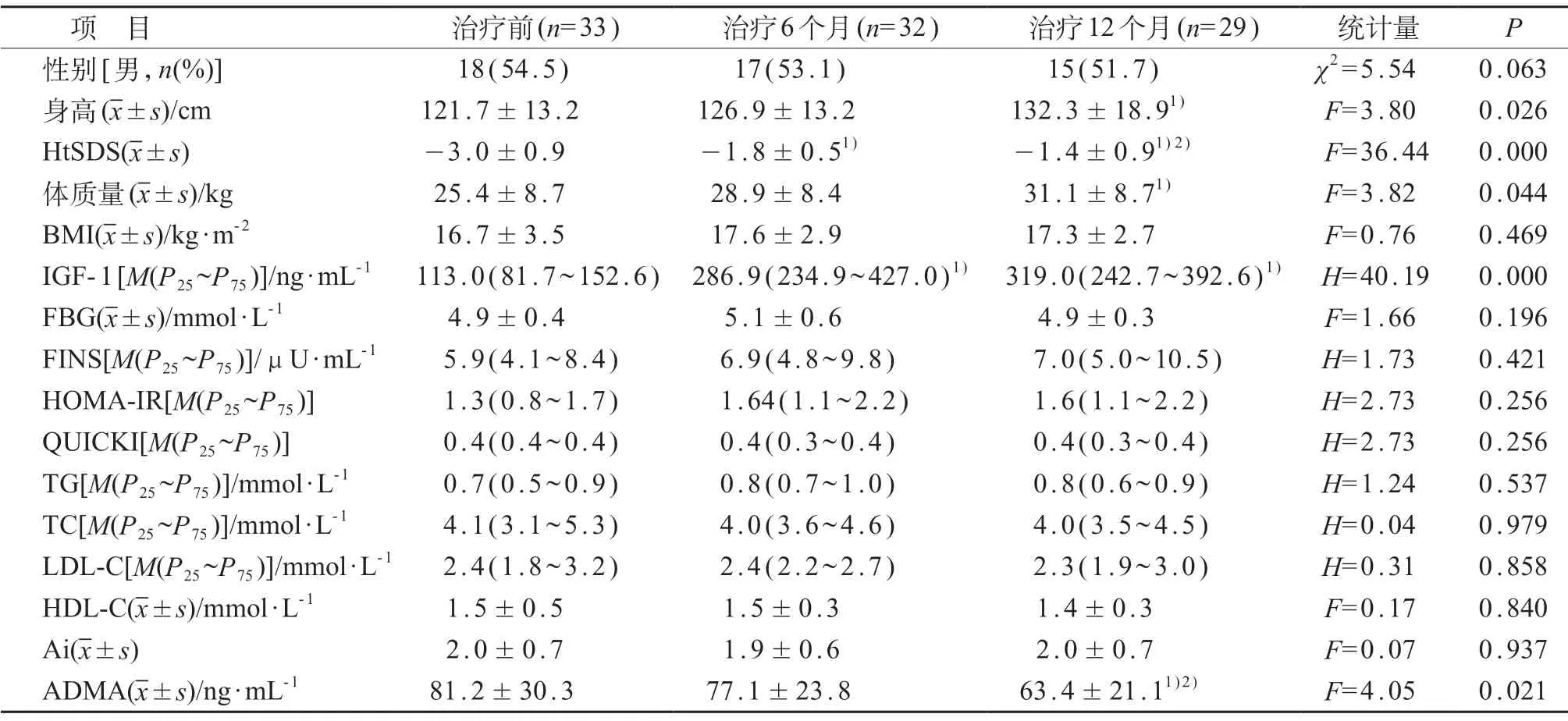
表3 rhGH治疗前后ISS组临床指标比较
3 讨论
导致儿童身材矮小的原因很多,其中GHD和ISS是临床上最常见的两种病因。GHD患儿由于体内GH水平较低,成年后发生代谢综合征、心血管疾病的风险更高[1,13]。ISS与代谢性疾病关系研究较少,临床上通过给予rhGH治疗可有效促进这两类患儿的身高增长[14-15]。ADMA 可以通过竞争性抑制一氧化氮合酶(nitric oxidase synthase,NOS)的活性,减少血管内皮NO 的合成,或通过诱导NOS 解偶联形成超氧化物,引起氧化应激[16-17],导致内皮功能失调。目前研究认为血浆ADMA水平增高与血管内皮损伤、动脉粥样硬化形成的过程有关[18-19],可作为早发性动脉粥样硬化性疾病的潜在预测指标和新的治疗靶点。
近年来rhGH对心血管疾病的影响得到广泛探讨,研究证实rhGH 治疗可改善GHD 患儿心脏质量、结构和舒缩功能,改善血管内皮功能、降低外周血管阻 力[20-21],具体机制尚不清楚。有研究发现GHD患儿血清ADMA 较相匹配的正常人群增加,rhGH 治疗可有效降低ADMA 水平,降低心血管疾病发生风险[7-8]。但也有研究发现相反结果[9]。本研究发现在三组儿童中,GHD组的ADMA水平最高,对照组最低,但仅在GHD 与对照组间的差异有统计学意义,提示GHD 的儿童未来发生动脉粥样硬化性疾病的风险更高,这与其他的研究结果一致[7,22]。同样的,针对成年GHD患者的研究也观察到ADMA 水平较健康人群增高[23],因此推测GH 缺乏可能与ADMA 升高有关。此外,本研究中,经过rhGH治疗后,GHD患儿血清ADMA水平呈下降趋势,治疗12个月后无论GHD组或ISS组与治疗前相比ADMA水平均明显降低,甚至接近健康儿童的ADMA水平。相关研究结果与本研究一致,也显示rhGH治疗6个月、12个月后GHD患儿ADMA水平降低[7-8],在成人GHD患者中应用rhGH治疗10天也观察到ADMA水平的降低[24]。提示给予rhGH治疗可有效降低血清ADMA水平,推测可能与长期心血管获益有关。然而,也有研究发现未经治疗的GHD患儿与健康儿童血清ADMA 水平相似,经过rhGH 治疗6 个月后ADMA水平较前明显升高[9],考虑与该研究样本量较小且生长激素剂量及干预时间不同有关。未来还需进行更多大样本更长时间的研究来进一步证实。
本研究也观察了三组儿童在治疗前后血脂及Ai水平的变化,显示治疗前GHD患儿的LDL-C和Ai均明显高于健康儿童,但尚在正常水平内,而ISS组与健康儿童相比血脂水平未见明显差异,表明GHD 患儿更有发生脂代谢紊乱的倾向,Ai的增高也同样证实了GHD 儿童期即有可能发生动脉硬化的改变,与之前的研究结论一致[1-2]。rhGH 治疗12 个月后GHD 患儿的TG较前显著降低,HDL-C随治疗时间呈增高趋势。相比之下ISS患儿的脂代谢在治疗前后变化并不显著。相关的研究显示rhGH 治疗后GHD 青少年的TG 明显降低[25],与本研究结果一致。此外,其他研究也有rhGH 治疗后GHD 及ISS 患儿TC、LDL、Ai 水平下降的报道[7-8,26-27]。尽管各研究治疗后血脂变化的具体表现不一致,但均表明rhGH 治疗可改善矮身材患儿尤其是GHD患儿的血脂谱,降低了动脉粥样硬化性疾病的风险。本研究还对rhGH 治疗后糖代谢指标进行了分析,发现治疗后FBG、FINS、QUICKI和HOMAIR均较治疗前无明显变化,与相关研究结果一致[28]。
关于GHD患儿ADMA增高的机制目前尚不清楚,研究发现GHD患儿氧化应激增强,会降低人体二甲基精氨酸二甲胺水解酶(dimethylarginine dimethylamino hydrolases,DDAHs)的表达,减少对ADMA 的清 除[16,29]。给予rhGH 治疗,可通过GH/IGF-1 刺激内皮细胞产生NO,诱导平滑肌松弛,降低脂质氧化,增强血管抗氧化应激能力[30];血浆DDAHs的表达也会随氧化应激的减轻而增加,ADMA的清除增强。随着ADMA的降低,其对NOS活性的竞争性抑制减轻,反过来也促进NO 的生成。此外,本研究及其他研究结果均表明rhGH治疗还可以改善矮身材儿童的血脂谱,可同样达到降低患者动脉硬化及心血管疾病发生风险的目的。
本研究也存在一些不足,首先,样本量较小,对整体代表性欠佳,今后可进行更多大样本量的长期随访性研究;其次,未对健康对照人群进行随访,治疗后矮身材儿童缺乏健康对照,因此不能完全排除年龄增长及自然生长发育过程对ADMA 水平的影响。但有研究在对健康儿童随访1 年后发现ADMA 水平较基线无明显变化[7],对青春期前及青春期的健康儿童进行比较也发现二者ADMA水平无明显差异[9],今后可对健康儿童进行同期随访观察。
综上,本研究表明矮身材儿童尤其是GHD 患儿的血浆ADMA 水平增高,使用rhGH 治疗后可降低ADMA水平,同时血脂也得到改善,降低了GHD患儿罹患心血管疾病的风险。

