十堰市部分地区魔芋腐烂病发病类型和重要致病菌
张卓然, 杨柳, 王东歧, 荆玉玲, 王巍,郭荣君*, 肖能武, 向世标, 李世东
(1.中国农业科学院植物保护研究所,北京100193; 2.湖北省十堰市农业科学院,湖北 十堰 442000)
魔芋(Amorphaphalluskonjac)为多年生草本植物,属于天南星科魔芋属,喜温暖潮湿和荫蔽的环境,主要分布在东南亚和非洲[1]。我国主要在湖南、湖北、云南、四川及陕西等地栽培。魔芋在整个生长期和贮藏期都可能出现腐烂病,感染后块茎及其茎叶变软、腐烂,叶片变黄,茎秆易弯曲,植株倒伏。球茎染病,表皮出现水渍暗褐色病斑,随后逐渐扩大向内扩展,果肉粘稠变软呈黑褐色[2-4]。魔芋一般在6月下旬开始发病,7、8月由于高温多雨,空气和土壤湿度高,是魔芋软腐病发生的高峰期,9月随气温下降发病率也逐渐降低[5]。魔芋软腐病是一种细菌性病害,主要由胡萝卜软腐果胶杆菌胡萝卜软腐亚种(Pectobacteriumcarotovorasubsp.carotovora)引起[6]。生产上报道白绢病菌也可导致魔芋腐烂[7]。吴金平[8]还分离到一株肠杆菌科细菌,也会导致魔芋软腐。
湖北十堰市位于亚热带湿润季风气候区,是理想的魔芋种植地[9],从低山平原到高山都有魔芋生长。随着魔芋产业的发展,魔芋种植面积逐渐扩大,规模化及常年连作导致魔芋腐烂病发生加重、传播快、防治难,严重制约魔芋产业发展[10]。生产上需采用的晒种、种芋处理等技术虽然可缓解魔芋腐烂病的发生,但魔芋发病仍然很重。调查发现,十堰市魔芋腐烂病除软腐型外[6],还存在其他病原引起的腐烂。明确十堰市不同地区魔芋腐烂病的发病类型和主要致病菌对该病害的防控具有重要的指导意义。
项目组对十堰市部分地点魔芋地块的耕作措施、种植环境进行了调查,采集生长期不同发病症状的魔芋进行病原菌的分离,并根据细菌的16S rRNA基因序列分析结果对菌株进行初步鉴定,发现分离到的魔芋腐烂病菌与样品来源和样品的发病类型密切相关,研究结果为魔芋腐烂病的防控提供了依据。
1 材料与方法
1.1 材料
1.1.1培养基 1/2 King′S B培养基:蛋白胨10.0 g、甘油5.0 g、磷酸氢二钾0.75 g、硫酸镁0.75 g、琼脂18.0 g、蒸馏水1 L,pH 7.2。
1/2 PDA培养基:马铃薯100.0 g、葡萄糖10.0 g、琼脂18.0 g、蒸馏水1 L。
加抗1/2 PDA培养基:在1/2 PDA培养基中加入氨苄青霉素钠,浓度为50 μg·mL-1。
LB培养液:胰蛋白胨10.0 g、酵母提取物5.0 g、氯化钠5.0 g、蒸馏水1 L,pH 7.0。
磷酸缓冲液:KH2PO41.0 g、(NH4)2SO41.0 g,去离子水定容至1 000 mL,pH 5.5。
1.1.2试剂 1%~2%次氯酸钠溶液、30%甘油用纯甘油配制;溶菌酶购自北京大宏利辉生物科技中心;1.1×T3 Super PCR Mix购自北京擎科生物科技有限公司;细菌基因组DNA提取试剂盒(DP302-02)购自天根生化科技(北京)有限公司。
1.2 样品采集
于7月16日—19日魔芋发病初期,调查了十堰市柳陂、谭家湾、周家洼、郧西乡四个地点的魔芋发病情况,采集发病植株,记录其发病症状、前茬作物、种芋品种、栽培措施以及发病率等。另取部分种芋种植于中国农业科学院植物保护研究所(植保所)盆栽沙土中,于7月26日—8月7日采集发病植株。病样相关信息列于表1。

表1 发病魔芋样品采集
1.3 病原菌的分离和纯化
1.3.1茎秆汁液涂抹法 茎秆表面用1%~2%的次氯酸钠溶液冲洗30 s,再用无菌水冲洗3次,滤纸吸干水分,刮除表皮,从切开的横截面挤出汁液,涂抹于1/2 King′S B平板上,28 ℃培养3 d。三区划线法纯化细菌,肉眼观察单菌落形态并记录。
1.3.2组织块分离法 取病健交界处的茎杆组织或者块茎组织,在1%~2%的次氯酸钠溶液中浸泡30~90 s,无菌水漂洗3次共2 min,滤纸吸干水分。将部分组织块在1/2 King′S B平板上涂抹,28 ℃培养3 d;部分组织块放置于加抗的1/2 PDA平板上,26 ℃培养3~4 d。经划线纯化后,观察单菌落形态。菌株经划线纯化后,保存于30%甘油中,贮存于-20 ℃。切取1/2 PDA平板上生长的真菌边缘菌丝转接于加抗1/2 PDA平板上,纯化后保存于30%甘油中,贮存于-20 ℃。
1.3.3不同地点病原菌的分离频率统计 根据单菌落的颜色、形状、透明度、光滑度、色素、大小等特征进行分类归纳,统计有效菌株。根据症状将魔芋腐烂病划分为n种类型,统计各症状样品分离的每种菌株的平均分离频率。计算公式如下。
(1)
式中,fi为平均分离频率,Sn为具有每种症状的所有样品分离的有效菌株总数,Sni为每种有效菌株的数量,i代表有效菌株编号。
1.4 细菌的16S rRNA基因序列分析
挑取单菌落于装有1 mL LB培养液的1.5 mL的离心管中,28 ℃、180 r·min-1振荡培养14~18 h,10 000 r·min-1离心1 min,弃上清液,加入110 μL TE溶液和70 μL溶菌酶,37 ℃放置40 min。利用天根细菌基因组DNA提取试剂盒提取细菌DNA,-20 ℃保存备用。
以细菌基因组DNA为模板,采用通用引物27F(5′-AGAGTTTGATCATGGCTCAG-3′)和1492R(5′-ACGGTTACCTTACCTTGTTACGACTT-3′)[11]扩增待测细菌的16S rRNA基因序列。PCR反应体系:DNA模板5 μL,引物各2 μL,1.1×T3 Super PCR Mix 41 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性45 s,55 ℃退火40 s,72 ℃延伸90 s,共32个循环;72 ℃延伸10 min,产物保存在4 ℃备用。扩增产物用1% 琼脂糖凝胶电泳,120 V、20 min,点样量4 μL,并设置阴性对照。将扩增产物送诺赛公司测序,测序结果在NCBI进行同源序列比对分析。
1.5 优势细菌B12、B13的致病性测定
选取优势细菌中可能的致病菌分离株B12和B13测定致病性。将两菌株的单菌落分别接种于装有100 mL LB培养液的三角瓶中,28 ℃、180 r·min-1培养12~18 h至OD值0.6。培养液4 ℃、10 000 r·min-1离心10 min,去上清,用磷酸缓冲液悬浮,计数,调节细菌浓度为108cell·mL-1,将悬液保存于4 ℃备用。
选取设施大棚避雨栽培模式下未种植过魔芋的田块,种芋采用47%春雷王铜可湿性粉剂500倍与80%代森锰锌可湿性粉剂1 000倍混和液消毒处理后播种。于魔芋幼苗期,选取长势相近的健康魔芋测定细菌致病性。将制备的菌悬液稀释100倍,每株苗浇300 mL,每个菌株接种30株魔芋,以浇灌清水为对照,设置3次重复。于接种后3周、5周分别进行魔芋发病症状和发病率调查。
1.6 利用特异引物对致病菌进行鉴定
在1.4细菌16S rRNA基因测序基础上,采用胡萝卜果胶杆菌特异性引物EXPCCF/EXPCCR[12]对试验中分离获得的7种细菌(9个分离株)的 DNA进行PCR扩增。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1.5 min,共30个循环;72 ℃延伸5 min,4 ℃保存。120 V电泳20 min检测其特异性。
1.7 数据统计
采用Excel软件进行数据整理和统计。
2 结果与分析
2.1 魔芋样品采集和发病症状调查
从十堰市郧西乡、周家洼、谭家湾和柳陂基地的魔芋种植地块以及植保所盆栽魔芋苗共采集魔芋病株28株(表2),其中21株具有细菌性病害症状;3株具有典型的白绢病症状(LB-1、LB-2、LB-5);4株具有细菌和真菌复合侵染特征(YX-6、YX-8、YX-9、ZJW-1),块茎表面有白色菌丝,茎基部或茎秆腐烂。所有发病症状可分为茎基环状软腐型、黄化茎基黑烂型、黄化茎黑裂型、黄化茎干软型、黄化茎基外黑内红型、茎上部或整株黒烂型六种类型(表2)。
2.2 病原菌的分离纯化
从采集的28株发病魔芋中选取具有典型症状的18株样品进行病原菌分离纯化,共获得94株细菌。根据细菌的单菌落形态特征,将分离到的细菌菌株归纳为48种。细菌菌落大小约在0.5~4.0 mm之间。菌落颜色有4种,其中B1、B2菌落呈黄白色,B3~B6菌落呈金黄色,B7菌落呈橘黄色,B8~B17菌落呈乳白色;除B2、B4~B6细菌菌落呈半透明外,其余菌落均不透明;除B7、B13、B14菌落明显凸起外,其余均稍凸起;B9、B10、B12、B15~B17细菌不产生色素,其余均可产生色素,其中B1~B7以及B11、B13细菌产生黄色色素,B8和B14细菌分别产生褐色和金黄色色素。排除单次出现的菌株,共有17种有效菌株用于分离频率的统计。
从样品LB-1(表2)病株茎基部收集到的菌核经抗生素溶液消毒后,转接到加抗生素的1/2 PDA培养基上,1 d即可长出白色菌丝,菌丝生长迅速,3~5 d后形成褐色的菌核(图1A),其菌核和菌落形态同齐整小核菌Sclerotiumrolfsii。从样品YX-3、YX-6、ZBS-2、ZBS-3和ZBS-4球茎内部组织仅分离到一种真菌(图1B),菌丝白色、卷曲、羊毛状、不丰富,显微镜下观察可见镰刀型孢子(图1C),因此将其鉴定为镰刀菌,说明这些病株侵染菌可能为镰刀菌。
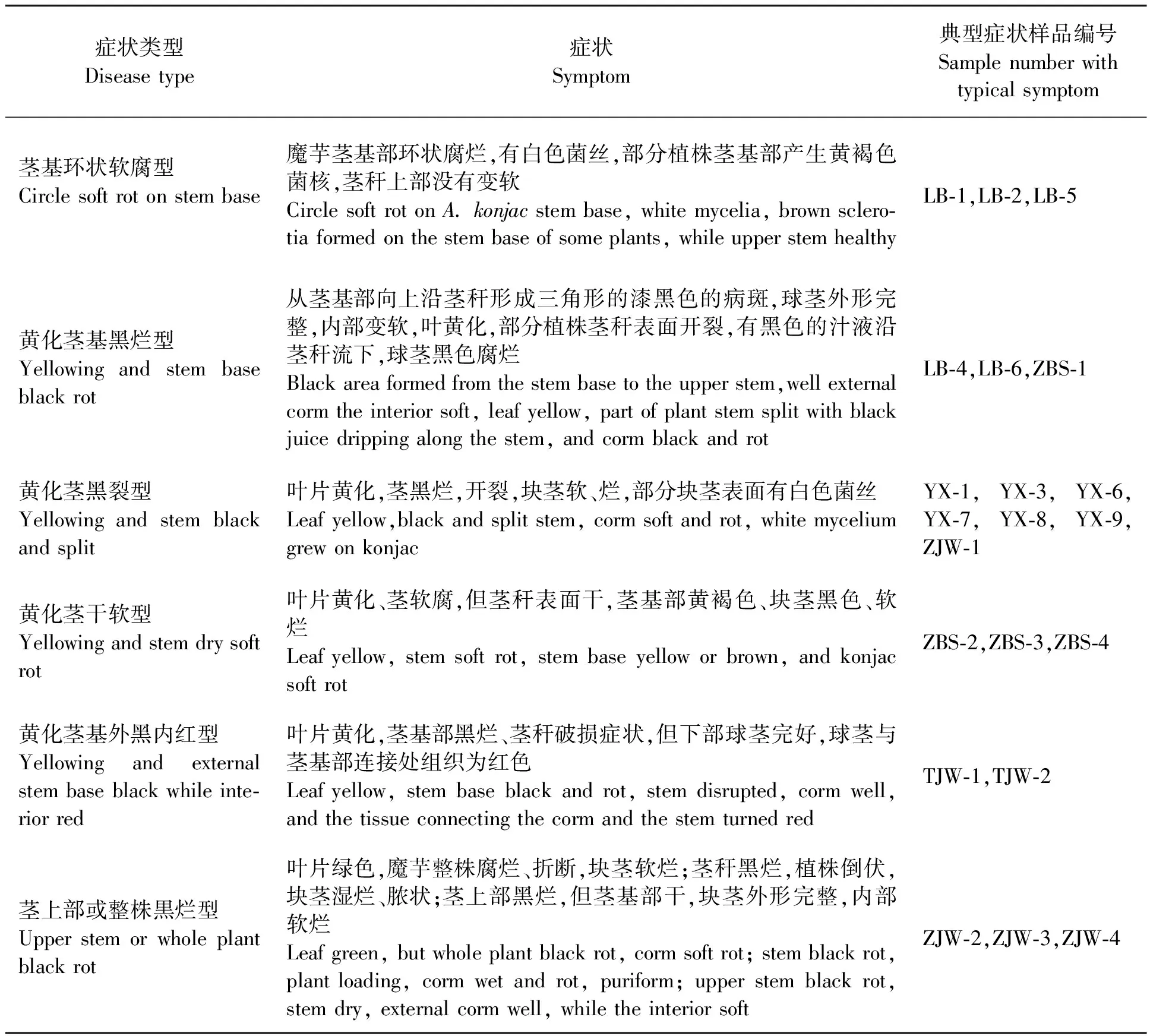
表2 不同地点魔芋腐烂病的典型症状
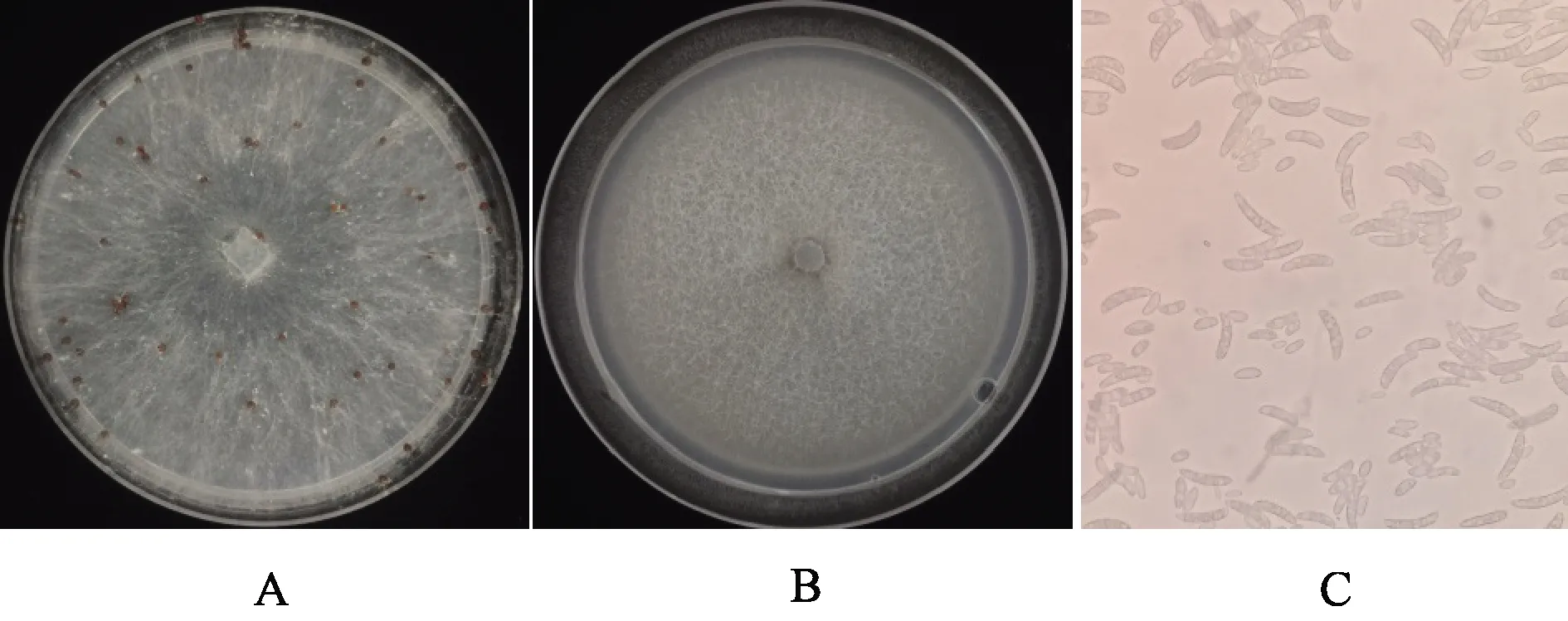
注:A为齐整小核菌菌落形态,B、C分别为镰刀菌的菌落形态和分生孢子形态。
2.3 细菌分离株的分离频率与鉴定
根据魔芋发病的典型症状,结合对应样品分离的有效菌株,计算所有菌株的平均分离频率。根据细菌的16S rRNA基因序列分析结果(GenBank登录号:MN874164-874180)对细菌菌株进行初步鉴定(表3)。

表3 不同细菌分离株的分离频率与16S rRNA类别
根据16S rRNA基因序列分析结果,将相同序列的菌株合并进行重新归类,并对合并后的11种菌株的平均分离频率进行统计。结果(图2)表明:胡萝卜软腐果胶杆菌(Pectobacteriumcarotovorumsubsp.carotovorum)(菌株B12、B16、B17)、嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)(菌株B4、B5、B6)、产酸克雷伯菌(Klebsiellaoxytoca)(菌株B13、B14)和Corticimicrobacterpopuli(菌株B10、B15)的平均分离频率较高,分别为27.6%、17.6%、12.1%和10.8%。
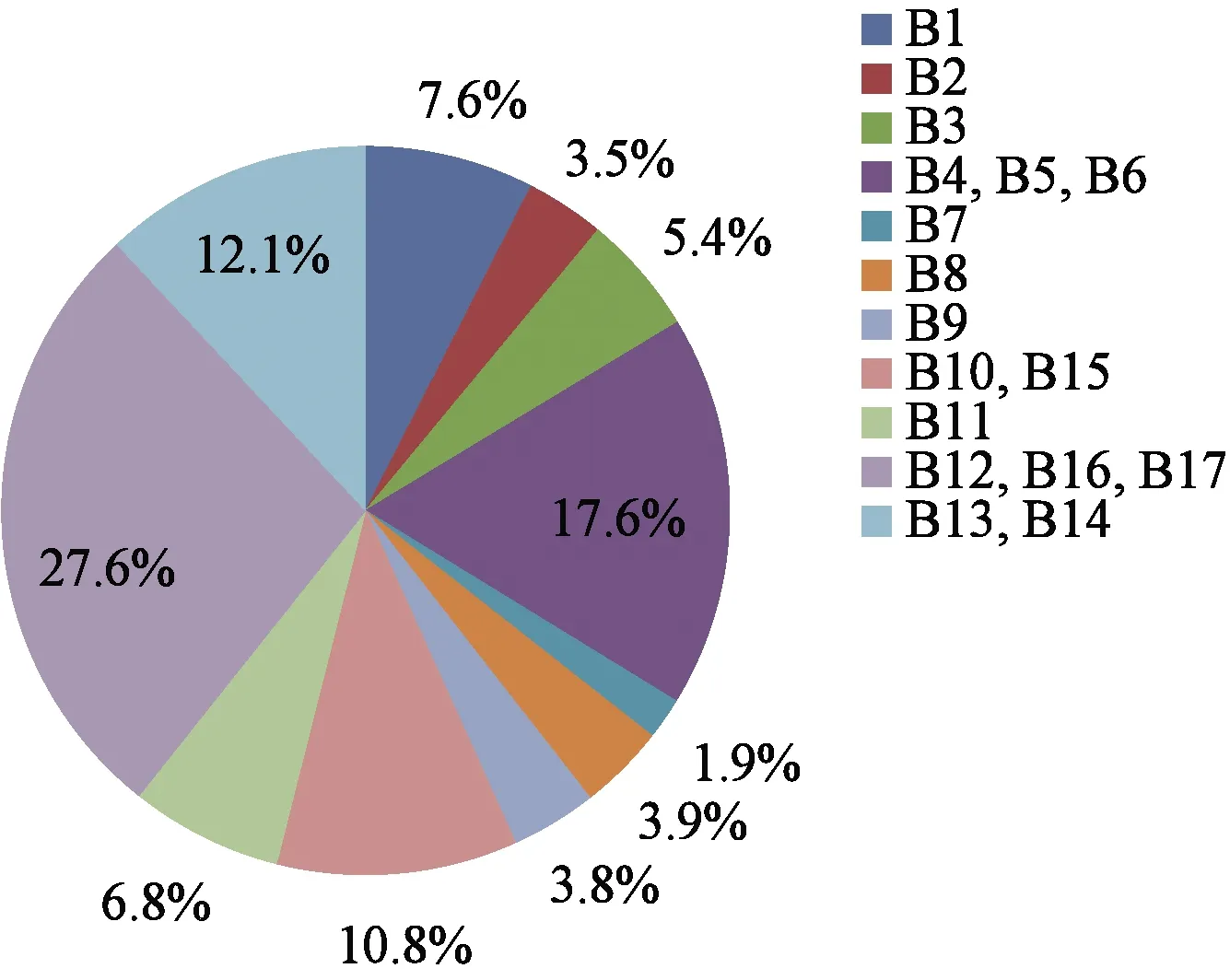
图2 11种细菌分离株的分离频率
2.4 魔芋发病症状与细菌分离频率和样品采集地关系
不同地块魔芋发病症状、病原菌的分离频率有所不同(图3)。柳陂主要发病类型为黄化茎基黑烂型和茎基环状软腐型,其中从黄化茎基黑烂型病样中分离到的主要为细菌,P.carotovorumsubsp.carotovorum为优势细菌,分离频率高达62.5%;而茎基环状软腐型的病原菌主要为齐整小核菌S.rolsfii,茎基环状软腐的发生可能与柳陂土壤本身带菌或者种芋下铺垫芝麻秸秆有关。郧西土壤和植保所盆栽土为沙土,而且郧西为避雨栽培模式,因而这两个地点的发病率较低。这两个地点的发病症状也不同于其他地点,分别为黄化茎黑裂型和黄化茎干软型,均存在镰刀菌和细菌的复合侵染。但两地分离到的优势细菌不同,郧西的优势细菌为S.maltophilia和P.carotovorumsubsp.carotovorum,植保所的优势细菌为P.carotovorumsubsp.carotovorum和K.oxytoca,说明不同环境条件下镰刀菌和不同细菌复合侵染产生的病症不同,可能与这两个地点的土壤为沙土有关。谭家湾的发病植株主要为黄化茎基外黑内红型,优势细菌为P.carotovorumsubsp.carotovorum和C.populi,分离频率分别高达 60.0%和30.0%;周家洼的发病类型主要为茎上部或整株黒烂,优势细菌为S.maltophilia和P.carotovorumsubsp.carotovorum。从这两个地点分离到人类的机会病原,且植株腐烂度高,可能与这两个地点均施用了未腐熟的农家肥或沼肥有关。
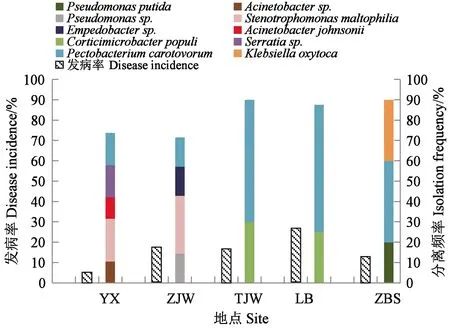
图3 不同地区的细菌分离频率与魔芋发病率
2.5 细菌分离株的致病性
两株待测细菌对魔芋的致病性不同。胡萝卜软腐果胶杆菌B12菌悬液浇灌处理后,魔芋发病率最高,接种菌悬液3周后发病率已达60%,5周后发病率达到了80%(表4)。发病症状为:茎秆从基部开始发黑、软、折,随后整株腐烂,为典型的魔芋软腐病的发病特征。产酸克雷伯菌B13菌株的菌悬液接种后魔芋发病率与清水对照处理未达到极显著水平。综合以上结果,确认B12菌为魔芋腐烂病的致病菌。

表4 两株优势细菌菌悬液浇灌魔芋幼苗后的发病率
2.6 软腐病菌特异性鉴定
在供试的7种细菌9个分离株中,利用特异性引物EXPCCF/EXPCCR只能从鉴定为胡萝卜软腐病菌(P.carotovorumsubsp.carotovorum)的B12、B16 和B17基因组DNA中扩增到大小为550 bp左右的特异性DNA条带(图4),进一步证明这三个分离株为胡萝卜软腐病菌。

注Note:M—Marker, 2 000 bp;1—Acinetobacter sp.;2—Stenotro-phomonas sp.;3—Empedobacter sp.; 4—Pseudomonas sp.; 5—Serratia sp.; 6—Klebsiella oxytoca; 7—ddH2O; 8~10—P. carotovorum subsp.carotovorum.
3 讨论
魔芋腐烂病是十堰市魔芋生产中的重要病害,人们常将魔芋腐烂病和魔芋软腐病混淆,统称为魔芋软腐病。前人研究多关注魔芋腐烂病的发病率和病原菌的种类,很少有研究注意魔芋生长地的环境条件、栽培措施与魔芋腐烂病发生之间的关系。本研究对湖北省十堰市魔芋腐烂病的病原菌分离和致病性测定结果表明:胡萝卜软腐果胶杆菌(P.carotovorumsubsp.carotovorum)是十堰市魔芋腐烂病的重要致病菌,与前人有关魔芋细菌性软腐病原菌的研究报道一致[13-16];此外,还发现齐整小核菌和镰刀菌也是魔芋腐烂的重要致病菌(图2),与细菌存在复合侵染。如:郧西和植保所发病魔芋为镰刀菌和细菌的复合侵染。因两地所使用的种芋相同,而植保所使用的盆栽土为未种植过作物的沙土,因此推测镰刀菌是由种芋携带的,生产中应加强种芋消毒。本研究的致病性测定采用47%春雷王铜可湿性粉剂和80%代森锰锌可湿性粉剂对种芋进行消毒处理,对照魔芋发病率较低(9.38%),说明所使用的种芋消毒药剂可以有效控制魔芋腐烂病的发生,因而建议生产中使用新型复配杀菌剂进行种芋消毒以提高魔芋腐烂病的防控效果。柳陂的魔芋腐烂主要为齐整小核菌和细菌的复合侵染导致。齐整小核菌可能是由于种植时铺垫芝麻秸秆造成的。王雅等[17]曾报道,引起芝麻白绢病的病原菌为齐整小核菌Sclerotiumrolfsii,该病原菌可侵染多种植物,提示一定要注意栽培措施、种植土壤中病原真菌S.rolfsii的监测,在防控措施上可采用土壤深翻、高起垅、及时排除积水等措施减轻病害的发生[18]。
胡萝卜软腐果胶杆菌(P.carotovorumsubsp.carotovorum)是一种具有鞭毛的细菌,土壤湿度大、雨水多会加重病害的发生[2-3]。研究中五个采样点的发病率从高到低依次为柳陂>周家洼>谭家湾>植保所>郧西。郧西和植保所发病率低可能与栽培土壤和栽培措施有关。这两个地点的栽培土壤均为沙土,而且郧西为避雨栽培模式,土壤水分少,栽培过程中没有雨水的冲刷,从而减少了病原菌的传播和侵染,减轻了病害的发生。其他三个地点均为粘土,土壤湿度大,增加了病原菌的侵染。因此魔芋腐烂病防控中要加强水分管理,应及时排水,避免田间积水而加重病害的发生。此外,从周家洼、郧西重病样中除分离到Pectobacterium外,还分离到多种其他细菌,如Pseudomonassp.(B3)、Empedobactersp.(B7)、Stenotrophomonasmaltophilia(B4、B5)。从有臭味的样品ZJW-2中还分离到了Serratiasp.。这些细菌的存在可能与采集的样品发病严重或与周家洼农民种植的魔芋地施用了有机肥,田块不平整,积水严重有关。有报道假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、短稳杆菌属(Empedobacter)和沙雷氏菌属(Serratia)对某些植物具有致病性[19-20],提示需要注意使用腐熟的肥料,避免因农耕措施不当造成病害加重。

