农用植物酵素液中梨树腐烂病菌拮抗细菌的筛选和防病效果
郁帆, 冯莹, 韩剑,2, 盛强, 孙丽英, 罗明,2*
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆维吾尔自治区高校农林有害生物监测与安全防控重点实验室,乌鲁木齐 830052;3.新疆巴音郭勒蒙古自治州农业科学研究院,新疆 库尔勒 841003;4.西北农林科技大学植物保护学院,陕西 杨凌 712100)
库尔勒香梨(简称香梨)(Pyrussinkiangensi)是一个地域性极强的地方特色品种,主要分布在新疆巴州库尔勒和阿克苏地区,是新疆林果产业的重要组成部分。随着香梨产业的发展、种植规模的扩大和栽培模式的改变,多种病害相继发生,成为影响香梨生产的突出问题[1]。由梨黑腐皮壳菌(Valsapyri)引起的梨树腐烂病是梨树栽培生产中最重要的真菌病害之一,在国内梨主产区均有分布,尤其在香梨上危害最为普遍且严重,重病园病株率高达77.8%~100%[2]。在梨树结果期持续低温、冻害或夏季高温、干燥及管理不当等导致树势衰弱会加重病害发生,造成树皮腐烂、枝干溃疡或干枯、大量果树死亡甚至毁园。随着树龄的增加,腐烂病逐年加重,严重威胁香梨产业的健康发展[3]。
梨树腐烂病主要通过刮除病斑、喷施或涂抹化学农药进行防治。目前国内尚无防治梨树腐烂病的专用药剂,生产上常用石硫合剂、腐植酸铜、甲基硫菌灵和甲硫萘乙酸等化学药剂进行防治,但使用后病斑复发率仍达20%~30%,病害难以根除[4]。当前生产中农药使用次数增多,乱施滥用问题突出,不可避免地造成病原菌抗药性增加、果品农药残留超标和环境污染等一系列问题,因此,生物防治是现代林果生产发展的必然选择。发掘对病原菌具有抑菌作用的有益微生物,利用其活体及其活性物质研制成生物菌剂防治植物病害,选择性强且病原菌不易产生抗药性,具有安全高效、环境友好等突出优势。利用生防菌防治果树腐烂病国内外开展了一些研究,但多数研究围绕着苹果腐烂病的防控展开,集中于从果树和药用植物内生菌、果树根际和果园土壤微生物中筛选腐烂病病原菌的拮抗菌,如娄彻氏链霉菌(Streptomycesrochei)、埃及青霉(Penicilliumegyptiacum)[5]、螺旋毛壳(Chaetomiumspirale)[6]、极长链霉菌(Streptomyceslongissimus)[7]、枯草芽孢杆菌(Bacillussubtilis)[8]、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)[9]等,在抗菌机理、拮抗菌发酵条件优化、室内毒力和田间防效试验等方面取得了一定研究成果[10]。但有关梨树腐烂病的生物防治研究鲜见报道。
农用植物酵素是利用蔬菜、药用植物、水果、果皮、果渣和农业废弃物等多种植物源材料为主要原料加入糖(蜜)和水,经天然发酵或接种菌剂发酵制成的微生物制品。酵素发酵技术于20世纪90年代由日本引入我国。在种植业生产中的应用实践表明,农用植物酵素将有机废弃物资源化利用,且制作简单、成本低廉、安全环保,在农作物、蔬菜、果树上叶喷或根施具有活化植物营养、改良土壤结构、促进植物生长、提高产量、改善品质等突出功效,展现了其良好的应用价值与推广前景[11]。近年来,酵素液对植物病虫害的生物防治作用得到人们的关注。酵素液中的抗菌活性成分对植物土传病害和叶面病原菌具有明显的抑制作用,可显著提高作物抗病害能力[12],表现出良好的应用潜力。本研究针对梨黑腐皮壳菌,以前期从各种农用植物酵素液中分离出的酵素细菌为材料,从中筛选具有较强抑菌活性的拮抗菌株,明确其抑菌作用方式,测定其防病效果,为发掘生防资源、安全防控梨树腐烂病提供科学基础,对于促进梨产业的健康可持续发展具有重要的意义。
1 材料与方法
1.1 材料
1.1.1酵素液细菌 本课题组在前期研究中从新疆库尔勒市阿瓦提乡、哈拉玉宫乡等地采集农户以各种果蔬、中草药植物(香梨、苹果、西瓜、甜瓜、甘草、蒲公英、香葱、大葱等)为原料自制的酵素发酵液,采用稀释平板分离法从中分离、纯化出68个细菌菌株。
1.1.2病原菌 梨黑腐皮壳菌(Valsapyri)菌株XJ005由新疆农业大学林学与园艺学院林木病理学实验室从库尔勒香梨腐烂病病样中分离、鉴定并保存,经测定为强致病力菌株。
1.1.3培养基 营养琼脂培养基(NA)、营养肉汤培养基(NB)、马铃薯葡萄糖培养基(PDA)。
1.2 梨黑腐皮壳菌拮抗菌株筛选
1.2.1拮抗菌的初筛 采用平板对峙培养法进行拮抗菌的初筛。将活化好的梨黑腐皮壳菌接种于PDA平板,25 ℃恒温培养5 d后用灭菌打孔器沿菌落边缘取直径约6 mm的菌饼,接种在PDA平板(直径90 mm)中央,再将待筛选的细菌菌株点接于距平板边缘20 mm处等距离的上、下、左、右4个位置,以只接种梨黑腐皮壳菌的平板作为对照,每菌株重复测定3皿,置于25 ℃培养箱培养,待对照组菌落长满平板,观察并记录有无抑菌圈产生并用十字交叉法测量处理病原菌菌落直径,计算抑菌率。试验重复3次,初筛出对梨黑腐皮壳菌有明显拮抗作用的细菌菌株。
1.2.2拮抗菌的复筛 ①拮抗菌发酵液的制备:将初筛拮抗菌株在NA平板上活化后,用接种环移取一环接入装有50 mL NB培养液的250 mL三角瓶中,150 r·min-1、28 ℃恒温振荡培养1~2 d,至细菌发酵液OD600为0.8~1.0。
②发酵液抑菌作用测定:滤纸片法。在PDA平板中央接种直径为6 mm的病菌菌饼,在距培养皿边缘20 mm处上、下、左、右4个位置放置直径为5 mm的灭菌滤纸片,每纸片滴加5 μL初筛拮抗菌的发酵液,以加入5 μL NB培养液的处理作为对照,每处理重复3皿,25 ℃暗培养3 d后十字交叉法测量病原菌菌落直径(mm),计算抑菌率。
抑菌率=[(对照病原菌菌落直径-处理病原菌直径)/(对照病原菌直径-6)]×100%
(1)
③除菌发酵滤液的抑菌作用测定:牛津杯法。将初筛拮抗菌株发酵液在4 ℃条件下10 000 r·min-1离心20 min,收集上清液,经0.22 μm微孔滤膜过滤除菌,得到除菌发酵滤液。抑菌作用的测定用滤纸片法。
1.3 梨黑腐皮壳菌孢子萌发率测定
1.3.1梨黑腐皮壳菌孢子萌发率测定 在香梨果园采集腐烂病发病枝条,切取带有梨黑腐皮壳菌分生孢子器的树皮组织保湿,待分生孢子角溢出后,以香梨果实煎汁为培养液,制备成浓度为106个·mL-1的孢子悬浮液。将拮抗菌发酵液或除菌发酵滤液与孢子悬浮液各取25 μL滴在载玻片中央,并置于装有1%水琼脂的培养皿中密封,以灭菌培养基与孢子悬浮液混合为对照,每处理3个重复。25 ℃恒温保湿,分别于12、24和36 h后显微镜下观察记录孢子萌发情况,计算孢子萌发抑制率。
孢子萌发抑制率=[(对照孢子萌发率-处理孢子萌发率)/(对照孢子萌发率)]×100%
(2)
1.3.2梨黑腐皮壳菌菌丝生长观察 将活化的梨黑腐皮壳菌菌饼接种于PDA平板中央,拮抗菌株点接于四周,25 ℃恒温对峙暗培养,以未接种拮抗菌的梨黑腐皮壳菌菌丝作为对照。观察拮抗菌菌落和梨黑腐皮壳菌菌落之间产生的抑菌带,5 d后挑取抑菌圈边缘的梨黑腐皮壳菌菌丝,在光学显微镜(LWD300-38LFT)下观察其形态变化并拍照。
1.4 离体枝条法测定拮抗菌株对腐烂病的防效
在库尔勒市香梨果园采集香梨树当年生枝条,剪取粗细一致、长30 cm的枝段,无菌水冲洗三次后用75%乙醇溶液浸泡5 min,晾干,两端封蜡防止水分散失。用手术刀切出直径为5 mm的圆形伤口,取一小块(约1 cm2)灭菌的脱脂棉蘸取1 mL拮抗菌发酵液(OD600=0.8~1.0)或不同稀释倍数的除菌发酵滤液贴在伤口部位,用保鲜膜包裹保湿,24 h后再接种新鲜培养的梨黑腐皮壳菌菌饼(Ф=5 mm)1块,每个枝条2个接种点,重复5个枝条。同法设置先用灭菌的脱脂棉蘸取1 mL无菌培养基贴敷枝条伤口,保湿24 h后再接种梨黑腐皮壳菌菌饼的处理为对照。将处理后的枝条放置在塑料托盘中,盘底铺有加无菌水的灭菌吸水纸,盘口覆盖保鲜膜保湿,于25 ℃恒温培养箱中培养,观察记录腐烂病的发生情况。7 d后测量病斑大小并按照公式计算病斑面积,统计防治效果。
病斑面积=π×病斑长边半径×病斑短边半径
(3)
防治效果=[(对照病斑面积-处理病斑面积)/对照病斑面积]×100%
(4)
1.5 拮抗菌株的鉴定
1.5.1形态及生理生化特征鉴定 参照《常用细菌系统鉴定手册》[13]和《伯杰细菌鉴定手册》[14]进行形态及生理生化特征测定。将拮抗菌株划线接种于NA培养基,28 ℃培养24 h,观察并描述菌落形态特征。革兰氏染色观察菌体形态及染色反应;芽孢染色观察芽孢形状及着生位置。采用北京陆桥技术股份有限公司的微量生化鉴定管测定菌株的VP、MR、H2S、硝酸盐还原、葡萄糖产气、接触酶、氧化酶、淀粉水解、明胶液化、丙二酸盐、吲哚试验反应及对乳糖、木糖、果糖和甘露糖等碳源的利用。
1.5.216S rRNA和gyrA基因序列测定及系统树发育分析 以细菌基因组柱式提取试剂盒(天根)提取的基因组DNA为模板进行扩增,16S rRNA的上、下游引物分别为27F:5′-AGAGTTTGATCCTG-GCTCAG-3′和1492R:5′-CTACGGCTACCTTG-TTACGA-3′,gyrA基因的上、下游引物分别为F:5′-CAGTCAGGAAATGCGTACGTCCTT-3′和R:5′-CAAGGTAATGCTCCAGGCATTGCT-3′。PCR反应体系为50 μL:模板DNA、Taq聚合酶和dNTPs各1 μL,上、下游引物各1.5 μL,10×Buffer 5 μL,ddH2O 39 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃终延伸7 min。PCR产物用AxyPrep DNA凝胶回收试剂盒回收,回收产物经1%琼脂糖凝胶检测后提交上海生工生物工程有限公司完成测序。测序结果在GenBank中进行同源性比对,利用MEGA 5.05软件以邻接法构建系统发育树。
2 结果与分析
2.1 农用植物酵素液细菌对梨黑腐皮壳菌的抑菌作用
通过平板对峙,从分离于各种植物酵素液的68株细菌中初筛出15株对梨黑腐皮壳菌具有拮抗作用的菌株,抑菌率为41.25%~74.14%(表1)。
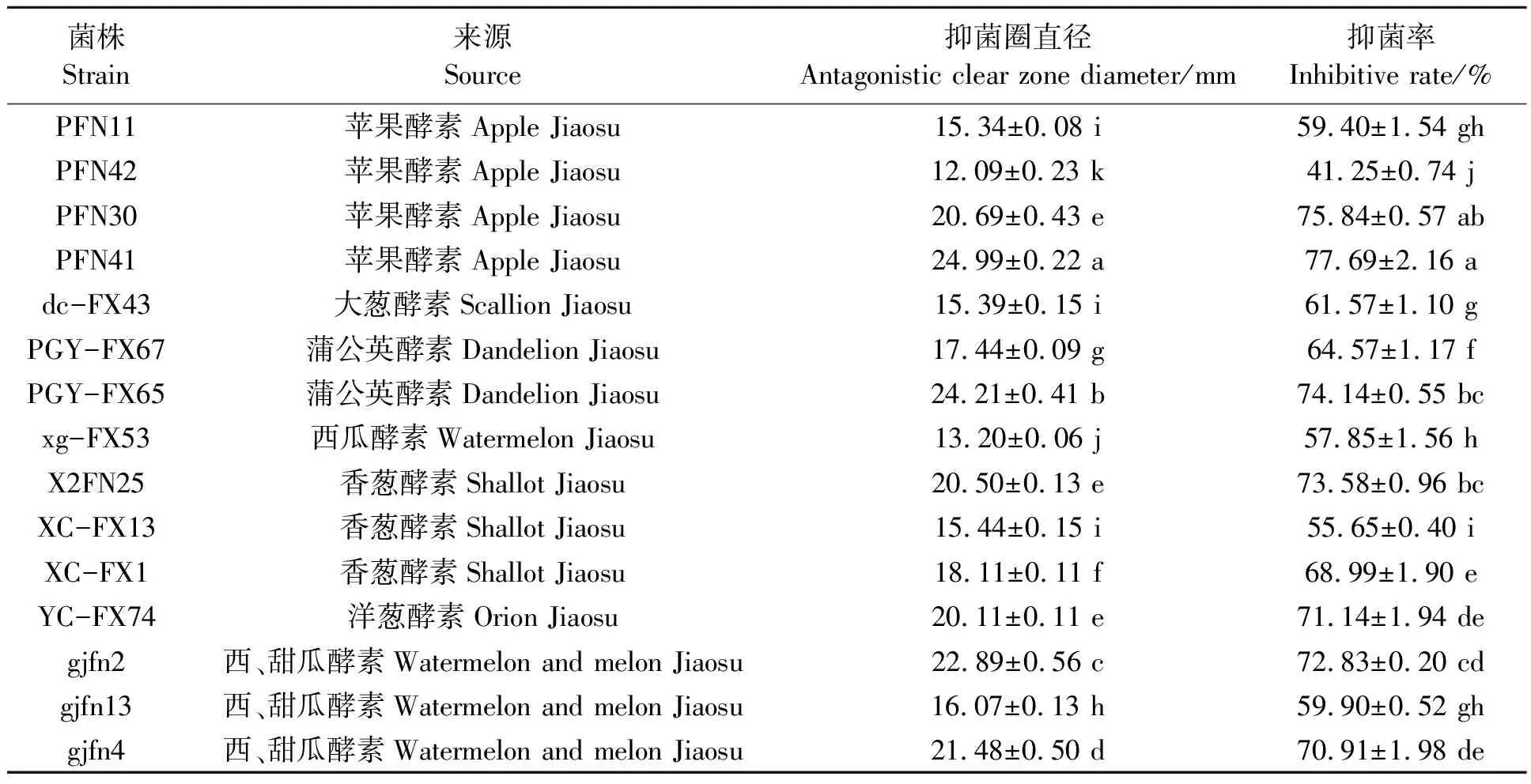
表1 农用植物酵素液细菌对梨黑腐皮壳菌抑菌作用初筛结果
其中,gjfn2、gjfn4、PFN41、PFN30、PGY-FX65、X2FN25和YC-FX74具有较强的抑菌作用,抑菌率在70%以上。gjfn4的抑菌效果如图1所示。
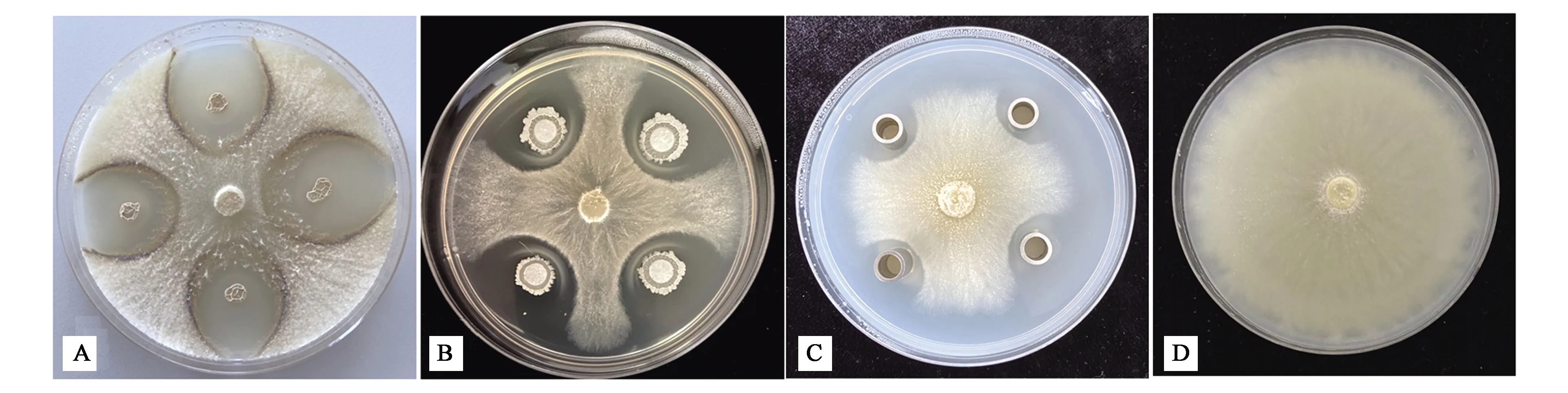
A:菌体与Valsa pyri对峙培养;B:发酵液与Valsa pyri对峙培养;C:除菌发酵滤液与Valsa pyri对峙培养;D:正常生长的梨黑腐皮壳菌
通过滤纸片法、牛津杯法测定初筛菌株发酵液和发酵除菌滤液的抑菌作用,对拮抗菌株进行复筛,gjfn2、gjfn4、PFN41和PGY-FX67抑菌作用显著,发酵液和发酵除菌滤液的抑菌率均分别大于70%和60%,显著高于其他11个菌株(表2)。因此,选取gjfn2、gjfn4、PFN41和PGY-FX67做进一步研究。

表2 农用植物酵素液细菌对梨黑腐皮壳菌抑菌作用的复筛
2.2 拮抗菌对梨黑腐皮壳菌分生孢子萌发和菌丝生长的抑制作用
2.2.1对分生孢子萌发的抑制作用 测定gjfn2、gjfn4、PFN41和PGY-FX67发酵液和除菌发酵滤液对梨黑腐皮壳菌分生孢子萌发的抑制作用,结果(表3)表明,4个拮抗菌株发酵液和除菌发酵滤液对梨黑腐皮壳菌分生孢子的萌发有明显的抑制作用,可显著降低梨黑腐皮壳菌分生孢子的萌发率。其中,gjfn4和PFN41对梨黑腐皮壳菌分生孢子的抑制作用最为显著,在发酵液和除菌发酵滤液中36 h分生孢子不能萌发,抑制率均达到100%。
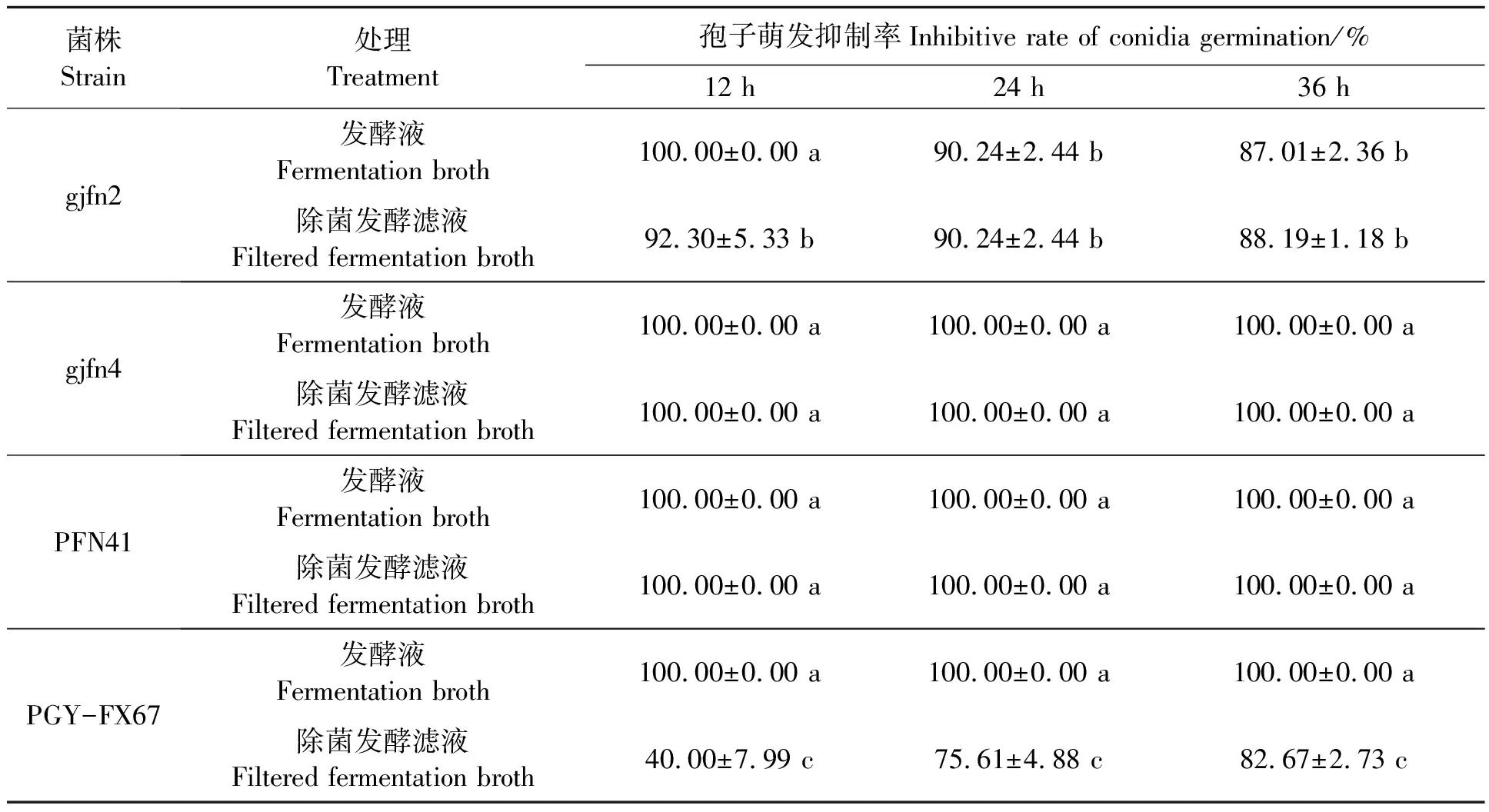
表3 拮抗菌株发酵液和除菌发酵滤液对梨黑腐皮壳菌分生孢子萌发的抑制效果
2.2.2拮抗菌株对梨黑腐皮壳菌丝生长的抑制作用 将拮抗菌株gjfn4与梨黑腐皮壳菌对峙培养5 d后显微观察(图2)显示,对照梨黑腐皮壳菌菌丝生长正常,菌丝较细、均匀一致、表面光滑、平直;而受gjfn4抑制的梨黑腐皮壳菌菌丝生长异常,如菌丝加粗、颜色变深、不规则弯曲增多、分枝增加、节间短、顶端膨大、畸形、部分膨大细胞破裂、细胞质外渗等。
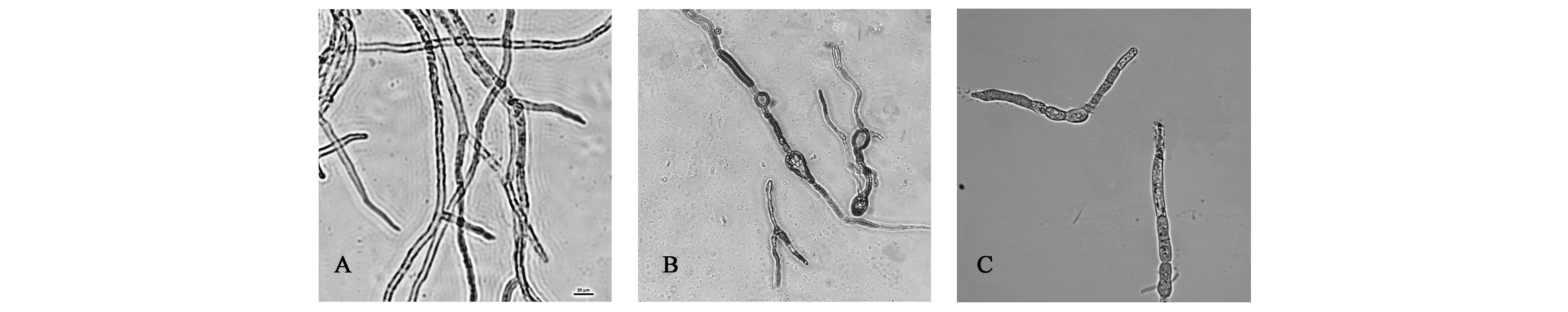
A:正常菌丝;B~C:gjfn4作用后的畸形菌丝
2.3 拮抗细菌对梨树腐烂病防治效果
采用离体枝条法测定拮抗菌株gjfn2、gjfn4、PFN41和PGY-FX67发酵液和除菌发酵滤液对梨树腐烂病的防效,结果(表4)表明,未接种拮抗菌的对照在接种梨黑腐皮壳菌1~2 d后枝条上出现典型病斑,并迅速扩展;而喷施gjfn2、gjfn4、PFN41、PGY-FX67发酵液和除菌发酵滤液后再接种病原菌的处理能有效抑制病斑的扩展速度、减缓显症时间(3 d后),且病斑面积均显著低于对照。4个菌株发酵液的防效均达到79%以上,除菌发酵滤液原液防效均达73%以上,发酵液防效略高于除菌发酵滤液。4个菌株中,gjfn4菌株发酵液、除菌发酵滤液原液和除菌发酵滤液50倍稀释液的防效分别为84.79%、81.57%和67.27%,防效最佳。

表4 拮抗细菌对梨树腐烂病的离体枝条防效
2.4 拮抗菌株的鉴定
2.4.1形态特征及生理生化特性 对拮抗菌株gjfn2、gjfn4、PFN41、PGY-FX67的形态特征、生理生化特性进行观察测定,结果(表5)表明,4个菌株在菌落、菌体形态和生理生化特性上均符合芽孢杆菌属特征。gjfn2、gjfn4和PFN41菌株在NA培养基上菌落均呈圆形、乳白色,表面粗造、边缘不规则,菌体杆状,G+,芽孢中央位;在VP、甲基红、H2S、革兰氏染色、硝酸盐还原、葡萄糖产气、接触酶、淀粉水解、明胶液化、丙二酸盐、吲哚试验中均呈阳性反应;氧化酶、乳糖、木糖、甘露糖试验中均呈阴性反应;其特性与贝莱斯芽孢杆菌(B.velezensis)一致。PFN41在NA培养基上菌落稍隆起、芽孢囊彭大,甲基红、H2S、丙二酸盐试验呈阴性反应,氧化酶试验呈阳性反应,其特性与解淀粉芽孢杆菌(B.amyloliquefaciens)一致。

表5 拮抗菌株的形态和生理生化特性
2.4.216S rRNA和gyrA基因序列分析 以菌株gjfn2、gjfn4、PFN41和PGY-FX67的总DNA为模板进行16S rRNA的PCR扩增,均得到一条大小约为1 500 bp的条带,经测定序列全长分别为1 438、1 438、1 440和1 438 bp,GenBank登录号分别为MW255029、MW255046、MW255043和MW266937。将测序结果在NCBI数据库中与已知序列进行BLAST比对,并下载与其相近序列构建系统发育树,结果(图3)表明,菌株PGY-FX67、PFN41和gjfn4聚为一类,同时又和gjfn2、贝莱斯芽孢杆菌C1聚在一个分支,与贝莱斯芽孢杆菌模式菌株NRRL B-41580T相似性最高,达99.8%~99.9%。
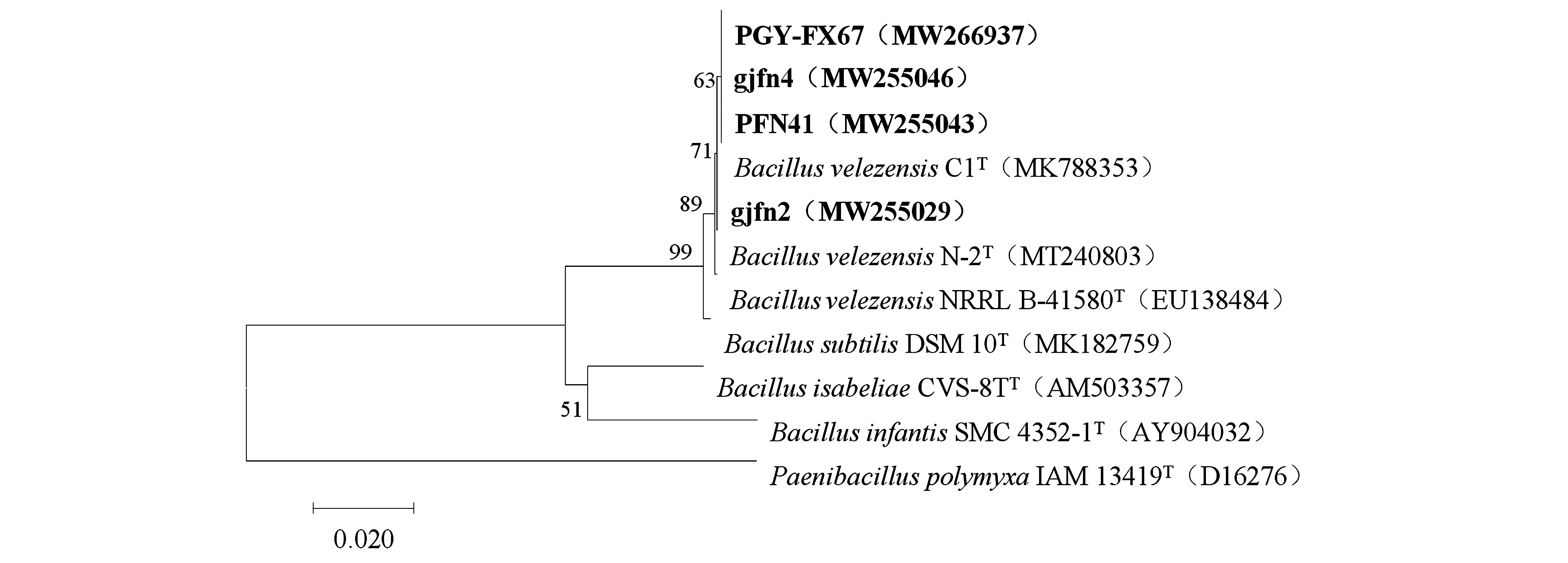
图3 基于16S rRNA构建的4个拮抗菌株的系统发育树
贝莱斯芽孢杆菌与枯草芽孢杆菌枯草亚种(B.subtilissubsp.subtilis)、解淀粉芽孢杆菌为相近种,序列相似性高于物种划分推荐的阈值(98.65%)。因此,仅通过16S rRNA基因序列分析不能有效区分。进一步对供试菌株的持家基因gyrA进行扩增,分别获得了1 000 bp左右的特异性目标条带,提交GenBank获得登录号分别为MW316629、MW316630、MW316631、MW316632。系统发育分析(图4)显示,gjfn2、PGY-FX67菌株与B.velezensisONU 553(CP043416)的序列相似性达100%;gjfn4菌株与贝莱斯芽孢杆菌B.velezensisCBMB205(NZ_CP011937)的序列相似性达到100%;PFN41号菌株与解淀粉芽孢杆菌B.amyloliquefaciensPG12(KC797584)的序列相似性达到100%。综合培养性状、形态及生理生化特征,将gjfn2、gjfn4、PGY-FX67鉴定为贝莱斯芽孢杆菌,PFN41鉴定为解淀粉芽孢杆菌。
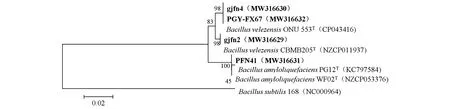
图4 基于gyrA基因构建的4个拮抗菌株的系统发育树
3 讨论
酵素液发酵过程中有丰富的复合菌群参与,产生多种营养及有机酸、酚类、活性酶、生物表面活性剂等活性物质[15],具有改善植物营养和抗菌杀虫的功效。近期,本课题组从西、甜瓜酵素液细菌中分离到XG-FX22和G-FX12菌株,对梨腐烂病的防效显著高于内生细菌[16],由此表明,酵素液是获得高效拮抗菌的重要来源。本研究从新疆库尔勒果农利用各种果蔬原料经天然发酵制备的酵素液中分离的68株细菌中,采用平板对峙试验初筛选出了15株对梨黑腐皮壳菌具有拮抗作用的菌株,筛选概率达22.1%;抑菌率为41.25%~74.14%,其中有7个菌株的抑菌率大于70%。通过发酵液和除菌发酵滤液复筛出4株抑菌效果显著的菌株,通过香梨离体枝条测定其防病效果,结果表明,4个菌株的发酵液防效均达到79%以上,除菌发酵滤液防效均达到73%以上。其中gjfn4菌株的发酵液和除菌发酵滤液防效俱佳,均达到80%以上,且除菌发酵滤液50倍稀释液的防效仍能保持在60%以上,具有作为香梨腐烂病生防菌的良好潜力。本研究结果再次证实了在酵素液中存在有大量的拮抗菌株,是获得高抗菌活性菌株的新来源。
近年来,农用植物酵素液在抑制病原菌生长、增强植物抗病性方面的功效不断地被研究发现和认知。耿健等[17]利用芳香植物孔雀草、薄荷发酵制成的酵素液喷施梨树,能有效防治梨黑心病、腐烂病和轮纹病的发生,对梨树叶片生长、光合特性和果实品质均具有促进作用。黄伟菁等[18]证实喷施苹果幼果酵素液能够明显促进树体生长,改善果实品质,减少α-法呢烯的含量,降低苹果虎皮病的发生率。王荣娟等[19]发现在苹果树上喷施苹果果实酵素液,可提高活性氧含量和抗氧化酶活性,有效诱导苹果叶片对斑点落叶病的抗性。但在应用植物酵素过程中也发现,由于原料成分多样、参与天然发酵的菌种复杂、易污染有害杂菌、复合菌群发酵过程易受环境影响、代谢产物难以控制等因素而造成酵素质量良莠不齐、使用效果不稳定等问题[20-21]。制作植物酵素液是一个复杂的发酵过程,在多种菌种复合共同作用下,使发酵基质产生一系列的生物化学变化,形成抗氧化物、有机酸、酶类和次生代谢产物等抗菌成分。由于发酵菌种不同、原料不同、工艺不同,所以发酵过程中相关代谢产物的变化也不尽相同,但参与发酵的菌种与酵素液的生防功能密不可分。因此,从酵素液中筛选出抗菌功能菌株,对于明确其功能性成分和发酵机理、产品质量调控及开发利用都具有重要意义。研究发现,自然发酵的植物酵素液中分离出的菌种通常是酵母菌和醋酸菌、乳酸菌等[22]。朱会霞等[23]通过高通量测序检测水果酵素发酵过程中的细菌变化,发现正常发酵主要的细菌有醋酸杆菌、乳酸杆菌、芽孢杆菌、酸硫杆状菌、明串珠菌和嗜酸菌。本研究从酵素液分离细菌中筛选出的4株梨腐烂病生防潜力菌株均为芽孢杆菌属,经鉴定gjfn2、gjfn4、PGY-FX67为贝莱斯芽孢杆菌,PFN41为解淀粉芽孢杆菌。这可能是由于芽孢杆菌广泛栖息于植物体表、体内和空气、水等环境中,在酵素液发酵过程中生长快,抗逆性强,耐受高酸、高渗透压环境,能产生多种抗菌物质,因而在发酵过程中与有害菌的竞争中更具优势。贝莱斯芽孢杆菌和解淀粉芽孢杆菌是目前备受关注的重要生防细菌,具有对多种植物病原菌的抗菌活性及促进植物生长的作用[24-25],但对梨腐烂病防治作用研究尚未见报道。
拮抗菌株对梨黑腐皮壳菌的抑制作用研究表明,4个拮抗菌株的发酵液和除菌发酵滤液可显著降低梨黑腐皮壳菌分生孢子的萌发率。显微观察显示,拮抗菌造成梨黑腐皮壳菌菌丝加粗、不规则弯曲增加、顶端膨大畸形及细胞原生质外渗。离体防效试验结果表明,拮抗菌株的发酵液和发酵除菌滤液对香梨腐烂病的防效接近,说明其代谢产物在防病过程中起重要作用。吕前前等[26]研究发现,解淀粉芽孢杆菌菌株BaA-007对苹果腐烂病菌的作用机制是分泌次生代谢物和激活JA、SA、ET和细胞壁相关抗性反应抑制腐烂病斑扩展。程超[27]从产酶溶杆菌(L.enzymogenes)OH11次生代谢产物中分离的HSAF(heat stable antifungal factor)对梨黑腐皮壳菌有较强的生长抑制作用,EC50值为0.5 μg·mL-1。利用微生物次生代谢物开发生物农药,可实现规模化生产,耐贮性好,功效稳定,对防控植物病害更具应用价值和发展前景。本研究从植物酵素液中筛选获得的梨腐烂病生防潜力菌株,其田间防效是否理想有待进一步验证。同时,菌株的抑菌机制及抑菌物质的成分、结构及稳定性等都需在今后工作中进行更加深入的研究。

