孤独症谱系障碍儿童丘脑和小脑磁共振波谱特征和临床关系的前瞻性研究
康倩倩 李旭 童光磊 范亚兰 施磊
(复旦大学附属儿科医院安徽医院/安徽省儿童医院,安徽合肥 230022)
孤独症谱系障碍(autism spectrum disorder,ASD)是一种严重的神经异质性发育障碍类疾病,其特征是存在社会沟通障碍和受限的兴趣、重复刻板行为,多起病于3岁之前[1],常共患癫痫、智力障碍、注意缺陷与多动障碍等疾病,给家庭带来沉重经济和心理负担。近年,其发病率正在逐年增加,2020 年美国疾病控制中心最新公布的数据显示,患病率为1/54,男女比例4.3∶1[2]。ASD已然被视为全球公共问题之一,但其发病机制仍未完全清楚。磁共振波谱(magnetic resonance spectroscopy,MRS)为测量体内组织结构的代谢指标变化提供了一种无创方法。目前,大量有关ASD 儿童大脑的神经生物学基础研究表明,最有可能存在异质性的区域有额叶、颞叶、杏仁核-海马复合体区、顶叶、小脑、丘脑、扣带回、枕叶、尾状核、壳核等,这些部位的改变与ASD 核心症状之间有不同程度的关联,可能存在广泛性的神经发育和结构异常[3-4]。其中,小脑在语言、工作记忆、执行控制、情绪加工等方面起着重要的作用,丘脑是感觉传导的接替站,各种感觉的传导通路均在丘脑内更换神经元,而后投射到大脑皮质,丘脑与小脑、额叶及扣带回之间存在广泛联系,但是丘脑和小脑生化代谢物之间的关系,这些解剖部位的代谢异常与ASD 症状的关系仍不明确。本研究应用短回波单体素点分辨率波谱(point resolved spectroscopy, PRESS) 序 列 选 取ASD 儿童双侧丘脑和小脑做为感兴趣区(region of interest,ROI)进行MRS采集,分析两脑半球代谢物差异、不同脑部位间代谢物关联及同发育水平的相关性,为ASD发病机制提供影像学依据。
1 资料与方法
1.1 研究对象
前瞻性选取 2020 年 1 月至 2021 年 7 月我院康复科门诊收治的50 名2~6 岁的ASD 儿童为研究对象。入选标准:符合《精神疾病诊断与统计手册》第 5 版 (Diagnostic and statistical manual of mental disorders-5,DSM-5) ASD 诊断标准[5],诊断由同一主治医生进行,该医生于北京大学第六医院儿科进修ASD 的早期诊断和干预,具有ASD 临床诊断能力。排除标准:(1)患脆性X综合征、结节性硬化症、脑性瘫痪、癫痫、听力障碍者;(2)临床诊断患有其他精神障碍者,如精神分裂症、情感障碍等;(3)外观畸形、颅脑磁共振或脑电图检查异常者及其他神经系统或躯体疾病者。最终纳入ASD儿童50例,其中男孩38例(76%)、女孩12 例 (24%),平均年龄 (3.5±1.3) 岁,头围(49.8±1.7)cm,平均体重(17±4)kg,平均身高(103±11)cm。
该研究通过我院医学伦理委员会审批(审批号:EYLL-2019-020),所有入组ASD 患儿均由家属签署知情同意书。
1.2 研究工具
1.2.1 儿童孤独症评定量表 儿童孤独症评定量表 (Childhood Autism Rating scale,CARS) 由Schopler等[6]于1980年编制。该量表共15个项目,每个项目4级评分。每级评分意义依次为“与年龄相当的行为表现”“轻度异常”“中度异常”“严重异常”。量表总分为60 分。非ASD 指得分<30 分,轻至中度ASD指得分30~36分,并且低于3分的项目不到5项;重度ASD指得分>36分,并且至少有5 项的评分高于3 分。该量表适用于2 岁以上的人群[7]。
1.2.2 Griffiths 发育评估量表中文版 Griffiths发育评估量表中文版(Griffiths Mental Development Scales-Chinese,GDS-C)分为0~2岁和3~8岁部分,0~2 岁部分分为粗大运动、个人-社交、听力-语言、手眼协调、视觉表现5 个能区,3~8 岁部分增加实际推理能区,共6个能区。每个儿童的测评结果以各能区的得分、百分数、相当月龄及总发育商表示。各能区的得分是各分量表的累计分数依据参考标准进行计算的,并可通过中国常模标准将各能区的得分转换成百分数和相当月龄,6个能区得分的均值再通过常模标准换算转化为总发育商,具体计算方法为总发育商=平均相当月龄/实际月龄×100,平均相当月龄为各能区得分的均值根据常模标准换算得出。其中总发育商的均值为100,标准差为15[8]。本研究统计分析中选择重合的前5 个能区与MRS 检测结果进行相关分析,排除实际推理能区。
1.3 MRS检测
ASD 儿童影像采集均在安徽省儿童医院影像中心进行,使用10%水合氯醛镇静(剂量为0.3~0.5 mL/kg),采用飞利浦1.5 T磁共振扫描仪,首先进行头部自旋回波(spin echo,SE)矢状位T1WI[重复时间(time of repetition,TR)=1 968 ms,回波时间(time of echo,TE)=11 ms],快速恢复快速自旋回波轴位T2WI(TR=4 060 ms,TE=99 ms),冠状位T2WI(TR=3 640 ms,TE=99 ms)以除外脑部未知病变。通过单体素波谱选用PRESS 进行匀场,选取双侧丘脑(体素=13 mm×13 mm×16 mm)和小脑(体素=14 mm×20 mm×20 mm)作为 ROI,TR=2 000 ms,TE=30 ms,反转角 80°(图1)。扫描完成后从工作站导出原始数据,在LCModel 上通过对原始波谱校正后,所有数据在LCModel 上的信噪比>5,半峰全宽<0.07,浓度标准差以<15%为采用标准,以Cr 为内标准,计算NAA/Cr、Cho/Cr、MI/Cr、Glx/Cr的比值。
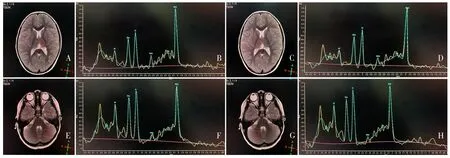
图1 ASD儿童MRS采集及对应LCModel校正谱线图
质量控制:本研究中常规磁共振和MRS 检查均按以上参数设置,MRS 检测ROI 的定位均避开脑脊液、血管部位,所有影像操作均由我院同一位有丰富临床经验的医师完成。
1.4 统计学分析
所有数据采用SPSS 23.0软件进行统计学分析。正态分布计量资料以均数±标准差()表示,组间比较采用配对t检验。代谢物与ASD相关量表的关系和两部位间的关系采用Pearson相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ASD儿童两侧丘脑和小脑代谢物与ASD相关量表的相关性分析
ASD 儿童左侧丘脑 NAA/Cr 与 GDS-C 中听力-语言和手眼协调评分呈正相关(P<0.05);右侧小脑Cho/Cr 与个人-社交、听力-语言、手眼协调呈正相关(P<0.05)。ASD 儿童两侧丘脑和小脑各代谢物与CARS得分无相关性(P>0.05)。见表1~2。
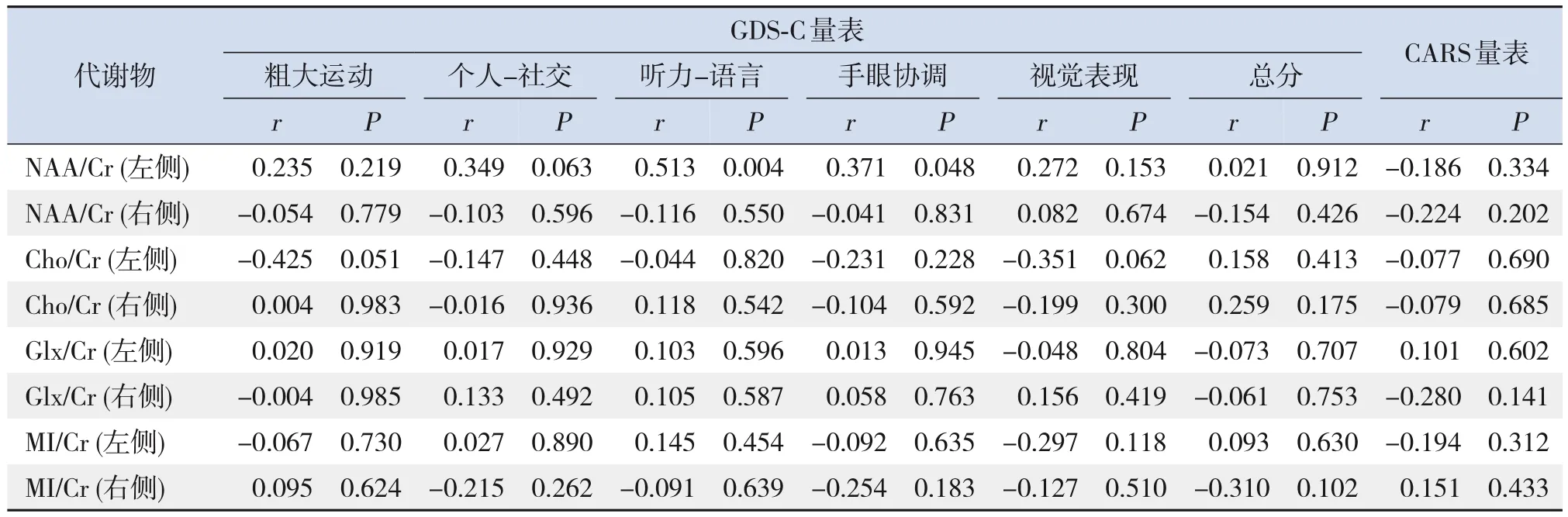
表1 ASD儿童两侧丘脑各代谢物与GDS-C、CARS得分的相关性分析
2.2 ASD儿童同侧丘脑和小脑代谢物之间相关性分析
ASD 儿童左侧丘脑和左侧小脑的NAA/Cr 呈正相关,左侧丘脑和左侧小脑的Glx/Cr 呈正相关(P<0.05),见表3。
表3 ASD儿童同侧丘脑和小脑代谢物之间的相关性分析 (,n=50)
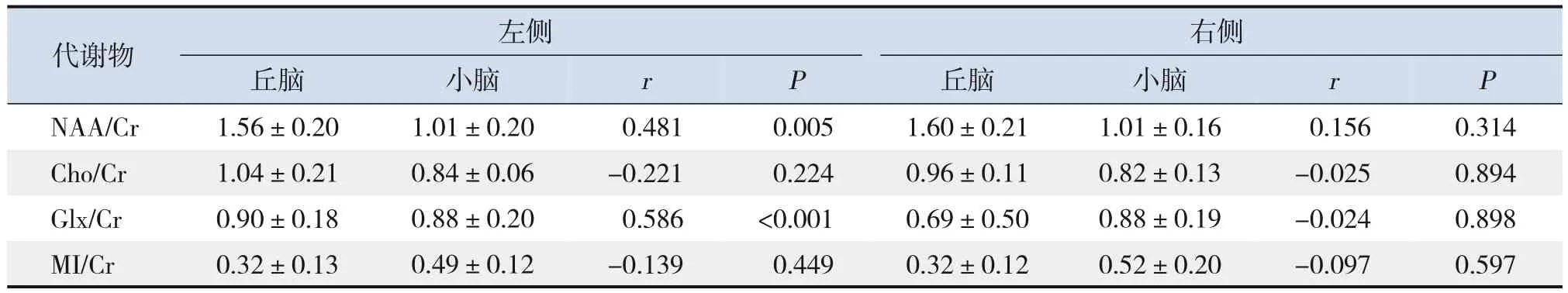
表3 ASD儿童同侧丘脑和小脑代谢物之间的相关性分析 (,n=50)
images/BZ_68_237_2207_460_2332.pngimages/BZ_68_460_2207_1352_2269.png右侧images/BZ_68_460_2269_712_2332.pngimages/BZ_68_1158_2269_1352_2332.pngimages/BZ_68_1600_2269_1848_2332.png images/BZ_68_964_2269_1158_2332.pngimages/BZ_68_1352_2269_1600_2332.pngNAA/Cr Glx/Crimages/BZ_68_1848_2269_2046_2332.pngimages/BZ_68_712_2269_964_2332.png Pimages/BZ_68_237_2391_460_2450.pngimages/BZ_68_712_2391_964_2450.png0.314 0.894 0.898 0.597images/BZ_68_460_2391_712_2450.pngimages/BZ_68_1158_2391_1352_2450.pngimages/BZ_68_1352_2391_1600_2450.pngimages/BZ_68_1600_2391_1848_2450.pngimages/BZ_68_1848_2391_2046_2450.png1.56±0.20 0.90±0.18images/BZ_68_964_2391_1158_2450.pngimages/BZ_68_237_2509_460_2568.pngimages/BZ_68_460_2509_712_2568.pngimages/BZ_68_712_2509_964_2568.png1.01±0.20 0.88±0.20images/BZ_68_964_2509_1158_2568.png0.481 0.586images/BZ_68_1158_2509_1352_2568.png0.005<0.001images/BZ_68_1352_2509_1600_2568.png1.60±0.21 0.69±0.50images/BZ_68_1600_2509_1848_2568.png1.01±0.16 0.88±0.19images/BZ_68_1848_2509_2046_2568.png0.156-0.024
2.3 ASD儿童两侧丘脑和小脑各代谢物比较
ASD 儿童丘脑和小脑部位左右两侧代谢物之间相比差异无统计意义(P>0.05),见表4。注:[ASD]孤独症谱系障碍;[NAA]N-乙酰天冬氨酸;[Cr]肌酸;[Cho]胆碱;[Glx]谷氨酸复合物;[MI]肌醇。
表4 ASD儿童两侧丘脑和小脑各代谢物比较 (,n=50)
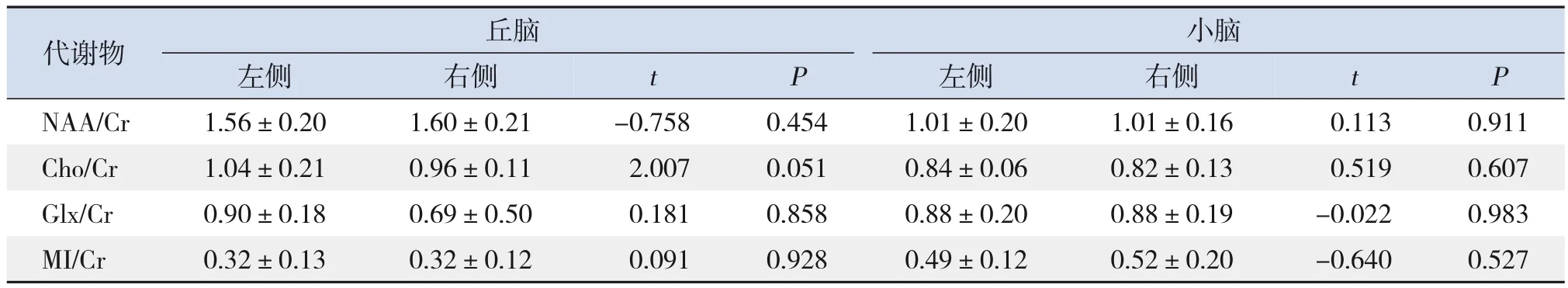
表4 ASD儿童两侧丘脑和小脑各代谢物比较 (,n=50)
注:[ASD]孤独症谱系障碍;[NAA]N-乙酰天冬氨酸;[Cr]肌酸;[Cho]胆碱;[Glx]谷氨酸复合物;[MI]肌醇。
images/BZ_68_237_2764_437_2882.pngimages/BZ_68_437_2764_1341_2823.png小脑images/BZ_68_437_2823_702_2882.pngimages/BZ_68_967_2823_1170_2882.png images/BZ_68_1170_2823_1341_2882.png images/BZ_68_1341_2823_1606_2882.pngimages/BZ_68_1606_2823_1871_2882.pngimages/BZ_68_1871_2823_2074_2882.png Pimages/BZ_68_237_2941_437_3000.pngNAA/Cr Glx/Crimages/BZ_68_437_2941_702_3000.pngimages/BZ_68_702_2823_967_2882.pngimages/BZ_68_702_2941_967_3000.pngimages/BZ_68_1341_2941_1606_3000.png0.911 0.607 0.983 0.527images/BZ_68_1606_2941_1871_3000.png1.56±0.20 0.90±0.18 1.60±0.21 0.69±0.50images/BZ_68_967_2941_1170_3000.pngimages/BZ_68_1170_2941_1341_3000.pngimages/BZ_68_1871_2941_2074_3000.pngimages/BZ_68_237_3059_437_3118.pngimages/BZ_68_437_3059_702_3118.pngimages/BZ_68_702_3059_967_3118.pngimages/BZ_68_967_3059_1170_3118.png-0.758 0.181images/BZ_68_1170_3059_1341_3118.png0.454 0.858images/BZ_68_1341_3059_1606_3118.png1.01±0.20 0.88±0.20images/BZ_68_1606_3059_1871_3118.png1.01±0.16 0.88±0.19images/BZ_68_1871_3059_2074_3118.png0.113-0.022
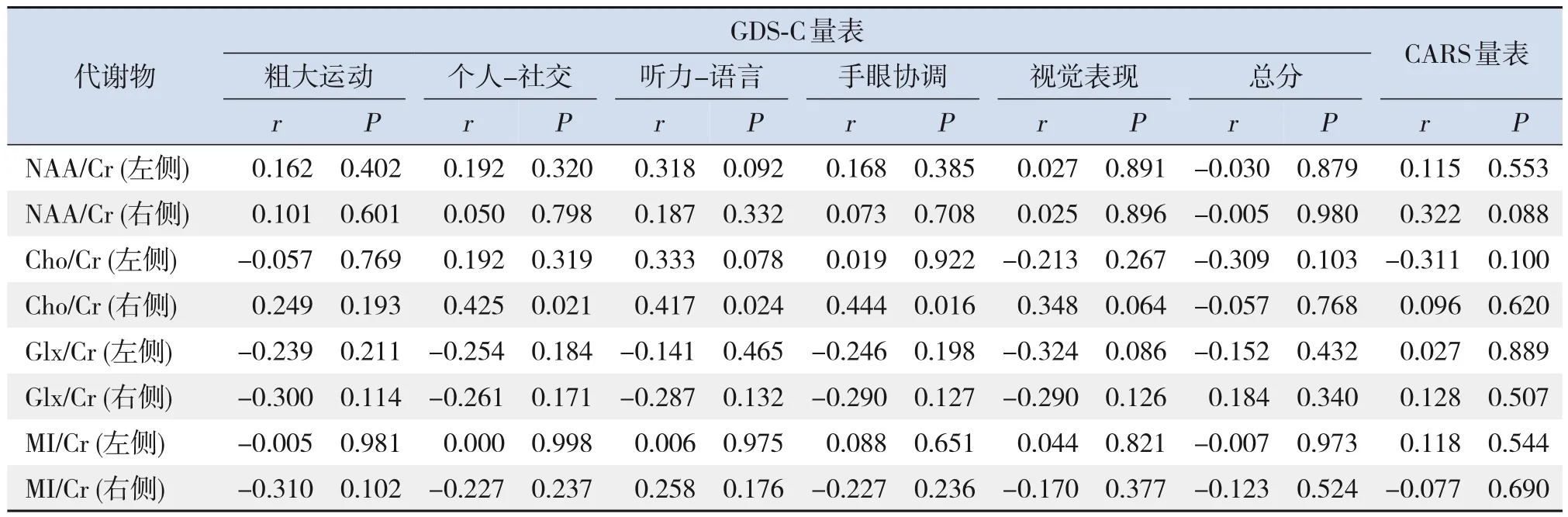
表2 ASD儿童小脑两侧各代谢物与GDS-C、CARS得分的相关性分析
3 讨论
本研究中发现ASD 儿童左侧丘脑NAA/Cr 和右侧小脑Cho/Cr 改变与ASD 儿童发育能力的严重程度呈正相关,其降低会导致ASD听力-语言、手眼协调和个人-社交能力的受损。既往关于MRS代谢物与ASD 临床症状关系研究中,也显示ASD 儿童大脑存在广泛NAA 代谢异常且不同脑区临床症状相关性有所不同,其中在顶叶白质中NAA 水平降低与社会性注视、空间感知和记忆缺陷相关[9],前扣带回系统与社交能力相关[10],右内侧颞叶与情绪和听理解相关[11],扣带回脑区与CARS评分呈负相关[12]。小脑MRS 代谢物相关研究中,邹小兵等[13]研究显示ASD儿童小脑蚓部NAA下降严重程度与语言障碍、认知障碍等临床表现相关。姚滔涛等[14]研究显示右小脑 Cho/Cr 与 CARS 评分呈正相关。此外,有关ASD 儿童丘脑的MRS 研究中,Hegarty 等[15]报道 ASD 患者丘脑 NAA 浓度下降,其含量与社会交往障碍、重复刻板行为症状严重程度一致。NAA 主要位于神经元和轴突内,是神经/轴索密度和异型性的公认神经元标志物,其含量反映了神经元及轴突的完整性,可能与线粒体的功能有关。NAA或NAA/Cr水平下降可能与神经元代谢率下降、神经元死亡或丢失,以及神经轴突、树突和突触连接减少、髓鞘形成减少有关[16],说明ASD 儿童小脑和丘脑部位存在神经元或轴突损伤,NAA/Cr 和Cho/Cr 有望作为患儿临床症状评估的定量指标。Cho为脑内总胆碱的总称,主要参与细胞膜构成及神经细胞髓鞘的形成,是乙酰胆碱的前体,可反映神经胶质细胞的密度,与记忆、情绪密切相关。Sokol 等[17]对 10 个 ASD 儿童的颞中回海马区进行MRS 分析,发现其Cho/Cr 值与疾病严重程度呈正相关。本研究还发现ASD 儿童NAA/Cr 和Glx/Cr 在左侧丘脑和左侧小脑之间存在正相关,既往研究大多证实NAA 在ASD 儿童大脑中广泛降低[18-20],由此预示着ASD 儿童左侧小脑和丘脑部位Glx/Cr 也存在降低可能。DeVito 等[21]对高功能ASD 和正常儿童的颅脑MRS 研究发现,ASD 儿童小脑半球Glx 较正常对照明显降低。Horder 等[22]研究也发现 ASD 患者丘脑 Glx 浓度明显下降,且与社交损害严重程度呈正相关。Glx包括谷氨酸(glutamic acid,Glu)和谷氨酰胺(glutamine,Gln),是脑内重要的兴奋性神经递质,也是脑内含量最高的氨基酸,与脑内葡萄糖氧化代谢呈直线相关。Gln 和Glu 结构复杂,它们的峰在MRS 上重叠并很难分离,所以这两种物质经常被合称为Glx。ASD儿童小脑兴奋/抑制失衡会影响其与丘脑的回路协调功能[23-24],这一改变同ASD 的发病相关,而Glx介导兴奋性突触传递过程,是兴奋性/抑制性失衡的重要物质基础,Glu的过度激活则对脑组织非常有害。本研究未发现ASD 儿童内丘脑和小脑左右代谢物之间差异,与姚滔涛等[25]研究显示左侧小脑Cho/Cr 均低于右侧不同,分析原因可能与年龄不同、参数设置,以及采集ROI部位大小有关。国外对于正常儿童的不同部位MRS 研究提示MRS检查不需要考虑大脑半球间的差异[26]。
综上所述,本研究发现ASD 儿童左侧丘脑NAA/Cr和右侧小脑Cho/Cr均与听力-语言和手眼协调能力呈正相关,此外右侧小脑中Cho/Cr 还与个人-社交呈正相关,提示丘脑和小脑部分代谢物与ASD 临床症状间存在关联,代谢物可做为临床判断ASD 严重程度的指标;还发现左侧丘脑和左侧小脑的NAA/Cr 呈正相关,左侧丘脑和左侧小脑的Glx/Cr呈正相关,可见大脑左侧小脑和丘脑间存在神经连接并相互影响。MRS 有望为将来ASD 临床症状严重程度判断及大脑间神经联系提供影像参考依据。本研究亦存在一定的局限性,未能区分年龄、性别、智力等因素,未设立正常对照组,今后若能进一步扩大样本细化临床亚型并与行为学症状进行相关研究,并探究同正常儿童各代谢物的差异,将有利于深入理解ASD 各临床症状的神经病理机制。MRS 通过对神经代谢物的检测,必将成为研究脑发育性疾病的重要手段,为ASD病因学的研究提供重要帮助。
利益冲突声明:所有作者均声明不存在利益冲突。

