Citrin缺陷病患儿体格和神经心理发育状况
张妮思 张占会 林伟霞 张萌 李冰肖
(1.暨南大学附属第一医院儿科,广东广州 510630;2.暨南大学临床医学研究院,广东广州 510630)
Citrin 缺 陷 病 (Citrin deficiency, CD) 是SLC25A13基因突变引起的以肝功能损害为主要临床表现的一种常染色体隐性遗传病。CD 有3 种年龄相关的表型:婴儿期表现为citrin 缺陷导致的新生儿肝内胆汁淤积症(neonatal intrahepatic cholestasis caused by citrin deficiency,NICCD),以肝脏功能异常和胆汁淤积等为主要临床表现;成人期表现为成人发病瓜氨酸血症Ⅱ型(adult-onset type Ⅱcitrullinemia,CTLN2),以高氨血症导致的神经精神症状为主要临床表现;部分患者在NICCD 与CTLN2 之间的代偿期表现为citrin 缺陷导致的生长发育落后和血脂异常(failure to thrive and dyslipidemia caused by citrin deficiency,FTTDCD)[1-5]。NICCD患儿的预后复杂,大部分会在1岁左右症状自然缓解,部分患儿在肝内胆汁淤积消失后进展为FTTDCD,约1/10的患儿经过数年至数十年的静止期进展为CTLN2[6-7]。目前关于CD 患儿的生长发育状况已有部分报道[2,8-12],但是神经心理发育状况的分析尚为空白。为了全面了解CD患儿的发育情况,本研究对93例CD患儿体格及神经心理发育状况进行了回顾性分析与评估,报道如下。
1 资料与方法
1.1 研究对象
收集 2010 年 8 月至 2015 年 8 月期间在暨南大学附属第一医院儿科就诊,根据临床及实验室特征等高度怀疑患有CD 并行基因分析确诊的93 例CD 儿童的临床资料。排除标准:(1)出生窒息;(2)严重的先天畸形、遗传代谢性疾病、全身性疾病、血液系统疾病、传染病;(3)临床数据不完整。其中男性55 例,女性38 例;足月儿89 例,早产儿4例;胎龄(39.2±1.5)周(范围:31+3~42周);出生体重(2 856±409)g(范围:1 650~3 650 g);小于胎龄儿 (small for gestational age,SGA)44 例(47%)。93 例患儿均进行了体格测量及神经心理发育评估,其中7 例1 岁内及1 岁后各做过1次体格测量及神经心理发育评估,故共纳入100例次体格及神经心理发育评估数据。
1.2 体格测量方法
由培训过的医学专业人员按照标准化方法进行体格测量。3 岁以下身长测量采用卧位,3 岁以上身高测量采用站立位。身长/身高数值精确到0.1 cm,体重数值精确到0.01 kg,头围数值精确到0.1 cm。
1.3 神经心理发育评估方法
采用Gesell 发育量表进行神经心理发育评估。该量表适用于0~6岁儿童,测评内容有适应性、大运动、精细动作、语言和个人社交行为5 个能区。由同一名从事儿童发育评估多年的专业人员进行测试。测试结果发育商(developmental quotient,DQ)=(发育年龄÷实际年龄)×100。神经心理发育测试结果分为6 个等级:DQ>85 为正常,76≤DQ≤85 为边缘发育迟缓,55≤DQ≤75 为轻度发育迟缓,40≤DQ≤54 为中度发育迟缓,25≤DQ≤39 为重度发育迟缓,DQ<25 为极重度发育迟缓[13]。本研究将DQ<75定义为发育迟缓[14]。
1.4 诊断标准
CD 的诊断标准:结合临床表现、生化、影像及代谢组学特征等临床资料高度怀疑CD,并根据PCR/LA-PCR、PCR-RFLP、Sanger 测序、cDNA 克隆、Western blot分析等方法进行SLC25A13基因分析而确诊[8-9,15-19]。
SGA 的诊断标准:指出生体重在同胎龄平均体重的第10百分位数以下的新生儿[20]。
生长异常的诊断标准:依据2006 年世界卫生组织5 岁以下儿童的生长标准[21],将小于年龄别身长/身高-2 SD 定义为生长迟缓,小于年龄别体重-2 SD 定义为低体重,小于身长/身高别体重-2 SD定义为消瘦[22]。具有生长迟缓、低体重和消瘦3 种情况之一者定义为生长发育落后(failure to thrive, FTT)[23-26]。 小 头 畸 形 是 指 头 围 Z 值<-2 SD[27-28];超重为身长/身高别体重>2 SD[22]。
1.5 统计学分析
应用SPSS 27.0 统计软件进行数据分析。计量资料以均数±标准差()表示;计数资料采用频数和百分率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
在100 例次病例中,首诊时年龄范围为1.9~59.8个月,平均年龄(18±13)个月,男性占58%(58 例次),女性占42%(42 例次)。其中≤1 岁44例次,平均年龄(6.9±2.8)个月(范围:1.9~12.0 个月),男性占55%(24 例次),女性占45%(20 例次);>1 岁56 例次,平均年龄(26.1±12.3)个月(范围:12.3~59.8个月),男性占61%(34例次),女性占39%(22例次)。
93 例CD 患儿来院首诊时,合并锌缺乏20 例(22%),维生素D 缺乏16 例 (17%),贫血14 例(15%),巨细胞病毒感染9例(10%),铁缺乏7例(8%),先天性心脏病6 例(6%),葡萄糖-6-磷酸脱氢酶缺乏症6 例(6%),代谢性酸中毒6 例(6%),脂肪肝4 例(4%),血脂异常3 例(3%),消化道出血3 例(3%),腹股沟疝3 例(3%),地中海贫血2例(2%),血管瘤2例(2%),肝硬化、腹水、低血糖惊厥、隐睾、白内障、腭裂、肺囊肿、卵巢囊肿、肺炎各1例(1%)。
2.2 体格生长情况
93例患儿中,23例(25%)出现了FTT。生长迟缓、低体重、消瘦及超重的发生率分别为23%、14%、4%、8%,小头畸形发生率为9%,见表1。

表1 体格生长异常情况 [例次(%)]
2.3 神经心理发育情况
93 例CD 患儿中,神经心理发育迟缓率为25%;适应性、大运动、精细动作、语言、个人社交5 个能区的发育迟缓率分别为7%、15%、7%、9%、7%。见表2。>1 岁组有1 人,在大运动及精细动作能区发育重度迟缓,在适应性及个人社交能区发育极重度迟缓。
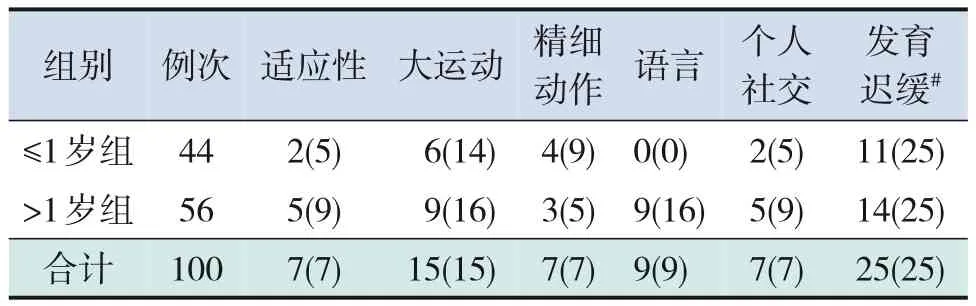
表2 神经心理发育迟缓情况 [例次(%)]
FTT组与非FTT组相比,神经心理发育迟缓率差异无统计学意义(P<0.05),见表3。

表3 FTT组和非FTT组神经心理发育迟缓的比较 [例(%)]
3 讨论
本研究中,CD 患儿的FTT 发生率为25%,远高于正常人群,如美国儿童保健机构报道正常人群FTT发生率为5%~10%,我国正常人群FTT发生率约为15%[25-26]。2021年Arai-Ichinoi等[10]对于20名1 岁以后确诊为CD 的患儿进行研究发现,FTT发生率为45%,证实了CD患儿人群中易出现FTT。这与既往研究提出的CD可导致生长发育落后和血脂异常表现一致[2,8]。由于 citrin 蛋白参与许多重要的代谢过程,其缺陷可引起肝功能损害,影响脂肪及维生素的吸收,此外还会导致低血糖、贫血、腹泻、喂养困难、营养不良等。因此,本研究中CD 患儿FTT 发生率较高与CD 疾病本身有密切关系。对于CD 的治疗,最重要的是控制饮食,改用无乳糖的富含中链脂肪酸的配方奶粉并补充脂溶性维生素,可迅速改善疾病及生长发育情况[2,5,9,11]。大约从 1~2 岁开始,患儿对富含蛋白质和脂质的食物表现出强烈的偏好,并厌恶碳水化合物。这种特殊饮食嗜好可能与摄入此类食物后可补充天冬氨酸和精氨酸,促进尿素循环、降低血氨,抑制胞内葡萄糖代谢,进而防止胞浆内还原型烟酰胺腺嘌呤二核苷酸/烟酰胺腺嘌呤二核苷酸比值增高,从而利于控制病情有关[2,5,7,9-11]。
由于与中国传统的以淀粉为主的饮食习惯相悖,依从性不佳会直接影响疾病的治疗及对FTT状态的改善。2007 年Dimmock 等[12]报道了欧洲第1例CD婴儿,表明持续保持高蛋白质低碳水化合物饮食和生长监测对这些患儿具有重大意义。此外,生长发育还会受营养、喂养方法、经济,以及卫生保健、养育人的知识水平等多方面因素的影响[25]。2020 年 Pinto 等[11]回顾性分析了英国 32 名CD 患者的临床资料,显示大多数患者会自行选择低碳水化合物、高蛋白质食物。随着年龄的增长,部分患者的症状及生化指标得到改善,初诊断时,生长迟缓率为28%,低体重率为38%,而最终评估时,生长迟缓率为19%,低体重率为25%,均较前有所改善,但是身高增长速度仍然不佳,可能与低能量摄入量有关。
本研究对CD 患儿的出生情况进行回顾性分析,显示SGA 比例为47%,远高于我国正常人群(6.6%~9.3%)[29-30]。Arai-Ichinoi 等[10]发现在CD 患儿中,高达70%患儿出生时为SGA或低出生体重。2009 年 Song 等[31]发现,CD 患儿中常为匀称型SGA,提示CD 在孕早期便限制胎儿生长,使得体重、身长和头围均受到影响。Numakura等[32]的研究也证实,由于CD在宫内时期就影响代谢及营养供给,并且这种生长受限情况可延续至童年期。尽管生后存在追赶生长,但不足以缩短和适于胎龄儿之间的差距。本组病例生长迟缓和低体重的发生率分别为23%、14%,均高于我国6 岁以下儿童的发生率(8.1%、2.5%)[26,33]。小头畸形发生率为9%,远高于活产婴儿中的发生率[(1.3~150)/10 万][28],这一方面可能是CD 在宫内时期就开始限制胎儿的身长、体重、头围等发育,另一方面可能是SGA 生后容易出现追赶不足,SGA人群中发生矮小的比例明显高于适于胎龄儿[34]。而消瘦和超重的发生率分别为4%、8%,均与我国6 岁以下儿童的发生率相近 (2.0%、8.4%)[26,33],可能与CD患儿中多为匀称型SGA有关。
本研究中,CD 患儿的神经心理发育迟缓率为25%,高于我国正常人群(16.26%)[35]。首先,本组病例小头畸形发生率较高,小头畸形与脑容量减少及智力和/或运动障碍有关[27]。其次,本组病例SGA 比例较高,SGA 在胎儿期为了生存而进行的适应性改变会引发早期生命应激,对神经发育产生长期影响[36]。另外,营养不良也可能影响神经心理发育[25],但是本研究中的FTT 组与非FTT组相比,神经心理发育迟缓情况无明显差异,因此,推测CD 患儿神经心理发育迟缓可能与CD 疾病本身密切相关,其具体机制有待进一步研究。
本研究显示,CD 患儿中大运动能区迟缓率相对较高。有研究发现,动作发育可能会影响其他能力的发育,且年龄越小,后期越易影响其他能区的发育[35]。本研究中,1岁之后语言发育迟缓更明显。1 岁之前是语言发育的准备期,2 岁左右是爆发期和关键时期。可能由于家长过度关注疾病的治疗,减少了与患儿的交流,减少了患儿语言表达机会,且由于患儿特殊的饮食偏好,可能会拒绝某些食物,或者咀嚼吞咽缓慢,从而影响口腔肌肉功能,不利于语言的发育[37]。
本研究结果为证实CD会导致生长发育落后提供了新的证据,还提出了CD疾病可能影响神经心理发育的新观点。但本研究仍存在一定的局限性。第一,样本量较少,且缺乏完善的临床资料,如家族史、养育人的受教育程度、经济情况、实验室检查数据、疾病的诊治经过等,可能会对结果产生一定的偏倚;第二,未对同一个体进行纵向对比,缺乏较长期的追踪观察结果。
综上所述,本研究显示,CD 患儿存在体格及神经心理发育落后。除了重视CD的治疗,还应定期对患儿进行体格及神经心理发育评估,并予以适当干预,以改善患儿预后。
利益冲突声明:所有作者均声明不存在利益冲突。

