阿来替尼致间变性淋巴瘤激酶阳性的非小细胞肺癌患者心动过缓的临床观察与分析Δ
安 娟,丁小胜,化怡纯,周莉莉,张俊丽,李晓燕#,汤传昊
(1.首都医科大学附属北京天坛医院肿瘤内科,北京 100070; 2.北京大学国际医院肿瘤内科,北京 102206)
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)是一种受体酪氨酸激酶,由位于2号染色体上的ALK基因编码,其改变最初发现于间变性大细胞淋巴瘤(因此得名该基因)[1-2];后在多种恶性实体瘤中亦发现变异,2007年在非小细胞肺癌(non-small cell lung carcinoma,NSCLC)中发现棘皮动物微管相关类蛋白4(echinoderm microtubule-associated protein like 4,EML4)基因的外显子1—13与ALK基因的外显子20—29结合的ALK融合基因[3-5]。ALK基因表达率为3%~5%,且多见于无吸烟史的年轻肺腺癌患者[6-7]。第1代酪氨酸激酶抑制剂克唑替尼于2011年在美国被批准用于ALK阳性的NSCLC患者。随后的随机对照试验结果显示,在既往治疗过(PROFILE 1007研究)或初治(PROFILE 1014研究)患者中,该ALK抑制剂均较化疗显著改善了无进展生存期(progression free survival,PFS),但通过ALK基因的二次突变导致的对克唑替尼的获得性耐药很常见,这将其中位PFS限制在约1年[8]。第2代酪氨酸激酶抑制剂阿来替尼是一种强效的ALK抑制剂,最大半抑制浓度为1.9 nmol/L,能有效对抗多种ALK突变,从而克服克唑替尼的耐药[9-13]。与克唑替尼相比,阿来替尼具有更好的疗效和更低的毒性[14]。对3个阿来替尼相关试验(ALEX、NP28673和NP28761研究)的汇总分析结果显示,其最常见的不良事件为胃肠道疾病、肝胆疾病、水肿、皮疹、肌痛、贫血和体重增加,3级以上不良事件发生率为4%。另有报道显示,接受阿来替尼治疗期间,1—2级心动过缓的发生率约为9%。虽然药品说明书已明确说明阿来替尼可致心动过缓,但国内类似报道极少。本研究通过回顾性分析35例接受阿来替尼治疗的ALK阳性的NSCLC患者的基线心率与治疗后心率的差异,比较基线最低心率与治疗后最低心率以及治疗后24 h动态心电图平均心率有无差异,现将结果报告如下。
1 资料与方法
1.1 资料来源
选择2018年8月至2021年6月首都医科大学附属北京天坛医院肿瘤内科35例接受阿来替尼治疗的ALK阳性的NSCLC患者作为研究对象,其中男性患者17例,女性患者18例;年龄28~85岁,中位年龄为52岁;病理诊断:腺癌33例,神经内分泌癌1例,NSCLC 1例;TNM分期:Ⅲ期5例(Ⅲa期2例,Ⅲc期3例),Ⅳ期30例;既往治疗线数为0~4线,中位线数为1线;既往有心脏病史4例,无心脏病史31例;既往服用抗心律失常药物2例,未服用心脏专科药物33例。
1.2 方法
35例患者均采用盐酸阿来替尼胶囊[规格:150 mg(按C30H34N4O2计)]600 mg(4粒),1日2次(日总剂量为1 200 mg)的方法口服给药,持续服药直至疾病进展或发生不可耐受的不良反应。翻阅患者病历资料,定期随访(每2周随访1次),记录患者基线最低心率和治疗后最低心率,治疗后最低心率<60次/min的患者行24 h动态心电图检查。心动过缓定义为最低心率<60次/min。
1.3 统计学方法
采用SPSS 23.0软件包进行统计学数据分析,采用配对T检验方法比较治疗前后的心率,用Fisher精确检验方法进行率之间的比较,用Mantel-Cox方法进行生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 心动过缓发生率及患者特征
35例患者中,8例发生窦性心动过缓,心动过缓发生率为22.86%,中位发生时间为服用阿来替尼6.65个月(范围:3.1~16个月)。在8例发生窦性心动过缓的患者中,男性患者5例(占62.50%),女性患者3例(占37.50%);中位年龄54岁(范围:38~69岁);腺癌7例(占87.50%),神经内分泌癌1例(占12.50%);临床分期:Ⅲ期2例(占25.00%),Ⅳ期6例(占75.00%);中位既往治疗线数为0.5线(范围:0~3线);有1例患者(占12.50%)既往曾诊断为室上性心动过速并行射频消融治疗;8例患者均无抗心律失常药物应用史;根据常见不良事件评价标准5.0版(CTCAE 5.0),8例窦性心动过缓评级均为1级,无2级及以上级别发生,所有患者均无心脏相关不适主诉,至文章发表时8例患者仍持续服用阿来替尼,未行相关干预措施,持续动态观察中。
2.2 发生心动过缓患者治疗前后心率比较
8例发生心动过缓患者的平均基线最低心率为65次/min(范围:58~72次/min),发生心动过缓后的平均最低心率为43次/min(范围:37~50次/min),二者比较,差异有统计学意义(P<0.000 1),见图1(A);24 h动态心电图监测的平均心率为57次/min(范围:46~69次/min)(其中5例<60次/min,3例≥60次/min),与基线最低心率比较,差异有统计学意义(P=0.020 7),见图1(B);5例动态心电图平均心率<60次/min患者的平均心率与基线最低心率之间的差异有统计学意义(P=0.006 9),见图1(C);3例动态心电图平均心率≥60次/min患者的平均心率与基线最低心率之间的差异无统计学意义(P=0.713 3),见图1(D)。
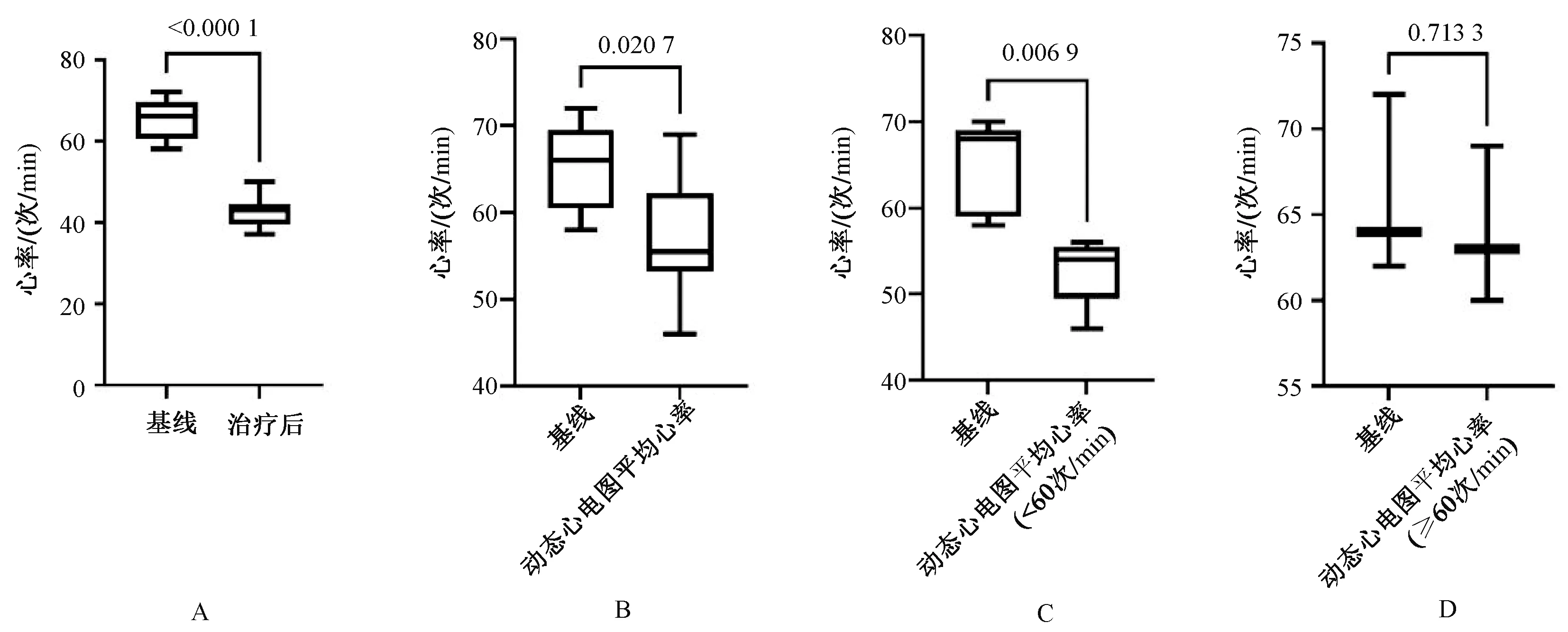
A.心动过缓者基线最低心率与治疗后最低心率比较;B.心动过缓者基线最低心率与动态心电图平均心率比较;C.动态心电图平均心率<60次/min患者平均心率与基线最低心率比较;D.动态心电图平均心率≥60次/min患者平均心率与基线最低心率比较
2.3 不同临床特征患者心动过缓发生率比较
男性患者心动过缓发生率(29.41%)高于女性患者(16.67%),但差异无统计学意义(P=0.443 0),见图2(A);年龄≥50岁的患者心动过缓发生率(25.00%)高于<50岁的患者(18.18%),但差异无统计学意义(P>0.999 9),见图2(B);有脑转移患者心动过缓发生率(27.78%)高于无脑转移患者(17.65%),差异亦无统计学意义(P=0.690 6),见图2(C)。
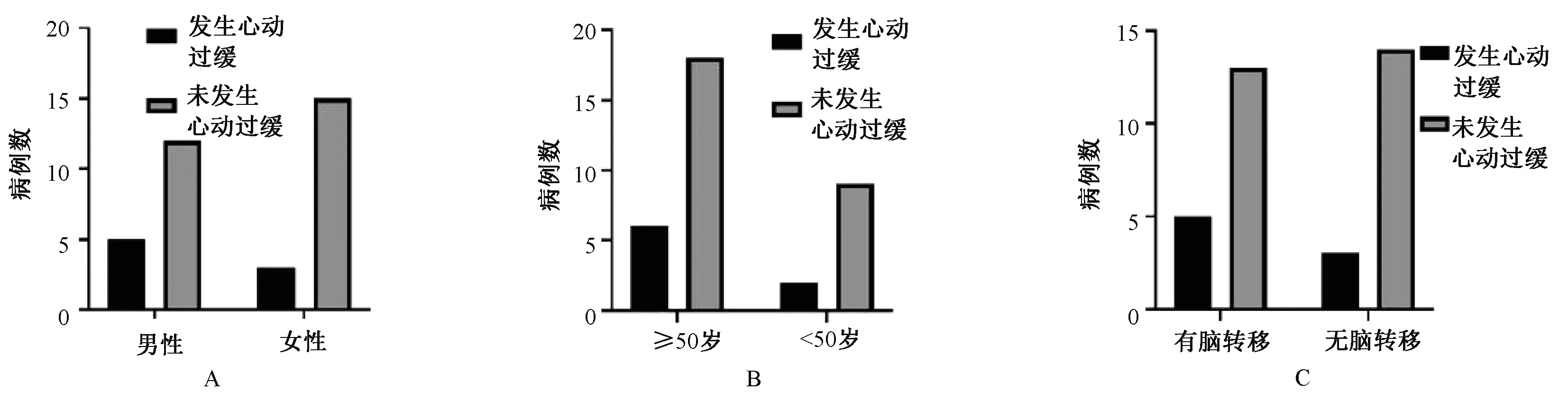
A.性别;B.年龄;C.是否脑转移
2.4 心动过缓对临床疗效和生存时间的影响
发生心动过缓患者的最佳反应率(87.50%,7/8)明显高于未发生心动过缓的患者(44.44%,12/27),二者比较,差异有统计学意义(P=0.047 2),见图3(A);但发生心动过缓与未发生心动过缓患者的PFS比较,差异无统计学意义(P=0.181 1),且中位PFS均未达到,见图3(B)。
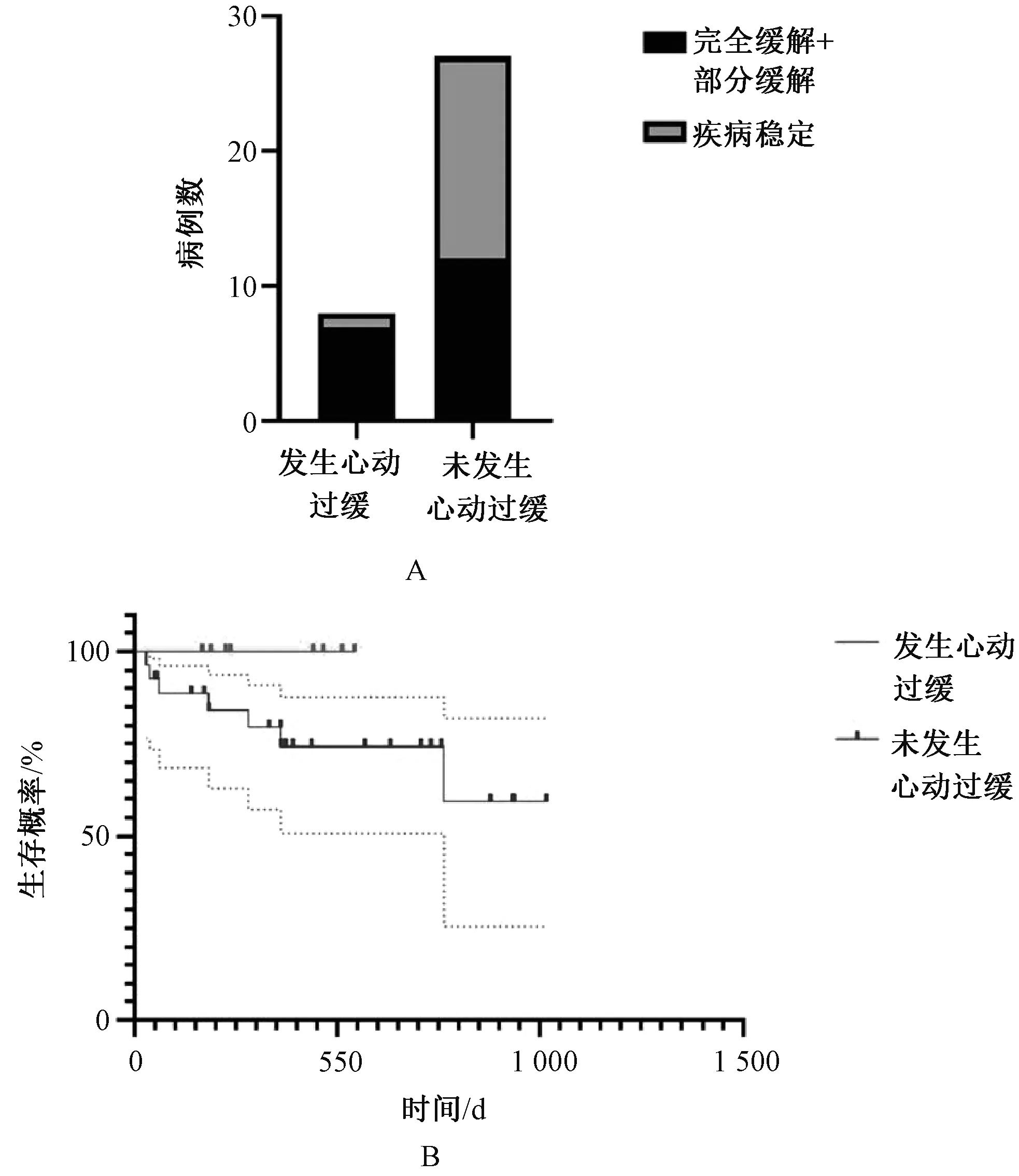
A.最佳反应;B.PFS
3 讨论
阿来替尼是继克唑替尼和色瑞替尼之后,美国食品药品监督管理局批准的第3个治疗ALK阳性的NSCLC患者的靶向药物,为ALK的第2代靶向药物,对克唑替尼治疗进展或不耐受的ALK阳性的NSCLC患者具有明显的临床获益和良好的安全性,美国食品药品监督管理局于2015年加速批准其上市[15-18]。阿来替尼的不良反应之一心动过缓在国内外有少量报道[19-20]。关键Ⅱ期研究NP28761和NP28673研究数据显示其心脏不良反应发生率为6%(13/221),其中窦性心动过缓5例,但心电图QTc间期并无明显延长,且无剂量依赖性,这与其他ALK抑制剂有所区别。阿来替尼可使平均心率降低11~13次/min,但均为无症状性改变[19]。
本研究纳入的35例服用阿来替尼的ALK阳性的NSCLC的患者中,心动过缓发生率为22.86%,明显高于文献报道的数据(6%~9%),且心率降低的程度(21次/min)亦明显高于关键Ⅱ期研究,虽然均为1级不良事件(CTCAE 5.0),未对患者造成严重不良影响,亦不影响药物的继续应用,但仍需引起高度重视,密切观察患者心率及心功能变化,必要时予以停药等临床干预,以免引起严重后果。根据本研究结果,将动态心电图监测平均心率作为监测该不良反应的措施具有临床应用价值,因该检查可以集中且持续监测患者较长一段时间内的心率变化,尤其是夜间心率变化,记录量大,较医务人员每日定点监测所获取的数据量明显增加,并有助于发现无症状心脏风险事件,且临床操作简便,患者易接受。本研究中,男性患者的心动过缓发生率有高于女性患者的倾向,年龄≥50岁患者的心动过缓发生率有高于<50岁患者的倾向,有脑转移患者心动过缓发生率有高于无脑转移患者的倾向,上述差异虽均无统计学意义(P>0.05),但不排除样本量较小导致的抽样误差,尚需进一步扩大病例数进行后续研究。发生心动过缓患者的最佳反应率明显高于未发生心动过缓的患者,差异有统计学意义(P<0.05),但两者PFS的差异无统计学意义(P>0.05),且中位PFS均未达到,尚需进一步延长观察时间。

