草鱼源乳酸菌的分离鉴定及其生物学特性研究
王 楠 ,尹纪元,王英英,李莹莹,吴斯宇,石存斌,李家豪,曹际振,王 庆
(1. 上海海洋大学/水产科学国家级实验教学示范中心,上海 201306; 2. 中国水产科学研究院珠江水产研究所/农业农村部渔药创制重点实验室/广东省水产动物免疫技术重点实验室,广东 广州 510380)
水产养殖业是我国农业经济的重要组成部分[1]。2019年我国渔业生产总值高达12 934.49亿元,草鱼作为最重要的淡水养殖品种之一,约占我国淡水鱼总产量的20%[2]。草鱼呼肠孤病毒 (Grass carp reovirus, GCRV) 引起的草鱼出血病 (Grass carp hemorrhagic disease, GCHD)[3]和嗜水气单胞菌 (Aeromonas hydrophila)、维氏气单胞菌 (A. veronii) 等导致的细菌性败血症[4]是目前草鱼养殖的主要病害,给我国草鱼养殖业带来了巨大的经济损失[5]。疫苗虽能有效控制水产病害发生,且具有安全无污染的优点[6-7],但草鱼用疫苗却只有草鱼出血病灭活疫苗[8]和嗜水气单胞菌败血症疫苗[9]。由于嗜水气单胞菌血清型复杂,疫苗免疫不能完全解决草鱼细菌性病害的防控问题[10]。抗生素和化学药物的使用短期有效,但是水产品药物残留和病原菌耐药性问题日益严重[11-12]。在水产病害防控过程中获得确保水产品质量安全、环境友好且操作简便、易于应用的绿色渔药,是促进我国水产养殖健康发展的当务之急。
乳酸菌等益生菌是一类存在于动物黏膜系统中的共生细菌[13],对酸碱胆盐具有一定的耐受性,能够很好地适应动物胃肠道环境[14]。该菌还能够分解乳糖等多糖,提高饲料利用率[15],改善水质[16];其代谢产生的乳酸、细菌素等物质具有维持机体肠道功能和微生态平衡[17]、抑制病原微生物生长[18]、提高鱼体特异性和非特异性免疫[19]等作用,因此乳酸菌具有通过生态防控减少水产病害发生,减少或替代抗生素和化学药品在水产养殖中使用的潜质[20]。
为了获得鱼源益生菌,本研究从健康草鱼黏膜系统分离乳酸菌,进行形态学观察和种属鉴定,对其理化特性、益生能力进行评价,以期为水产养殖病害生态防控制剂的研究和应用提供候选菌株。
1 材料与方法
1.1 实验材料
维氏气单胞菌、舒伯特气单胞菌 (A. schubertii)、嗜水气单胞菌 (A. hydrophila)、迟缓爱德华氏菌 (Edwardsiella tarda)、铜绿假单胞菌 (Pseudomonas aeruginosa) 等病原菌由中国水产科学研究院珠江水产研究所水产病害与免疫研究室分离保存,乳酸乳球菌NZ9000 (L. lactis NZ9000)、植物乳杆菌标准株ATCC8014 (L. plantarum ATCC8014) 购自广州勤卓生物科技有限公司。MRS肉汤培养基购于北京陆桥技术有限责任公司。过氧化氢 (H2O2)溶液、微生物生化鉴定管等生化试剂均购于广东环凯微生物科技公司。商品乳酸菌购于泉州誉邦商贸有限公司。
1.2 草鱼源乳酸菌的分离纯化
将健康草鱼处死后剪取肠道中段,用灭菌PBS溶液除净肠内容物后剪碎肠组织进行组织匀浆。取适量匀浆液用灭菌PBS溶液倍比稀释后涂布于MRS固体培养基上,置于30 ℃恒温培养箱中培养。挑取菌落呈白色、边缘光滑、中间隆起的小菌落接种在MRS液体培养基中扩大培养后划线培养,重复3次以上,直至菌落形态完全一致。
1.3 分离菌株形态学观察
1.3.1 菌体形态观察 取对数生长期的菌液于载玻片上酒精灯固定,以结晶紫初染1 min,水洗,碘液媒染1 min,水洗,95%乙醇脱色20~30 s,水洗,番红复染1 min,水洗。置于显微镜下观察分离菌株染色情况和菌体形态。
1.3.2 菌落形态观察 将分离菌株在无抗MRS固体培养基上三区划线,置于30 ℃恒温培养箱中静置培养,观察菌落颜色、大小、边缘整齐度等特性。
1.4 种属鉴定试验
1.4.1 初步鉴定 将活化的分离菌株3 000 r·min-1离心5 min后尽弃上清,加入3% H2O2溶液,观察是否有气泡产生;挑取菌体至氧化酶试纸表面,观察菌体颜色变化;取0.05 mL菌液接种于硝酸盐还原生化反应管中30 ℃恒温培养24 h后,依次滴加硝酸盐还原甲液、乙液,观察颜色变化。
1.4.2 生化反应分析 将活化的分离菌株在30 ℃培养箱中培养24 h,按照《伯杰氏细菌鉴定手册》[21],确定其生化反应特征。
1.4.3 16S rRNA 鉴定 按照天根基因组DNA提取试剂盒说明书提取分离乳酸菌基因组DNA,以16S rRNA通用引物 (27F: 5'-AGAGTTTGATCCTGGCTCAG-3', 1492R: 5'-TACGGCTACCTTGT-TACGACTT-3') 进行PCR扩增。PCR反应条件为:98 ℃预变性 3 min;98 ℃变性10 s,53 ℃退火10 s,72 ℃延伸30 s,30个循环;72 ℃延伸2 min。将PCR产物进行琼脂糖凝胶电泳后测序分析[22]。
1.5 生长曲线测定
将活化的乳酸菌分离株稀释至相同浓度,按3%比例接种至MRS肉汤中,37 ℃培养并持续测定菌液浓度至生长平台期,绘制分离菌株的生长曲线。选择分离乳酸菌中发酵性能最好的菌株进行后续评价。
1.6 环境耐受性评价
1.6.1 温度耐受性评价 将分离乳酸菌Y190430按1%接种于MRS肉汤培养基中,分别于20、25、30、37、42 和45 ℃培养,测量分离菌株在不同温度条件下的生长速率。
1.6.2 酸碱耐受性评价 将分离菌株Y190430、标准菌株ATCC8014及商品乳酸菌菌液培养至光密度 (OD600) 为 0.08~0.10,以1%分别接种于pH 为 2.0、2.5、3.0、4.0、5.0、5.6、6.0、7.0、8.0、8.5和9.0的MRS肉汤培养基中,最适温度条件下静置培养并绘制生长曲线。
1.6.3 渗透压耐受性评价 将分离菌株Y190430、标准菌株ATCC8014及商品乳酸菌菌液培养至OD600为 0.08~0.10,以1%分别接种在NaCl质量分数为0.9%、2%、4%、6%和8%的MRS肉汤培养基中,最适温度条件下静置培养并绘制生长曲线。
1.7 抗生素敏感性试验
采用药敏纸片法分析分离的乳酸菌抗生素敏感性。吸取200 μL 37 ℃静置培养12 h,OD600为2.50的分离株菌液涂布于MRS固体培养基上,待干后,分别将青霉素、氨苄西林、多西环素、四环素、氯霉素、氟苯尼考、红霉素和林可霉素的抗生素纸片贴在培养基表面,每组设置4个重复。37 ℃静置培养过夜,测量并记录抑菌圈直径。
1.8 益生效果评价
1.8.1 产酸性能测定 将活化的乳酸菌分离株稀释至相同浓度,按3%比例接种至MRS肉汤中37 ℃培养,持续监测菌液pH变化,并绘制乳酸菌产酸速率曲线,同时与植物乳杆菌标准株ATCC8014、商品乳酸菌的产酸性能进行比较。
1.8.2 抑菌能力分析 采用打孔平板对峙法[23]测定分离菌Y190430对草鱼常见病原菌的拮抗活性,以维氏气单胞菌、舒伯特气单胞菌、嗜水气单胞菌、迟缓爱德华氏菌、铜绿假单胞菌、乳酸乳球菌NZ9000作为指示菌,以植物乳杆菌标准株ATCC8014株和商品乳酸菌作为参考,分别吸取200 μL病原菌菌液均匀涂布到MRS平板上,再用无菌打孔器 (直径6 mm) 均匀打3个孔,每个琼脂孔添加60 μL乳酸菌,每组设置3个重复,生理盐水作为空白对照,置于37 ℃培养24 h,测量并记录抑菌圈直径,同时与植物乳杆菌标准株和商品乳酸菌的抑菌性能进行比较。
1.9 安全性试验
将分离乳酸菌Y190430和植物乳杆菌标准株ATCC8014以生理盐水稀释至终浓度为1×109CFU·mL-1,将平均体质量为140.0 g的草鱼随机分成3组,每组20尾,试验组每天灌胃分离菌200 μL·尾-1,连续灌胃21 d;对照组分别每天灌胃植物乳杆菌标准株和PBS 200 μL·尾-1,连续灌胃21 d,持续观察各组草鱼精神状态和摄食量,并测量各组草鱼体质量。
1.10 统计学分析
使用SPSS 23.0 统计软件对重复测量数据进行One-way ANOVA方差分析,P<0.05 表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 菌株的初步鉴定
通过反复划线纯化,从鱼体肠道共分离纯化得到8株分离菌株,依次编号为C13、C14、C15、C16、C17、C18、C20、C35,分离菌株在固体培养基中培养后菌落形态高度一致,菌落呈圆形、白色、表面光滑、边缘整齐、不透明的小菌落 (图1-a,表1)。革兰氏染色结果为菌体呈短杆状、两端钝圆、染色呈阳性 (图1-b)。

表1 分离菌株的菌落形态特征Table 1 Colony morphological characteristics of isolated strains
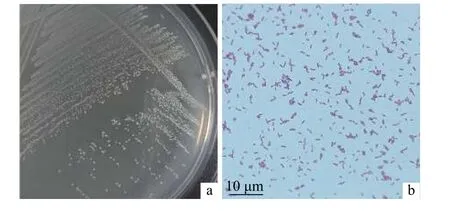
图1 分离菌株的菌落形态特征 (a) 及革兰氏染色 (b)Figure 1 Colony morphological characteristics (a) and gram staining (b) of isolated strains
2.2 鱼源乳酸菌的种属鉴定
分离纯化菌株的过氧化氢酶、氧化酶和硝酸盐还原反应结果均为阴性,初步判定分离菌株为乳酸菌,并按照《伯杰氏细菌鉴定手册》[21]中细菌生理生化指标对分离菌株进行生化鉴定 (表2),鉴定结果表明8株分离乳酸菌均为植物乳杆菌。同时,通过16S rRNA PCR对分离菌株进行鉴定,琼脂糖凝胶电泳分析结果表明离菌株均在1 500 bp位置有特异性扩增条带 (图2)。对PCR产物进行测序分析,16S rRNA测序比对结果表明8株分离菌与植物乳杆菌的相似性均为100%,系统发育树见图3。

图2 分离菌株的16S rRNA序列的PCR扩增结果Figure 2 PCR amplification results of 16S rRNA sequence of isolated strainsM. DL2 000 Marker; 1. C13; 2. C14; 3. C15; 4. C16; 5. C17;6. C18; 7. C20; 8. C35.

图3 基于分离菌株16S rRNA序列的系统发育树Figure 3 Phylogenetic tree based on 16S rRNA sequences of isolated strains

表2 分离菌株的生理生化特征Table 2 Physiological and biochemical characteristics of isolated strains
2.3 生长曲线
通过生长曲线的测定对分离乳酸菌的发酵性能进行评价,结果见图4。大约在接种后第2小时菌株进入对数生长期,在接种后第8小时进入平台期,其中分离菌株C13具有较好的生长速率和最好的发酵浓度及发酵性能,到达平台期的OD600约为2.257,暂命名为L. plantarum Y190430。

图4 分离菌株的发酵生长曲线Figure 4 Fermentation growth curve of isolated strains
2.4 环境压力耐受能力
2.4.1 温度耐受性 将乳酸菌Y190430分别在20、25、30、37、42和45 ℃条件下进行培养,检测分离乳酸菌不同温度条件下的生长情况(图5-a )结果表明分离菌株Y190430在不同温度条件下均能生长。在37 ℃温度条件下分离菌株Y190430生长速率较快,且平台期的菌液浓度最大,OD600为2.257;在42 ℃条件下分离菌株Y190430能够生长,发酵最高OD600为1.328;在45 ℃条件下分离菌株Y190430不再生长。
2.4.2 酸碱耐受性 将乳酸菌Y190430分别接种在不同pH培养基中,37 ℃条件下培养。分离乳酸菌Y190430能够耐受的最小pH为3.0,最适生长pH为5.6,pH 2.0环境中分离菌株Y190430停止生长,环境pH高于7.0时分离菌株Y190430的生长速率降低,但是仍可生长(图5-b)。分离株Y190430与标准株ATCC8014相比较,在pH为2.0、3.0、4.0时的生长速率差异显著 (P<0.01);分离株Y190430与商品株相比较,在pH为2.0、3.0、4.0、5.0、6.0、8.0和9.0时的生长速率差异显著 (P<0.05,表3),说明分离菌株Y190430具有更强的酸碱耐受性。
表3 分离菌株Y190430对酸碱的耐受性Table 3 Acid base tolerance of Y190430 strain ±SD
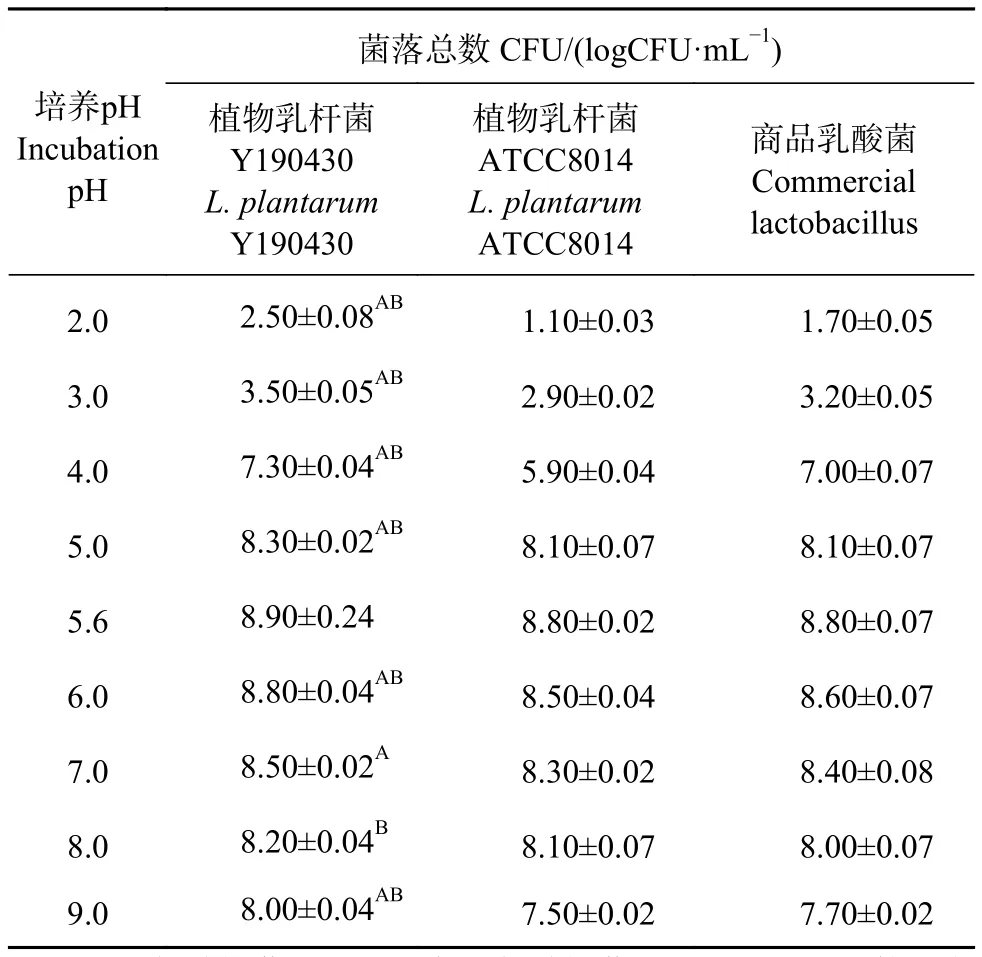
表3 分离菌株Y190430对酸碱的耐受性Table 3 Acid base tolerance of Y190430 strain ±SD
注:A. 植物乳杆菌Y190430与植物乳杆菌ATCC8014相比较具有显著性差异;B. Y190340与商品株相比较具有显著性差异。Note: A. Significant difference between L. plantarum Y190430 and L. plantarum ATCC8014; B. Significant difference between L. plantarum Y190430 and commercial lactobacillus.
商品乳酸菌Commercial lactobacillus 2.0 2.50±0.08AB 1.10±0.03 1.70±0.05 3.0 3.50±0.05AB 2.90±0.02 3.20±0.05 4.0 7.30±0.04AB 5.90±0.04 7.00±0.07 5.0 8.30±0.02AB 8.10±0.07 8.10±0.07 5.6 8.90±0.24 8.80±0.02 8.80±0.07 6.0 8.80±0.04AB 8.50±0.04 8.60±0.07 7.0 8.50±0.02A 8.30±0.02 8.40±0.08 8.0 8.20±0.04B 8.10±0.07 8.00±0.07 9.0 8.00±0.04AB 7.50±0.02 7.70±0.02培养pH Incubation pH菌落总数 CFU/(logCFU·mL-1)植物乳杆菌Y190430 L. plantarum Y190430植物乳杆菌ATCC8014 L. plantarum ATCC8014
2.4.3 渗透压耐受性 将乳酸菌Y190430分别接种在不同NaCl质量分数的MRS液体培养基中,37 ℃条件下培养。分离菌株Y190430对高渗环境具有一定耐受性,在8% NaCl培养环境中,虽然发酵能力减弱,但是仍可生长 (图5-c)。在不同渗透压条件下的适应性,分离株Y190430与标准株ATCC8014之间无显著性差异 (P>0.05)。在0.9%、2% NaCl培养环境中,分离株Y190430与商品株之间存在显著性差异 (P<0.05,表4)。
表4 分离菌株Y190430对渗透压的耐受性Table 4 Osmotic pressure tolerance of Y190430 strain ±SD

表4 分离菌株Y190430对渗透压的耐受性Table 4 Osmotic pressure tolerance of Y190430 strain ±SD
注:B表示植物乳杆菌Y190430与商品株相比具有显著性差异(P<0.05)。Note: B represents significant difference between L. plantarum Y190430 and commercial lactobacillus (P<0.05).
氯化钠质量分数NaCl mass fraction/%菌落总数 CFU/(log CFU·mL-1)植物乳杆菌Y190430 L. plantarum Y190430植物乳杆菌ATCC8014 L. plantarum ATCC8014商品乳酸菌Commercial lactobacillus 0.9 8.90±0.08B 8.80±0.08 8.50±0.16 2.0 8.70±0.16B 8.50±0.16 7.90±0.16 4.0 7.10±0.16 6.90±0.08 6.90±0.16 6.0 6.50±0.08 6.70±0.16 6.40±0.16 8.0 5.10±0.24 5.00±0.16 4.70±0.20

图5 分离菌株Y190430的环境耐受性分析结果a. 温度耐受性;b. 酸碱耐受性;c. 渗透压耐受性。Figure 5 Environmental tolerance analysis results of Y190430 straina. Temperature tolerance; b. Acid base tolerance;c. Osmotic pressure tolerance.
2.5 抗生素敏感性
用多种抗生素的微生物药敏片对植物乳杆菌Y190430的抗生素敏感性进行评价。抑菌直径与标准抑菌直径比较结果表明,分离的植物乳杆菌对氨苄西林、多西环素、四环素、氟苯尼考、氯霉素、红霉素和林可霉素等常见抗生素敏感;对青霉素较敏感 (表 5)。
2.6 益生性能评价
2.6.1 产酸性能 乳酸菌可以通过分泌乳酸等有机酸,调节环境pH、抑制病原微生物。因此乳酸菌的产酸能力可以间接评价其益生效果。测定分离菌株Y190430的产酸速率曲线,同时以植物乳杆菌标准菌株ATCC8014以及商品乳酸菌作为参考。接种后0 h分离菌株Y190430、标准菌株ATCC8014和商品菌株的pH均为5.85;接种后2 h分离菌株Y190430、标准菌株ATCC8014和商品菌株的pH分别为5.54、5.60、5.72;接种后8 h分离菌株Y190430、标准菌株ATCC8014和商品菌株的pH分别为4.07、4.20、4.52;分离菌株Y190430、标准菌株ATCC8014和商品菌株发酵液能够达到的最小pH分别为3.55、3.56、3.80(图6)。相较于标准株ATCC8014,分离菌株Y190430在接种后8~12 h,培养基pH值差异显著(P<0.05),12 h后无显著差异 (P>0.05);与商品株相比较,在接种2 h后,培养基pH差异极显著 (P<0.01),表明分离株Y190430具有更高的产酸速率。2.6.2 抑菌能力 分离获得的草鱼源植物乳杆菌对水产养殖中的常见致病菌均具有一定抑制作用(表6)。与标准株ATCC8014相比较,分离株Y190430对嗜水气单胞菌、迟缓爱德华氏菌、铜绿假单胞菌和维氏气单胞菌的抑菌效果更强,具有显著性差异 (P<0.05)。与商品株相比较,分离株Y190430对迟缓爱德华氏菌、铜绿假单胞菌和维氏气单胞菌的抑菌效果更强,具有显著性差异 (P<0.05)。分离株Y190430对植物乳杆菌、乳酸乳球菌等益生菌不产生抑制作用。

图6 分离株Y190430的产酸性能a. 与标准株相比较具有显著性差异;b. 与商品株相比较具有显著性差异;ab. 与标准株、商品株相比较均具有显著性差异。Figure 6 Ability to produce acid of Y190430 straina. Compared with standard strain, there is a significant difference;b. Compared with commercial lactobacillus, there is a significant difference; ab. Compared with standard strain and commercial lactobacillus, there is a significant difference.
2.7 安全性评价
安全性试验中以分离菌株连续21 d口服灌胃草鱼,试验期间草鱼无一死亡,相较于对照组,试验组草鱼摄食、游动未见异常。试验期间,PBS对照组草鱼平均体质量由141.3 g生长至147.0 g,标准株对照组草鱼平均体质量由139.1 g生长至146.1 g,分离株试验组草鱼平均体质量由139.6 g生长至146.6 g。相较于两组对照组,草鱼体质量增重在试验期间均无显著差异 (P>0.05)。结果表明口服分离菌株草鱼安全性较好,对其生长未产生显著影响。
3 讨论
据《2020中国水生动物卫生状况报告》,2019年我国养殖草鱼因各种病害造成的测算经济损失约25.8亿元[24],严重危害了我国草鱼养殖业的健康发展。抗生素等药物虽然有效但在使用时存在诸多问题[25-26]。乳酸菌等益生菌是健康鱼类黏膜系统内天然共生的一类益生菌,可通过维持或调节宿主肠道微生物平衡,改善宿主健康和生长性能[27],研究发现在虹鳟 (Oncorhynchus mykiss)[28]、凡纳滨对虾 (Litopenaeus vannamei)[29]和海参 (Apostichopus japonicus)[30]等水产动物的日粮中添加乳酸菌能促进生长、提高抗病力,并可以与肠道内有害菌产生竞争,确保肠道健康[31]。本研究从健康草鱼肠黏膜系统中筛选获得8株乳酸乳杆菌,经鉴定均为植物乳杆菌。植物乳杆菌在水产健康养殖中的应用早有报道,Man和Xiang[32]发现植物乳杆菌与其他乳酸菌相比较产酸性能更强,能更好地稳定微环境pH;其代谢产生的乳酸菌素是一种生物防腐剂,可以抑制池塘底部饵料和粪便腐烂,降低水体中氨氮和亚硝酸盐含量;王水泉等[33]研究发现植物乳杆菌分解和利用植物多糖的能力更强,能够更好地提高饲料利用率、净化水质;刘佳琪等[34]构建表达IPNV VP2蛋白的重组虹鳟源植物乳杆菌,口服饲喂虹鳟后能够显著提高其抗感染能力。
发酵能力是评价生物工程菌的重要指标之一,快速增殖的乳酸菌在肠道环境中更容易获得竞争优势,与其他细菌竞争黏膜真皮层的黏附位点[35-36]和营养物质[37],进而竞争性抑制微环境中的病原微生物[38]。本研究对8株分离乳酸菌生长曲线进行测定,结果显示植物乳杆菌Y190430的生长速率较快,发酵浓度最高,具有作为生物工程菌的应用潜力。此外,由于环境中的pH、温度和盐度对细菌繁殖生长具有抑制作用,因此乳酸菌在消化道中的发酵效果也与菌株对pH、温度和盐度等环境因素的耐受能力有关。有研究表明有胃鱼类的胃内pH最低能达2[39],鲤科等无胃鱼类的消化道内pH近中性[40],本研究酸碱耐受试验表明植物乳杆菌Y190430能够耐受的环境最小pH为3.0,因此可以直接在无胃鱼类健康养殖中进行应用,而在有胃鱼类病害防控应用中则需要通过与壳聚糖等生物高分子混合,提高菌剂在胃内的成活率[41]。分离株Y190430的最适培养温度为37 ℃,在20 ℃生长速率虽有所下降,但仍可正常生长;由于鱼类为变温动物,草鱼等淡水鱼类的最适养殖温度为20~30 ℃[42],本研究分离株在20 ℃条件下仍可保持较好的生长性能,因此适合在淡水养殖中应用。此外,在饲料加工和生物技术操作过程中常会在一定范围内提高培养或加工温度,本研究分离乳酸菌可以耐受42 ℃,对高温环境具有一定耐受性,具有作为生物工程菌进行生物工程操作和改造的潜质。
乳酸菌是公认的益生菌,具有改善消化道微环境、提高宿主免疫力、抑制病原微生物等作用,研究表明乳酸菌广泛分布在动物肠道中,维持消化道微生物群落稳定[43]、抑制肠道内致病菌的生长繁殖,与人类[44]和水产养殖动物[35]的健康密切相关。乳酸菌能通过产生乳酸[45]、细菌素、H2O2及小分子肽类等[46]代谢产物对肠道致病菌产生抑菌或杀菌作用,Cai 等[47]证实乳酸菌分泌产生的乳酸是其抑菌的重要物质基础。本研究对植物乳杆菌Y190430的产酸性能进行评价,与植物乳杆菌标准株ATCC8014相比较,分离菌株Y190430具有更好的产酸速率。为了进一步评价分离乳酸菌对病原菌的抑制能力,及其对其他益生菌菌株的影响,本研究发现从健康草鱼黏膜系统分离获得的草鱼源植物乳杆菌Y190430对嗜水气单胞菌、维氏气单胞菌等几种能够引起草鱼发病的条件病原菌均有一定的抑制作用;对植物乳杆菌ATCC8014和乳酸乳球菌NZ9000无抑制作用。与植物乳杆菌标准株ATCC8014相比较,分离株Y190430对嗜水气单胞菌、铜绿假单胞菌和维氏气单胞菌的抑菌作用更显著,表明该菌株对能够针对性抑制导致草鱼病害的主要病原菌,具有作为草鱼病害生态防控制剂的潜质。
益生菌的安全性是其能否在生产中应用的重要前提。益生菌使用不当会引起宿主出现病理变化,有研究表明枯草芽孢杆菌 (Bacillus subtilis) 可引起斑节对虾 (Penaeus monodon) 细菌性白斑综合征[48];蜡样芽孢杆菌 (B. cereus) 可引起刺参“腐皮综合征”和凡纳滨对虾白斑综合征[49-50]。闫肃等[51]研究发现,部分乳酸菌具有溶血活性,也能够对宿主产生一定伤害。为评价分离菌株Y190430的安全性,本研究将1×109CFU·mL-1分离乳酸菌Y190430菌液以200 μL·尾-1连续21 d口服灌胃草鱼,试验期间草鱼无一死亡,与对照组相比较,试验组草鱼摄食、游动等行为无显著异常,且生长速度更快,但与对照组相比无显著性差异 (P>0.05)。
抗菌药物在保证人类和动物健康的同时,也带来了严重的耐药问题。水产养殖动物主要细菌性病原的耐药现象普遍存在[52]。益生菌如果携带抗生素耐药性基因,在使用过程中很可能通过转化、转座等方式转移到环境微生物中,使环境中的病原微生物获得抗生素耐药性[53],对人类健康和生态环境造成潜在威胁。恩诺沙星、氟苯尼考、多西环素和磺胺甲唑是目前用于水产养殖动物细菌性疾病防治的主要药物[54]。乳酸菌可能涉及青霉素类[55]、氨基糖苷类[56]和四环素类[57]的耐药基因及其耐药基因可转移的风险。本研究评价了分离菌株Y190430对氨苄西林等常见抗生素的敏感性,结果表明植物乳杆菌Y190430对氟苯尼考、恩诺沙星和多西环素等常见抗生素的敏感性佳,在应用中既能有效规避耐药转移对人和环境造成的潜在危害,又能为科学用药提供指导意见。
4 结论
本研究从健康草鱼消化道黏膜中分离获得8株乳酸菌,经16S rRNA鉴定和生化反应鉴定此8株乳酸菌均为植物乳杆菌,通过比较生长速率,筛选获得发酵性能最好的菌株Y190430。该分离菌株具有较好的环境耐受性和抗生素敏感性,具有作为生物工程菌开发和应用的潜质。此外该分离菌株还具有很好的产酸性能和常见水产病原微生物拮抗作用,可作为水产病害生态防控的候选菌株。后期将对分离菌株体内抑菌能力和抗病毒能力展开进一步研究,以期能够更好地作为益生菌制剂应用于水产动物病害的生态防控。

