冻干甲型肝炎减毒活疫苗在18 ~24 月龄儿童中接种的免疫原性及安全性评价
董媛媛,王辰皓,徐艳玲,赵淑洁,夏强,姜崴,胡伟军,郭雪
1.陕西省疾病预防控制中心,陕西西安710054;2.长春生物制品研究所有限责任公司,吉林长春130012
甲型肝炎(简称甲肝)是由甲型肝炎病毒(hepatitis A virus,HAV)引起的一种以肝脏损害为主的肠道传染病[1],主要经粪-口途径传播[2],全球每年HAV 感染者约 140 万例[3],接种甲肝疫苗是预防和控制甲肝的有效途径[4]。我国自2007 年将甲肝疫苗纳入国家免疫规划以来,甲肝发病率已从2002 年的 8.29 人 / 10 万下降至 1.67 人 / 10 万[5-7],接种甲肝疫苗能够有效降低甲肝的发病率[8-16]。
长春生物制品研究所有限责任公司研制的冻干甲型肝炎减毒活疫苗于2000 年获得国家药品监督管理局生产批件,2018 年通过工艺变更获得补充申请批件。为进一步评价工艺优化后该疫苗的免疫原性和安全性,本研究于2020 年9 — 11 月在陕西省勉县和洋县疾病预防控制中心对18 ~24 月龄儿童接种了该疫苗,并以其他两个厂家的同类产品作为对照,进行非劣效试验,评价疫苗的免疫原性及安全性。现将结果报道如下。
1 对象与方法
1.1 研究对象 经陕西省疾病预防控制中心伦理委员会审查(批件号:2020-001-07),以受试者法定监护人知情同意、自愿参加原则,在陕西省洋县和勉县疾病预防控制中心临床试验现场,筛选符合研究方案中规定的入选、排除标准的受试者共450 名,按照1 ∶1 ∶1 的比例分别接种试验疫苗和对照疫苗。
1.2 疫苗 试验疫苗(冻干甲型肝炎减毒活疫苗,批号:20191143,规格:复溶后每瓶0.5 mL)由长春生物制品研究所有限责任公司生产;对照疫苗1(冻干甲型肝炎减毒活疫苗,批号:20191148-1,规格:复溶后每瓶0.5 mL)和对照疫苗2(冻干甲型肝炎减毒活疫苗,批号:202005024K-1,规格:复溶后每瓶1.0 mL)为不同厂家生产的同类上市疫苗。上述疫苗含甲肝病毒应不低于6.50 lgCCID50,均在有效期内使用,于2 ~8 ℃运输和保存。
1.3 疫苗接种 免疫程序为1 针次全程免疫,用灭菌注射用水复溶后充分摇匀,经上臂外侧三角肌皮下注射,试验疫苗和对照疫苗1 每次接种剂量为0.5 mL,对照疫苗2 每次接种剂量为1.0 mL。
1.4 免疫原性观察 采用单中心、随机、平行对照的非劣效试验,18 ~ 24 月龄儿童按照 1 ∶1 ∶1 接种1 剂试验疫苗或两种对照疫苗。所有受试者于免疫前、免疫后30 d 采集静脉血,分离血清,于-20 ℃以下保存,由中国食品药品检定研究院采用电化学发光法检测人血清HAV 总抗体(HAV 抗体检测试剂盒由罗氏诊断有限公司制备,批号:47932801)。HAV抗体水平 ≥ 20 mIU / mL 判为阳性。免疫前HAV抗体水平 < 20 mIU / mL,免疫后 ≥ 20 mIU / mL 或免疫前HAV 抗体水平 ≥ 20 mIU / mL,免疫后HAV抗体水平 4 倍增长为阳转[12,15]。试验组与对照组抗体阳性率、阳转率差值的95% CI 下限>-10%则非劣效检验成立。
1.5 安全性观察 记录所有受试者免疫后30 min、0 ~ 7 d、8 ~ 30 d 内的不良事件(adverse events,AEs),并随访至接种后6 个月。参照国家食品药品监督管理局关于《预防用疫苗临床试验不良反应分级标准指导原则》(国家药监局 2019 年第 102 号)[16]对 AE进行判定。
1.6 统计学分析 采用STATA 17.0 软件进行统计分析,定量指标用中位数、最大值、最小值表述,定性指标或等级指标用频数分布表进行统计描述。免疫原性组间比较采用卡方检验/ 非劣效检验;AE 发生率组间比较采用卡方检验 / Fisher 确切概率法。以P <0.05 为差异有统计学意义。
2 结 果
2.1 受试者脱落情况 共入组450 名受试者,进入安全性分析集(safety set,SS)449 名(99.78%),其中试验组150 名(100%),对照组1 149 名(99.33%),对照组 2 150 名(100%);进入全分析集(full analysis set,FAS)446 名(99.11%),其中试验组 150 名(100%),对照组1 147 名(98.00%),对照组2 149 名(99.33%);进入符合方案数据集(per protocol set,PPS)分析集427 名(94.89%),其中试验组 141 名(94.00%),对照组 1 142 名(94.67%),对照组 2 144 名(96.00%)。试验过程中受试者脱落23 名(5.11%)。
2.2 受试者人口学特征分布 试验组、对照组1、对照组2 在月龄、性别、身长、体重构成组间差异均无统计学意义(P > 0.05),见表 1。
2.3 免疫原性
2.3.1 免疫后PPS 数据集抗体阳性率 试验组、对照组1 和对照组2 全研究人群免疫后抗体阳性率分别为100%、100%和99.31%;免疫前阴性者免疫后抗体阳性率分别为100%、100%、99.28%;免疫前阳性者免疫后抗体阳性率均为100%。试验组与对照组全研究人群免疫后抗体阳性率、免疫前阴性者免疫后抗体阳性率、免疫前阳性者免疫后抗体阳性率率差的95% CI 下限均>-10%,试验组免疫后抗体阳性率非劣效于对照组1 和对照组2。见表2~表4。
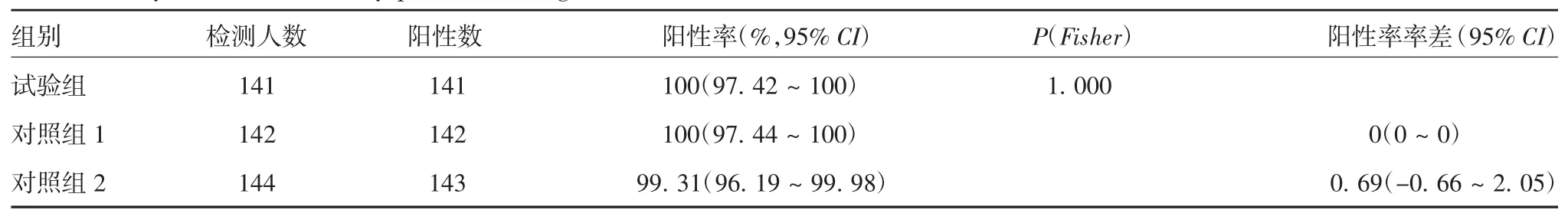
表2 免疫后HAV 总抗体阳性率分析(PPS 集)Tab.2 Analysis of total antibody positive rate against HAV after immunization(PPS set)

表4 免疫前阳性者免疫后HAV 抗体阳性率分析(PPS 集)Tab.4 Analysis of antibody positive rate of HAV after immunization in subjects positive for antibody before immunization(PPS set)
2.3.2 免疫后PPS 数据集抗体阳转率 试验组、对照组1 和对照组2 全研究人群免疫后HAV 总抗体阳转率分别为100%、99.30%和99.31%;免疫前阴性者免疫后抗体阳转率分别为100%、100%和99.28%;免疫前阳性者免疫后抗体阳转率分别为100%、0.00%和100%。试验组与对照组全研究人群免疫后抗体阳转率、免疫前阴性者免疫后抗体阳转率、免疫前阳性者免疫后抗体阳转率率差的95%CI 下限均>-10%,试验组免疫后抗体阳转率非劣效于对照组1 和对照组2,见表5 ~表7。
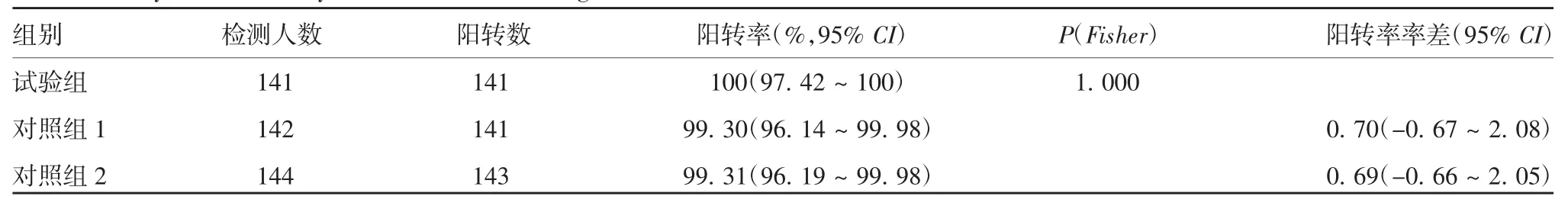
表5 免疫后HAV 总抗体阳转率分析(PPS 集)Tab.5 Analysis of antibody seroconversion rate against HAV after immunization(PPS set)

表7 免疫前阳性者免疫后HAV 抗体阳转率分析(PPS 集)Tab.7 Analysis of antibody seroconversion rate against HAV after immunization in subjects positive for antibody before immunization(PPS set)
2.4 安全性
试验组、对照组1 和对照组2 总AE 分别为30(20.00%)、33(22.15%)和 36 例(24.00%),见表 8。征集性事件中局部反应发生率分别为2 例(1.33%)2 例次、2 例(1.34%)2 例次和 1 例(0.67%)1 例次;全身反应发生率分别为18 例(12.00%)24 例次、21例(14.09%)25 例次和 24 例(16.00%)33 例次。非征集性AE 发生率分别为13.33%、11.41%和14.00%。总AE、征集性AE 和非征集性AE 发生率以及严重程度组间差异均无统计学意义(P > 0.05),见表9。
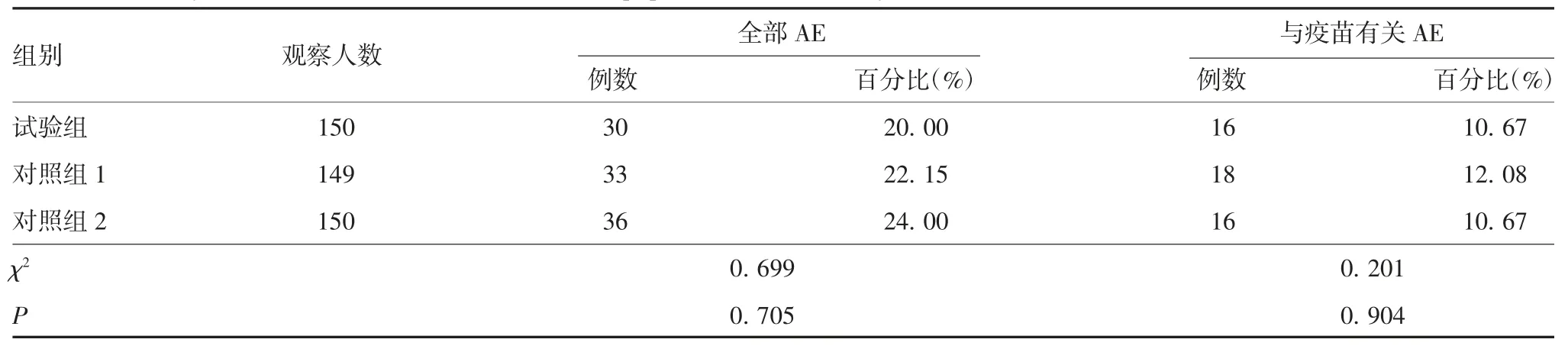
表8 全研究人群总AE 总结Tab.8 Summary of total adverse events in the whole population in this study

表9 全研究人群AE 发生情况Tab.9 Incidence of adverse reactions in the whole population in this study
2.4.1 局部反应症状 试验组、对照组1 和对照组2局部反应症状均以1 级为主。对照组2 出现1 例(0.67%)红晕,对照组 1 出现 1 例(0.67%)肿胀,试验组和对照组1 分别出现2 例(1.33%)和1 例(0.67%)皮疹。局部反应症状及严重程度各组间比较差异均无统计学意义(P > 0.05),见表10。3 组均未观察到3 级局部反应。

表10 受试者局部反应症状发生情况Tab.10 Incidence of symptoms of local reactions in subjects
2.4.2 全身反应症状 试验组、对照组1 和对照组2 全身反应以1、2 级居多,主要为发热,其中发热反应以2 级为主。各组发热1 级发生率分别为2.00%、0.67%和3.33%;发热2 级发生率分别为5.33%、8.05%和10.00%。全身反应症状及严重程度各组间比较差异均无统计学意义(P > 0.05),见表11。

表1 全研究人群人口学特征Tab.1 Demographic characteristics of the whole population in this study

表11 受试者全身反应症状发生情况Tab.11 Incidence of symptoms of systemic reactions in subjects
2.4.3 严重不良事件(serious adverse events,SAE)共观察到5 例SAE,试验组2 例以及对照组2 的3例均发生于接种疫苗后30 d 内,最终判定均与疫苗接种无关。
综上,征集性 AE 主要以 1、2 级为主,3 级不良反应发生率低,且各组间比较差异无统计学意义(P > 0.05),未见4 级不良反应发生。局部反应只见红晕、肿胀和皮疹,且发生率较低。全身反应多数为发热,其他全身反应发生率较低,且各组间比较差异无统计学意义(P > 0.05)。共收集5 例SAE,均判定与疫苗接种无关。

表3 免疫前阴性者免疫后HAV 抗体阳性率分析(PPS 集)Tab.3 Analysis of antibody positive rate against HAV after immunization in subjects negative for antibody before immunization(PPS set)

表6 免疫前阴性者免疫后HAV 抗体阳转率分析(PPS 集)Tab.6 Analysis of antibody seroconversion rate against HAV after immunization in subjects negative for antibody before immunization(PPS set)
3 讨 论
随着我国甲肝疫苗在20 世纪90 年代普及应用后[3-4,11],高接种覆盖率已有效在人群中建立了免疫保护屏障,并大幅降低了甲肝的发病率[3-5,12]。根据国家免疫规划疫苗儿童免疫程序,儿童基本在1.5 ~2 岁完成甲肝疫苗接种[15]。目前国内使用的甲肝疫苗主要有灭活疫苗和减毒活疫苗两种,除少数地区外,大部分省区免疫规划用疫苗为甲肝减毒活疫苗[9-10]。本研究涵盖了国内3 家生产厂家的甲肝减毒活疫苗,进行了疫苗免疫原性及安全性比较。
免疫原性结果显示,接种1 剂甲肝减毒活疫苗后,试验组全研究人群免疫后抗体阳性率、免疫前阴性者免疫后抗体阳性率、免疫前阳性者免疫后抗体阳性率、全研究人群免疫后抗体阳转率、免疫前阴性者免疫后抗体阳转率及免疫前阳性者免疫后抗体阳转率均非劣效于两个对照组(P >0.05)。
安全性结果显示,试验组和两个对照组总体AE发生率、征集性AE 发生率、非征集性AE 发生率及与疫苗相关的AE 发生率组间差异无统计学意义(P >0.05)。局部反应观察到红晕、肿胀和皮疹,均为1、2 级,未见3 级。全身反应以2 级发热为主,试验组发热率低于对照组1 和对照组2。共观察到5 例SAE,均与疫苗接种无关。
综上所述,本次临床试验结果证明,长春生物制品研究所有限责任公司通过工艺优化生产的甲肝减毒活疫苗,其免疫原性和安全性与国内其他厂家生产的甲肝减毒活疫苗相当,在18 ~ 24 月龄儿童中免疫效果显著,安全性良好,适合推广使用。

