巨噬细胞移动抑制因子在慢性阻塞性肺疾病发病机制中的作用*
张 敏,李 倩,李玲玲
(1.皖南医学院弋矶山医院急诊内科,安徽 芜湖 0241001;2.皖南医学院弋矶山医院呼吸与危重症医学科)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是最常见的慢性肺病之一,其特点是不可逆性、进展性气流受限[1]。COPD有多种病因,如吸烟、环境污染和衰老等,其中吸烟是造成COPD的主要病因,肺部长期反复暴露于香烟烟雾的有毒成分中,导致肺部细胞损伤引起炎症[2]。许多介质参与COPD的发病,迄今为止,关于导致COPD发生和进展的分子机制知之甚少,因而目前尚无有效的治疗方法。
巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)是一种炎症因子,通过调节其它促炎介质的释放来控制炎症的“设定点”[3]。已有研究证明,MIF与各种炎症性疾病的发病有关,如感染性休克、糖尿病、结肠炎、类风湿性关节炎和肾小球肾炎等[3-5]。MIF在多种细胞中表达,包括肺中的肺微血管内皮细胞、血管平滑肌、成纤维细胞和支气管上皮细胞[6-9]。MIF具有酶的活性,可以催化D-多巴色素以及苯丙酮酸的互变异构化,被认为是蛋白质互变异构酶超家族的成员[10]。MIF可诱导细胞因子和其他炎症介质的表达,包括TNF-α、IFN-γ、IL-1β、IL-2、IL-6、IL-8、IL-12、CO、特异性基质金属蛋白酶和花生四烯酸级联产物等[11]。MIF还能上调经典的先天免疫受体Toll样受体4和特殊的微生物传感器,如dectin-1[12]。
MIF是一种普遍存在的蛋白,MIF缺陷小鼠具有正常的发育、体格以及行为,且发生自发性年龄相关性肺气肿、哮喘的几率低于野生型对照小鼠,MIF在哮喘、COPD和肺癌中的表达和反应性存在差异[13,14]。此外,与野生型小鼠相比,随着小鼠老龄化,抗氧化活性的差异进一步增加[15],MIF缺陷小鼠的支气管肺泡灌洗液检测结果显示其抗氧化活性降低。MIF可以通过防止组织衰老和损伤发挥有益作用,这可能是MIF与慢性肺病发展有关的原因。MIF可能与COPD的自我修复反应有关,但需要更多的研究来充分阐明MIF在COPD发生发展中的作用。本研究旨在测定COPD患者、健康不吸烟者和健康吸烟者血清中MIF水平,探讨MIF在慢性阻塞性肺疾病发生发展中的作用。
1 对象与方法
1.1临床资料 本组研究对象年龄在45~75岁,分成三组:健康不吸烟组、健康吸烟组和COPD组。纳入标准:在COPD患者中,预测FEV1(FEV1 %)的百分比 < 80 %,FEV1/FVC(%)比值 < 70 %。吸烟者的FEV1 ≥ 80 %预测正常值,FEV1/FVC(%)比值>70 %,目前或以前吸烟者至少有20年累积吸烟史。相反,不吸烟者FEV1≥ 80 %预测正常值,FEV1/FVC(%)比值>70 %。排除标准:(1)患有其他阻塞性肺病(哮喘病史,囊性纤维化,支气管扩张,闭塞性细支气管炎或声带功能障碍)的成年人;(2)由于语言、认知或其他障碍原因而不能给予知情同意的成年人;(3)由于认知、健康或其他原因不能进行肺活量测定的成年人。本研究所有参与者签署了皖南医学院弋矶山医院医学伦理委员会批准的知情同意书。
1.2实验室测量 抽取受试者晨起空腹外周静脉血10 mL,注入EDTA抗凝管,然后将血样品在4 ℃以2 500 g转速离心15 min。提取离心后的血清并在-80 ℃环境中储存。采用ELISA法,按照试剂盒说明书检测血清MIF浓度。

2 结果
2.1患者的临床特征 COPD患者组与不同对照组之间年龄、性别、身高和体重的差异无统计学意义(P>0.05),具有可比性,FEV1/FVC(%)、FEV1(%)数值大小差异有统计学意义,结果详见表1。

Table1 Baseline characteristics of the study population
2.2三组患者血清MIF的表达 经单因素方差分析可知,三组患者血清MIF的表达数值差异有统计学意义(P<0.05)。经LSD检验两两比较结果显示,与健康不吸烟者比较,COPD患者血清样本中MIF蛋白水平显著降低(P<0.05);COPD患者血清中MIF蛋白水平显著低于健康吸烟者(P<0.05);健康不吸烟者和健康吸烟者的血清MIF浓度差异无统计学意义(P>0.05)。结果详见表2。

表2 三组患者血清MIF的表达比较
2.3血清MIF水平与COPD严重程度的关系 为了表明MIF与疾病严重程度之间的关系,参考GOLD(慢性阻塞性肺病全球倡议)标准进一步将COPD患者分类后进行分析发现,重度COPD患者(GOLD 3级)患者的血清MIF显著低于轻度COPD(GOLD1级和2级)患者(P<0.05)。结果详见表3。
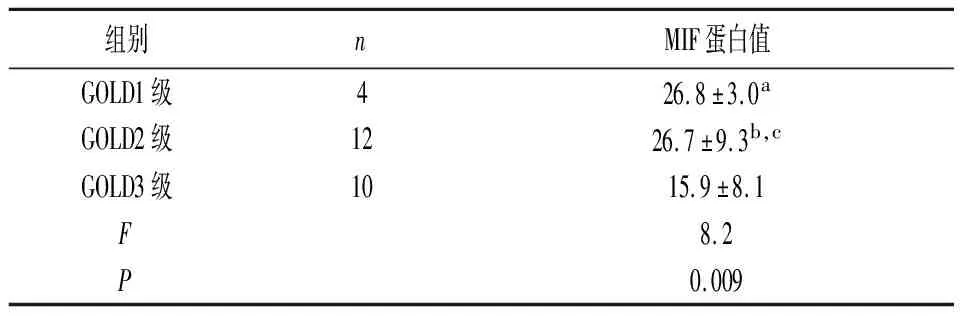
表3 不同严重程度COPD血清MIF水平的比较
3 讨论
COPD是一种对人类健康危害极大的疾病,在美国被列为第三大死亡原因[16]。目前针对COPD病理机制的研究并未得到明确答案[17-21]。因为即使在暴露于吸烟这种主要危险因素的人群中,COPD的发生也并不普遍。因此,了解吸烟患者COPD易感性的决定因素对于制定改进预防和治疗策略至关重要。本次研究分析细胞因子MIF作为COPD易感性可能调节因子的作用。
本次研究结果显示,COPD患者血清中MIF的表达明显低于健康对照组(吸烟者和不吸烟者),并且重度COPD患者的血清MIF明显低于轻度患者。我们的研究发现与先前的两项研究一致[22-23],但是与另两项研究相反[24-25]。Russell等[25]研究发现COPD患者痰液和支气管肺泡灌洗液中MIF增加,但血清中MIF未增加。而Husebø等[24]研究表明,COPD患者的血清MIF水平明显高于对照组,并在AECOPD患者中MIF水平更高。Fallica等[22]研究结果显示,与健康吸烟者相比,COPD患者的血清MIF普遍较低,GOLD 4级患者的MIF水平显著降低,而GOLD 2级和GOLD 3级患者的MIF水平与健康吸烟者相似。我们的研究结果是可靠的,因为对混杂因素进行了控制,如体重指数、性别和合并疾病等。我们的研究结果和以前的研究结果似乎表明,MIF在肺组织样本中表达水平较高,而在COPD患者的血液MIF水平较低。这可能说明MIF的表达直接受肺部疾病的影响。COPD患者的全身性炎症的来源至今仍不是很清楚。全身性炎症可能是炎症介质从肺部释放到全身各组织的结果[26-28]。吸烟引起的炎症在COPD的发病机制中起着至关重要的作用,已被广泛接受[29]。例如在COPD患者中,无论目前吸烟与否,炎症依然是持续存在的[30-32]。我们的研究结果表明,MIF作为一种全身炎症反应的标志物,患者吸烟的数量可能与血清MIF水平有关。我们的研究结果还表明,重度COPD患者(GOLD 3级)的血清MIF显著下降。这一结果可能解释了为什么COPD患者戒烟者和吸烟者存在持续性的炎症。
在吸烟造模的COPD小鼠中发现,COPD小鼠肺组织中MIF mRNA和蛋白质的水平均低于对照组小鼠[33]。另一项研究发现,MIF敲除小鼠会出现与年龄有关的自发性肺气肿,也更容易受到香烟烟雾的影响导致肺气肿[34]。然而,在臭氧诱导的COPD小鼠模型的两项研究发现,与暴露于空气的小鼠相比,暴露于臭氧的小鼠在肺和支气管肺泡灌洗液中的MIF mRNA和蛋白质水平表达更高[35]。COPD动物模型的数据表明MIF的水平根据造模方法而改变,这与COPD患者的研究中观察到的结果一致,表明在COPD患者中MIF水平受多个因素的影响,MIF及其受体在气道疾病中的作用也可能更广泛。吸烟调节肺泡巨噬细胞的极化,这对COPD的发病机制具有重要意义[36]。
本研究存在以下几点不足:首先,该研究是横断面分析,样本量相对较小,因此无法进行分层分析;其次,没有足够的临床数据来解决MIF与其他临床相关变量之间的关系,例如通过高分辨率胸部断层扫描进行定量肺气肿重塑;最后,本次研究未同时分析局部肺部炎症,因此无法确定全身炎症与局部肺部炎症之间的关系。
综上所述,本次研究通过分析MIF在COPD炎症中的作用,表明了MIF表达减少与COPD之间的关系,而且,本次研究发现MIF与COPD的严重程度有关。未来继续探讨MIF在COPD中的具体机制,评估MIF是否可以作为COPD患者的治疗靶点,进一步分析并阐明MIF在COPD治疗上的作用。

