TNF-α对足细胞损伤的影响
苑佳奇,沈晓丹,张志凤,丁海麦,张学明
(包头医学院基础医学与法医学院,内蒙古 包头 014040)
肾小球结构在肾单位内,肾小球过滤屏障负责血液从传入小动脉到鲍曼间隙的选择性过滤。过滤屏障包括3层:肾小球上皮、基底膜和缝隙隔膜。足细胞维持肾小球过滤屏障,足细胞足突附着在肾小球基底膜(glomerular basement membrane,GBM)的肾小球毛细血管上,形成细胞间连接,在相邻足突之间的界面上呈阶梯状结构,形成缝隙隔膜过滤屏障,帮助维持正常的肾功能。缝隙隔膜是阻止蛋白质进入尿液滤液的最后一道屏障[1]。足细胞由细胞体、主要突起和足突组成的复杂细胞组织,足突有三个膜结构域,分别是顶端膜结构域(apical membrane domain,AMD),基膜结构域(basement membrane domain,BMD)和裂孔隔膜(slit diaphragm,SD)。这三个结构域都与细胞骨架相互连接。足突中含有高度有序的、平行的、可收缩的肌动蛋白纤维束,细胞骨架及肌动蛋白纤维束破坏,会使足细胞损伤进而导致足突抹消、SD选择性滤过功能受损,进而形成蛋白尿[2]。有研究表明单个足细胞分子异常与蛋白尿和肾小球硬化之间存在因果关系[3]。足细胞应激细胞通常在健康状态下保持体内平衡,当遇到生理压力或病理刺激时,它们适应于保持功能,但当压力超过其补偿能力时,可能会受到损伤。受损的足细胞会消失,从而失去结构并扩散,导致过滤屏障功能降低。蛋白尿是足细胞受损的早期结果,也是肾脏疾病的早期症状。足细胞损伤可引起微小病变性肾病和局灶节段性肾小球肾病。随着对足细胞生物学研究的深入,尤其是在发现足细胞表达的一些特异性蛋白分子之后,足细胞已被认为是参与各种原发性或继发性肾小球疾病进展的关键细胞。因此足细胞在肾脏疾病中具有关键作用。
肿瘤坏死因子α(Tumor necrosis factor alpha,TNF-α)由157个氨基酸组成,属于TNF超蛋白家族。它是一种涉及系统性炎症的细胞因子,主要由巨噬细胞直接分泌,其主要功能是调节免疫细胞,引起细胞凋亡、炎症和自身免疫[4]。通过TNF-α建立足细胞损伤模型有利于进一步研究足细胞损伤所引起疾病的分子机制,为疾病的诊断和治疗提供新的方向。
1 对象与方法
1.1材料 来源于南京医科大学的MPC5小鼠肾足细胞;TNF-α购自abcam公司;RIPA裂解液(强)、PMSF(100 Mm)、BCΑ蛋白浓度测定试剂盒、极超敏ECL化学发光试剂盒、一抗二抗去除液﹑SDS-PAGE蛋白上样缓冲液(5×)、彩色预染Marker、TEMED购自于上海碧云天生物技术有限公司;Tween-20﹑TritonX-100购自美国Amresco公司;0.45 μm PVDF膜购自美国Immobilon®-P公司;Synaptopodin兔多克隆抗体﹑RhoA兔多克隆抗体﹑14-3-3β兔多克隆抗体﹑HRP标记山羊抗兔IgG﹑HRP标记Tubulin小鼠单克隆抗体购自abcam(英国)生物技术公司;罗丹明标记的TRITC鬼笔环肽荧光染色剂购自上海翊圣生物科技有限公司。
1.2方法
1.2.1模型制备 在33 ℃、5 % CO2条件下将75 cm2培养瓶中的足细胞培养至80 %~90 %时进行传代,将增殖过程中生长状态良好汇合度达到80 %的足细胞进行分化培养。分化细胞在37 ℃,5 % CO2条件下培养6.5 d后,将培养基全部吸出,用PBS清洗两次,加入3 mL无血清的1640培养基培养4 h后,再加1 %的FBS 3μL,并依次加入6个不同体积的浓度为10ng/μL TNF-α使终浓度为0、5、10、20、30、40 ng/mL,37 ℃继续培养24 h后,收集细胞,提取蛋白用于Western Blot。分别给予相同浓度的TNF-α 10 ng/mL和20 ng/mL作用时间分别为6、12、24、36、48 h,分别收集细胞,提取蛋白用于Western Blot。
1.2.2形态学检测 将爬片放置于12孔板,每孔接入1×104数量的足细胞培养6.5 d后,更换培养基,每孔按TNF-α浓度为0、5、10、20、30、40 ng/mL培养24 h(将这6组设置为A、B、C、D、E、F组,其中A组为对照组),爬片取出后用 4 % 的甲醛溶液固定,通过 0.5 % Triton X-100溶液的透化处理,然后将罗丹明标记的鬼笔环肽与足细胞进行免疫荧光染色,最后通过共聚焦显微镜观察足细胞骨架结构。
1.2.3Western印迹 样品处理每个60 mm培养皿加入100 μL含有PMSF的 RIPA裂解液,超声裂解提取总蛋白溶液。使用BCA蛋白浓度测定试剂盒测定总蛋白浓度,用含有 PMSF 的 RIPA 裂解液稀释各样品浓度相同,SDS-PAGA上样缓冲液(5×)制备上样蛋白,煮沸5min使蛋白变性,-20 ℃保存。用10 %分离胶,5 %浓缩胶进行垂直电泳后转膜,5 %脱脂牛奶封闭1h,孵育一抗HRP标记的Tubulin(1∶2000)、Synaptopodin(1∶500)、RhoA(1∶1000)、14-3-3β(1∶1000)4 ℃过夜(12~18 h),TBST洗膜三次,10 min/次。孵育HRP标记的山羊抗兔二抗(1∶2000)室温2 h,TBST洗膜三次,10 min/次。用Western blot方法检测蛋白表达,将膜置于天能凝胶成像仪上进行化学发光影像采集,Image J软件进行目的蛋白相对定量分析及统计。
1.3统计学分析 Western blot结果使用Image J、SPSS 17.0统计软件进行灰度值分析,对目的蛋白进行相对定量(相对蛋白表达量=灰度值目的蛋白/灰度值内参)分析并统计,以P<0.05为差异有统计学意义。
2 结果
2.1足细胞鬼笔环肽免疫荧光染色 利用鬼笔环肽免疫荧光染色检测细胞骨架变化(图1A~F),图1A和图1B显示足细胞肌动蛋白丝(F-actin)经罗丹明标记的TRITC-phalldidin染色后,F-actin 被染成红色并均匀分布于细胞内,而图 C-F 经罗丹明标记的 TRITC-phalldidin 染色后肌动蛋白应力纤维减少,细胞边缘染色程度较细胞中央强,且细胞骨架排列失调,经图1A与图1B~F比较分析表明,足细胞分化培养中,TNF-α 浓度达到10 ng/mL 后,就可以诱导足细胞骨架损伤。
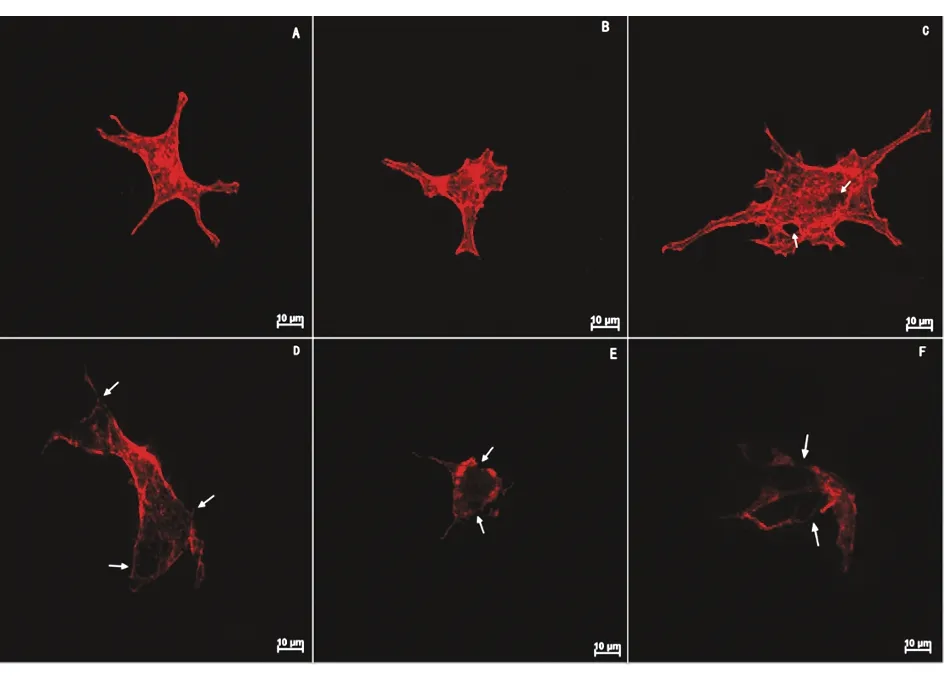
图1 足细胞鬼笔环肽荧光染色(原始放大倍数1000×,A~F)
2.2Western印迹结果 不同浓度 TNF-α 诱导足细胞24 h 体外培养的足细胞,分化培养6.5 d后,添加TNF-α 0、5、10、20、30、40 ng/mL诱导损伤培养24 h,采用Western Blot从蛋白表达水平检测足细胞中Synaptopodin、RhoA及14-3-3β的表达变化(图2)。随着培养液中TNF-α浓度的增加与正常对照组比较,Synaptopodin、RhoA及14-3-3β表达水平以α-Tubulin为内参得到的各组相对表达量从TNF-α 浓度为10.00 ng/mL起逐渐降低,且差异有统计学意义(n=3, *P<0.05)。该结果也表明:TNF-α浓度为10 ng/mL足细胞发生损伤,随着TNF-α浓度的升高,足细胞中Synaptopodin、RhoA及14-3-3β的表达水平均显著降低,表明足细胞损伤模型建立成功。
2.3TNF-α 浓度为10 ng/mL 诱导足细胞不同时间 体外培养的足细胞,分化培养6.5 d后,添加 TNF-α 浓度为10 ng/mL诱导损伤培养6、12、24、36、48h,采用Western Blot从蛋白表达水平检测足细胞中Synaptopodin、RhoA及14-3-3β的表达变化(图2)。细胞培养液中TNF-α浓度为10 ng/mL,随着细胞损伤培养的时间越长,Synaptopodin、RhoA及14-3-3β表达水平以α-Tubulin为内参得到的各组相对表达量均下降,且差异有统计学意义(n=3, *P<0.05)。该结果也表明:TNF-α 浓度为10 ng/ml诱导损伤培养细胞时间越长,足细胞中Synaptopodin、RhoA及14-3-3β的表达水平降低越明显,表明足细胞损伤模型建立成功。
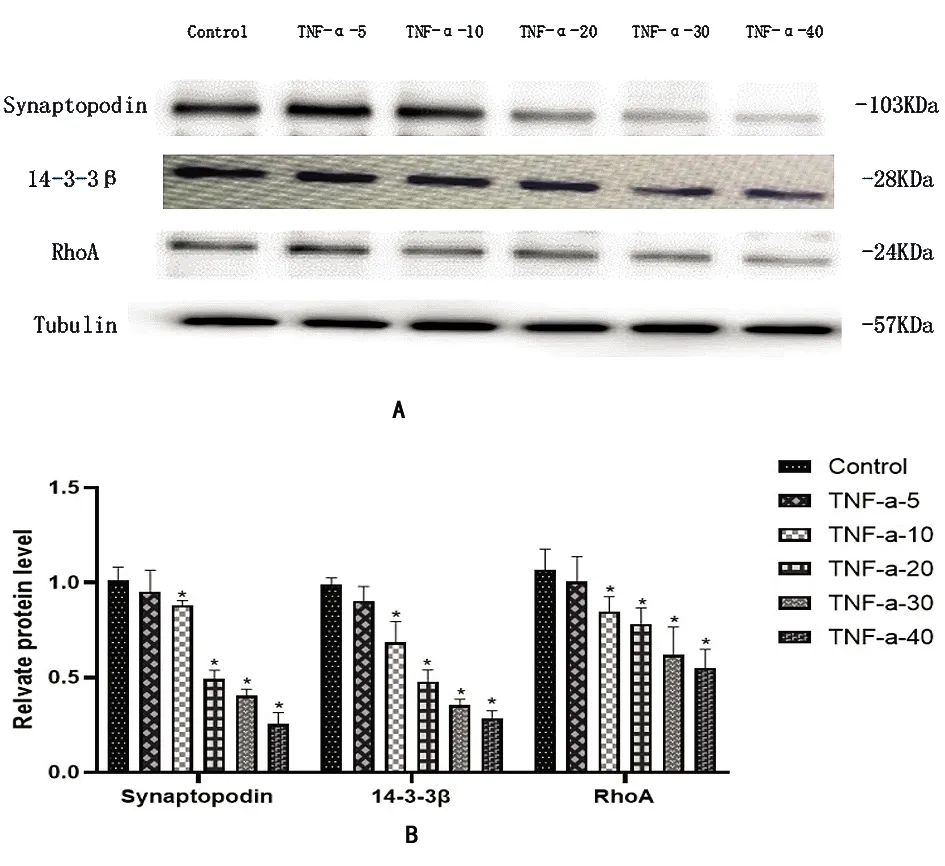
图2 肾足细胞中各组synaptopodin、14-3-3β、RhoA蛋白表达
2.4TNF-α 浓度为20 ng/mL 诱导足细胞不同时间 体外培养的足细胞,分化培养6.5 d后,添加 TNF-α 浓度为20 ng/mL诱导损伤培养6、12、24、36、48 h,采用Western Blot从蛋白表达水平检测足细胞中Synaptopodin、RhoA及14-3-3β的表达变化(图3)。细胞培养液中TNF-α浓度20 ng/mL,随着细胞损伤培养的时间越长,Synaptopodin、RhoA及14-3-3β表达水平以α-Tubulin为内参得到的各组相对表达量均下降,且差异有统计学意义(n=3, *P<0.05)。该结果也表明:TNF-α 浓度为20 ng/mL诱导损伤培养细胞时间越长,足细胞中Synaptopodin、RhoA及14-3-3β的表达水平降低越明显,表明足细胞损伤模型建立成功。
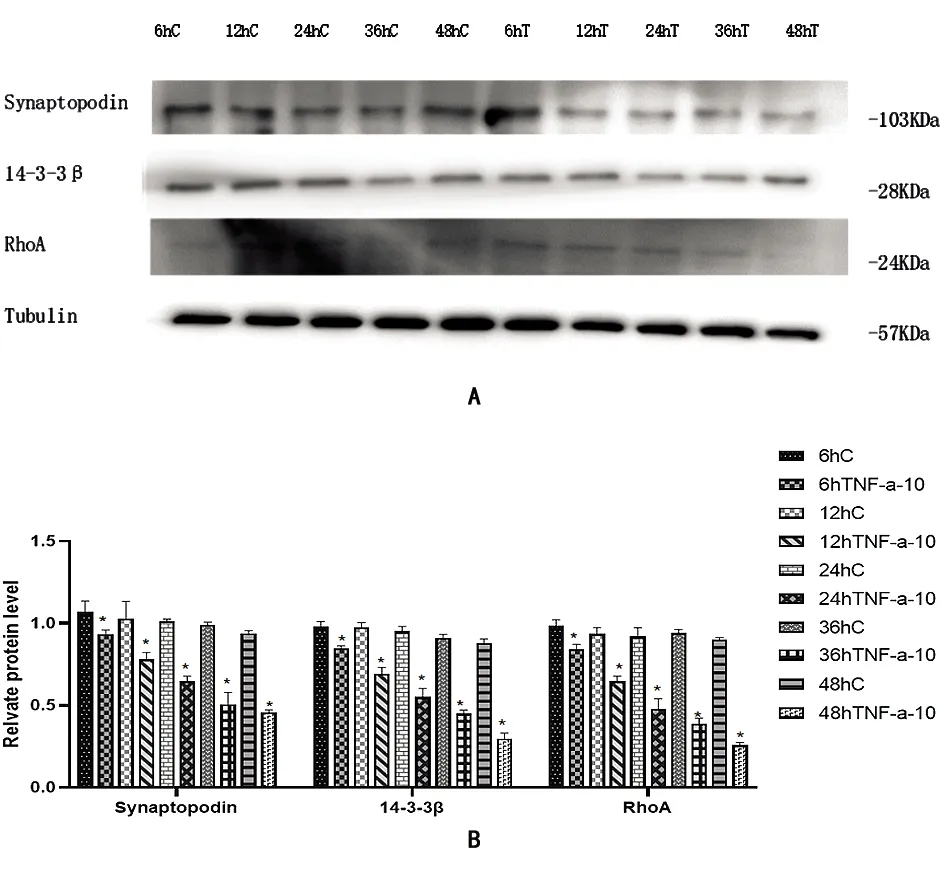
图3 肾足细胞中各组synaptopodin、14-3-3β、RhoA蛋白表达
3 讨论
足细胞是排列在肾小球毛细血管外表面的终末分化细胞,受损后不再具有自愈和再生能力,一旦损伤最终将导致细胞脱落。当足细胞受损,足突出现弥漫性增生或融合以及进一步脱落后形成节段性硬化,最终会导致局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)的形成。FSGS也被称为足细胞病[5],顾名思义造成FSGS的主要原因是足细胞的损伤,尤其是足突的损伤。FSGS是肾病综合征(nephrotic syndrome,NS)中最常见的类型之一,NS是肾小球滤过屏障功能障碍从而引起血液中的蛋白从尿液中被排出的一系列病理以及生理改变的临床综合征[6]。目前全球范围内FSGS患病人数较其他类型的肾小球疾病呈现上升趋势,同时随着FSGS的恶化也是进一步造成终末期肾脏病(End-Stage Renal Disease,ESRD)的重要原因[7]。可以将引起FSGS的因素分为两大类,原发性诱因和继发性诱因,继发性又包括适应性型、病毒相关型、遗传型、药物诱导型和APOL相关型[8],其病因的最大共同点是足细胞损伤或脱落。足细胞的独特功能是建立和维持肾小球正常的滤过功能,因此足细胞损伤以及脱落程度对FSGS病情的发展起着尤为重要的作用[9]。
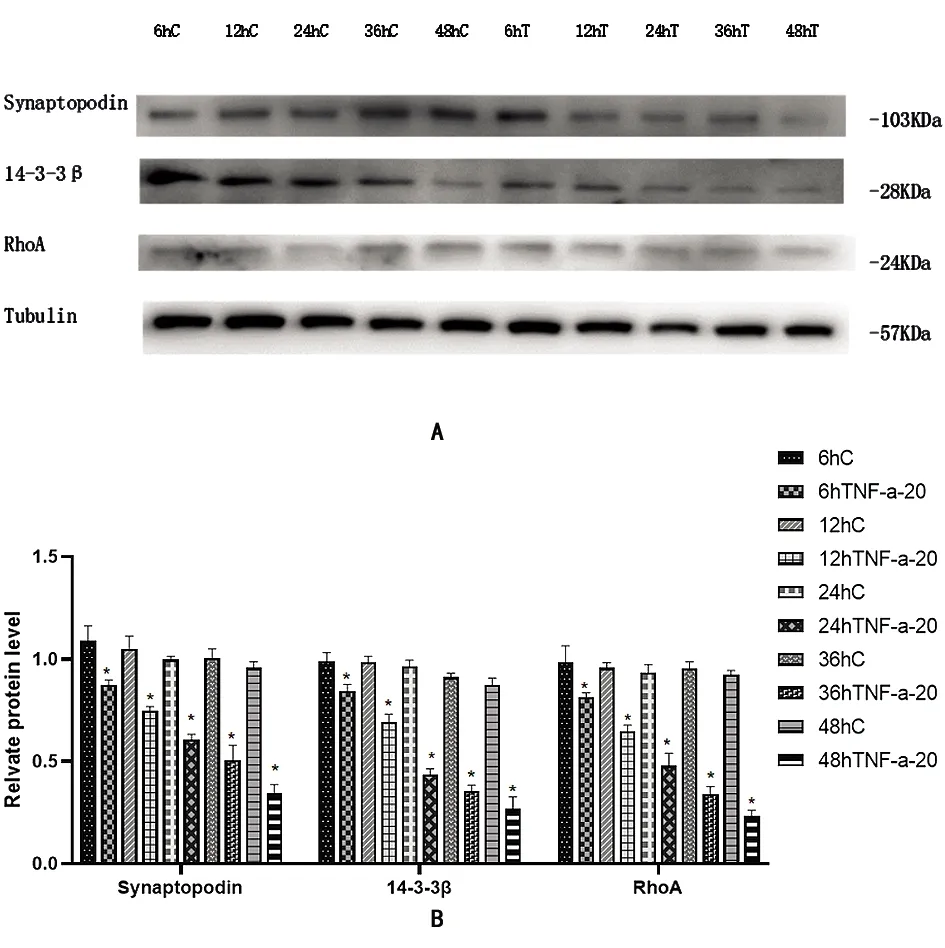
图4 肾足细胞中各组synaptopodin、14-3-3β、RhoA蛋白表达
足细胞能够稳定存在是依赖于细胞骨架,与细胞骨架相关的蛋白质有很多。在TNF-α诱导的足细胞中磷酸化的Synaptopodin减少,14-3-3β乙酰化增加,导致14-3-3β和Synaptopodin解离[10]。钙调神经磷酸酶可阻断Synaptopodin去磷酸化,通过磷酸化的Synaptopodin 与14-3-3β 相互作用来保护Synaptopodin免受组织蛋白酶L的降解[11]。磷酸化的Synaptopodin可以阻止RhoΑ的降解,Synaptopodin的基因沉默抑制了肌动蛋白应力纤维的形成[12],细胞骨架稳定依赖于肌动蛋白应力纤维。由此可以通过14-3-3β、Synaptopodin和RhoA 的表达明显降低证明足细胞损伤模型建立成功。
文献报道阿霉素也可用于建立足细胞损伤模型。阿霉素是一种抗肿瘤抗生素,属于一种周期非特异性抗癌化疗药物,具有较强的毒性作用[13]。有研究表明[14],对小鼠静脉给药后以肾脏毒性最为明显,伴随肝脏毒性、心脏毒性以及生殖毒性等。阿霉素通过诱发肾小球细胞凋亡、诱导氧化应激反应、促进细胞因子的释放、抑制肾小球足细胞周期等,损害肾小球毛细血管袢,造成肾损伤。
本研究结果表明,TNF-α可诱导足细胞的损伤,并且足细胞的损伤程度与TNF-α的作用时间和作用浓度呈正比,即在TNF-α为10 ng/mL和20 ng/mL的作用下,其TNF-α的作用时间在6 h时足细胞已发生损伤且随着作用时间越长足细胞损伤越严重;在相同损伤培养时间24 h下,TNF-α浓度为10 ng/mL时,足细胞出现损伤,且随着浓度增高足细胞损伤越严重。在本研究中,对正常足细胞和TNF-α诱导损伤足细胞进行Western Blot检测发现,14-3-3β、Synaptopodin和RhoA 的表达明显降低。可根据实验需求,选择合适的TNF-α作用浓度及作用时间,为后期研究肾病综合征的预防及其治疗奠定基础。

