大麻二酚对人牙龈间充质干细胞体外成骨分化的影响
王伟峰 李娜
中图分类号:R329.2 文献标志码:A doi:10.3969/j.issn.1001-3733.2021.06.007
人牙龈间充质干细胞(bone marrow mesenchymal stem cell,hGMSCs)具有可塑性强、无免疫排斥、易于获取、来源广泛等优点,是研究细胞骨向分化、骨组织改建等生理过程的理想材料,被越来越多的应用于修复牙组织缺损的研究,如何促进其成骨分化成为研究的热点[1-3]。大麻二酚(cannabidiol,CBD)是从大麻提取的化合物,无神经致幻作用,且药用价值越加明显,可通过腺苷A1途径抑制凋亡、抗氧化自由基等方式治疗多发性硬化、舞蹈病、炎症等[4-5],但CBD对hGMSCs成骨分化的影响,相关报道较少。本研究拟通过研究CBD对hGMSCs成骨分化的影响,为牙组织工程修复提供研究参考。
1 材料与方法
1.1 材料与仪器
碱性磷酸酶(alkaline Phosphatase, ALP)试剂盒(武汉艾美捷科技有限公司);CBD(上海源叶生物科技有限公司);逆转录试剂盒(DBI公司,德国);Trizol试剂盒(Gibco-BRL公司,美国);紫外线分光光度仪(Eppendorf,德国);荧光定量PCR分析仪(BIO-RAD公司,美国);CCK-8试剂盒(南京建成生物工程研究所);BCA蛋白浓度测定检测试剂盒(上海碧云天生物技术公司);茜素红、Notch信号通路抑制剂DAPT(Sigma公司,美国)。
1.2 实验方法
1.2.1 hGMSCs的分离提取和培养 收集进行牙拔除术的健康牙龈组织进行原代培养。将牙龈组织剪碎至1 mm3左右,接种于含适量间充质干细胞培养基(15%FBS、1%青-链霉素、100 mmol/L维生素C)的无菌培养皿中,置于37 ℃、5%CO2的条件下的培养箱中继续培养。每3 d进行1 次换液,当细胞融合到80%~90%的程度时进行传代培养。
1.2.2 hGMSCs的鉴定 取生长状态较好的第三代hGMSCs进行TrypLE消化,离心后制成细胞悬液(5×105/mL),加入1 μL hGMSCs表面标记物CD73、CD90及CD105抗体。室温避光孵育15 min,加入1×FACSTM裂解液,室温避光静置15 min,溶血后离心5 min,弃上清,用含有0.1%NaN3和1%BSA的PBS洗液离心洗涤5 min,弃上清,上Attune NxT流式细胞仪(赛默飞世尔科技公司,美国),Cell Quest Pro软件获取细胞,FlowJo Version 8.7.2软件进行数据分析。
1.2.3 CCK-8法检测CBD对hGMSCs增殖活性的影响 将hGMSCs接种于96孔板(2×103/孔),1 d后PBS洗涤,更换培养液。将96 孔板细胞随机分为8组,分别加入不同浓度的CBD(0、2、4、8、16、32、64、128 μmol/L),空白组hGMSCs仅加入完全培养基,每组样本另设3复孔。培养3 d时,每孔加入10 μL CCK-8工作液,在37 ℃下继续培养4 h,在450 nm波长处测定各孔的吸光度(A)值。绘制细胞增殖曲线。在后续实验中选择对hGMSCs增殖无影响的CBD浓度。
1.2.4 成骨诱导和茜素红染色 将hGMSCs接种于24孔板(1×105个/孔),将成骨诱导培养基(15%FBS、100 mmol/L维生素C、10 nmol/L地塞米松、1.8 mmol/L磷酸二氢钾)分别加入含0、2、4、8 μmol/L CBD的细胞。每3 d换1 次培养基,培养3 周后,每孔细胞加入适量4%多聚甲醛固定20 min,PBS洗涤,加入0.1%茜素红进行染色,10 min后进行蒸馏水冲洗,在室温下风干。观察各组细胞矿化结节染色情况。
1.2.5 ALP活性检测 将hGMSCs接种于24 孔板(1×108个/孔),待细胞融合至80%~90%时,将成骨诱导培养基(15%FBS、100 mmol/L维生素C、10 nmol/L地塞米松、1.8 mmol/L磷酸二氢钾)分别加入含有0、2、4、8 μmol/L CBD的细胞,每3 d换1 次培养基。在第2周时,使用ALP试剂盒检测ALP活性,同时选择405 nm波长,使用酶联仪(艾迪公司,德国)检测hGMSCs的吸光度值,重复上述实验3 次。
1.2.6 成骨相关基因检测 将含有0、2、4、8 μmol/L CBD的细胞进行成骨诱导培养7 d后,TRIzol法提取细胞总RNA,再将RNA逆转录为cDNA,β-actin为内参,用PCR仪和SYBR GREEN试剂盒对各成骨相关基因(Col-1、OCN、Runx2)进行RT-PCR分析。反应体系:SYBR Premix Ex Taq II 10 μL,上下游引物各0.8 μL,cDNA模板2.0 μL,ROX Reference Dye II 0.4 μL,dH2O 6.0 μL,反应条件:在95 ℃条件下进行3 min预变性,在62 ℃条件下退火15 s,73 ℃延伸45 s,扩增30 个循环。2-ΔΔct法计算各成骨相关基因(Col-1、OCN、Runx2)mRNA的相对浓度。引物序列见表1。

表1 各目的基因引物序列Tab 1 The primer sequences of the target genes
1.2.7 Western blot检测Notch信号通路相关蛋白 将hGMSCs接种于六孔板(1×105个/孔),当细胞融合至90%时,将成骨诱导培养基(15%FBS、100 mmol/L 维生素C、10 nmol/L地塞米松、1.8 mmol/L 磷酸二氢钾)分别加入含有0、2、4、8 μmol/L CBD的细胞。培养10 d时加入细胞裂解液,收集蛋白,使用BCA蛋白定量试剂盒检测蛋白浓度。取30 μg蛋白样品,凝胶电泳,分离蛋白后电转至硝酸纤维素膜上,在5%脱脂奶粉封闭液中孵育2 h。加入一抗Notch1(稀释比例1∶1 000)、Hes-1(稀释比例1∶1 000),4 ℃孵育过夜。TBST洗膜3 次,加入二抗(稀释比例1∶3 000),室温孵育1 h。洗膜后曝光显影。以GAPDH为内参。
1.2.8 Notch信号通路抑制剂处理细胞 将hGMSCs接种于六孔板(1×105个/孔),当细胞融合至90%时,将成骨诱导培养基(15%FBS、100 mmol/L 维生素C、10 nmol/L地塞米松、1.8 mmol/L 磷酸二氢钾)分别加入含有2 μmol/L CBD和2 μmol/L CBD+10 μmol/L Notch信号通路抑制剂DAPT,对两组细胞进行茜素红染色、成骨相关基因检测和Notch信号通路相关蛋白WB检测。
1.3 统计学方法
2 结 果
2.1 hGMSCs原代培养分离结果
hGMSCs经原代培养1 周后,组织周边可见梭形细胞;10~12 d后hGMSC融合度可达80%以上;第三代的hGMSC贴壁生长,呈梭形,大小形态均匀。
2.2 hGMSC表面标记物鉴定结果
第三代hGMSC强阳性表达间充质干细胞表面标记物CD73(98.9%)、CD90(96.2%)及CD105(97.4%)(图1)。
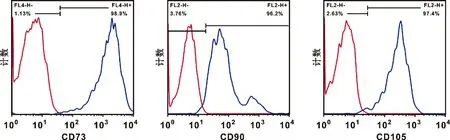
图1 流式检测hGMSC细胞间充质干细胞表面标记物
2.3 CBD对hGMSC细胞增殖的影响
培养至3 d时,CCK-8法检测各组细胞增殖活性,结果显示,与对照组相比,CBD在16~128 μmol/L范围内均能促进hGMSC增殖(P<0.05),当CBD浓度为32 mol/L时促进作用最强。选择不影响细胞增殖的2、4、8 μmol/L CBD进行后续hGMSC骨向分化实验(图2)。
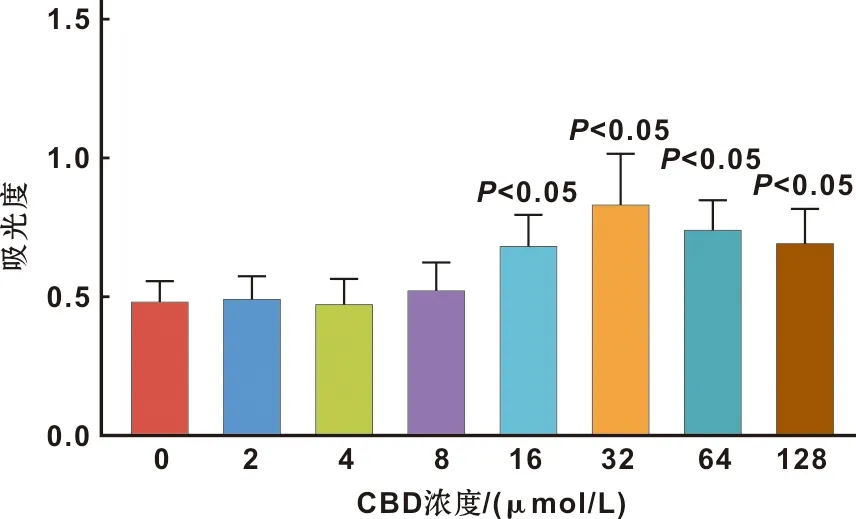
图2 CBD对hGMSCs增殖活性的影响
2.4 各组细胞茜素红染色结果比较
0、2、4、8 μmol/L CBD对hGMSCs进行成骨诱导培养。各组细胞形成矿化结节的矿化面积分别为8.67%±1.09%、15.65%±4.53%、25.67%±6.53%和43.00%±8.76%(P<0.05)(图3)。
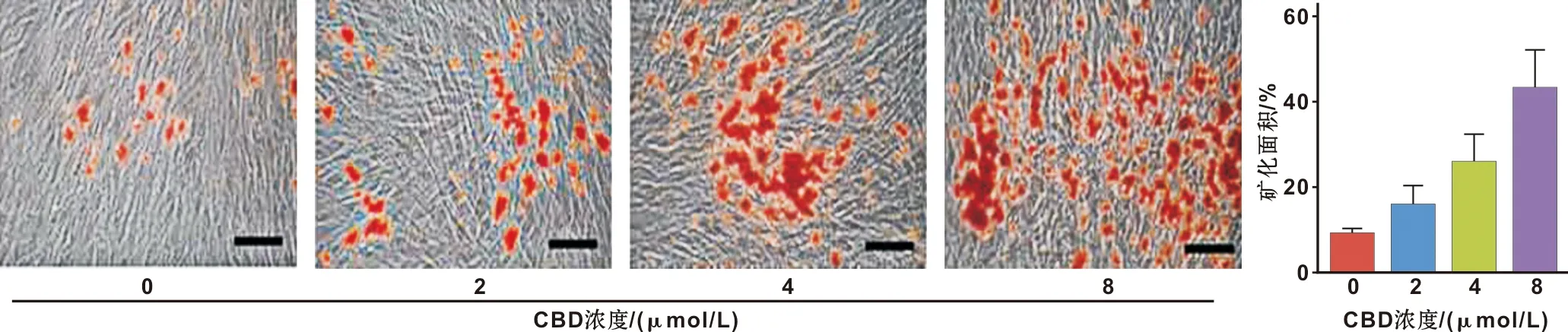
图3 各组hGMSCs细胞茜素红染色结果比较
2.5 各组细胞ALP活性比较
0、2、4、8 μmol/L CBD各组hGMSCs ALP活性分别为0.41±0.08、0.56±0.11、0.74±0.18和0.92±0.33(P<0.05)(图4)。

图4 不同浓度CBD下实验组细胞ALP活性比较 图5 CBD对Col-1、OCN、Runx2 mRNA表达水平的影响
2.6 各组hGMSCs骨向分化基因检测
随着CBD浓度的升高,各组hGMSCs Col-1、OCN、Runx2 mRNA表达水平逐渐升高(P<0.05)(图5)。
2.7 Notch通路相关蛋白检测
Western blot 检测显示,随着CBD浓度的升高,各组hGMSCs细胞中Notch1、Hes-1蛋白表达水平逐渐升高(P<0.05)(图6)。
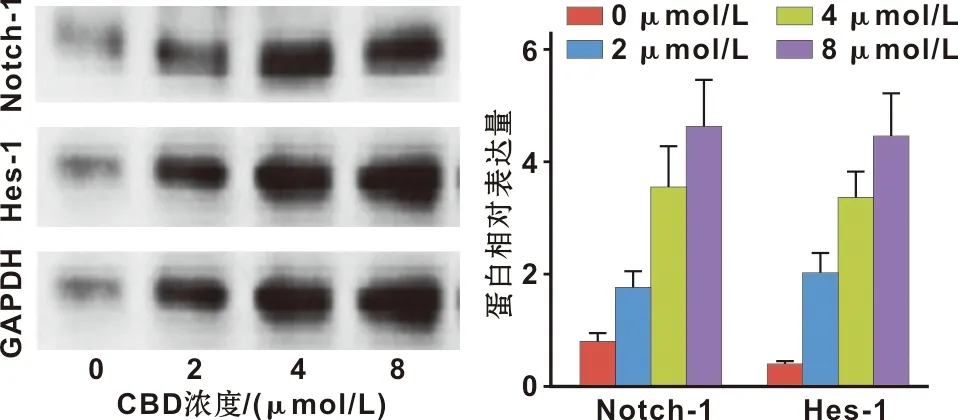
图6 CBD对Notch1、Hes-1蛋白表达水平的影响
2.8 Notch通路抑制剂对hGMSCs成骨分化的影响
hGMSCs细胞分2 μmol/L CBD组和2 μmol/L CBD+DAPT组,茜素红染色结果发现,2 μmol/L CBD+DAPT组矿化面积低于2 μmol/L CBD组(图7A,P<0.05);Col-1、OCN、Runx2 mRNA表达水平低于2 μmol/L CBD组(图7B,P<0.05),Notch1、Hes-1蛋白表达水平低于2 μmol/L CBD组(图7C,P<0.05)。
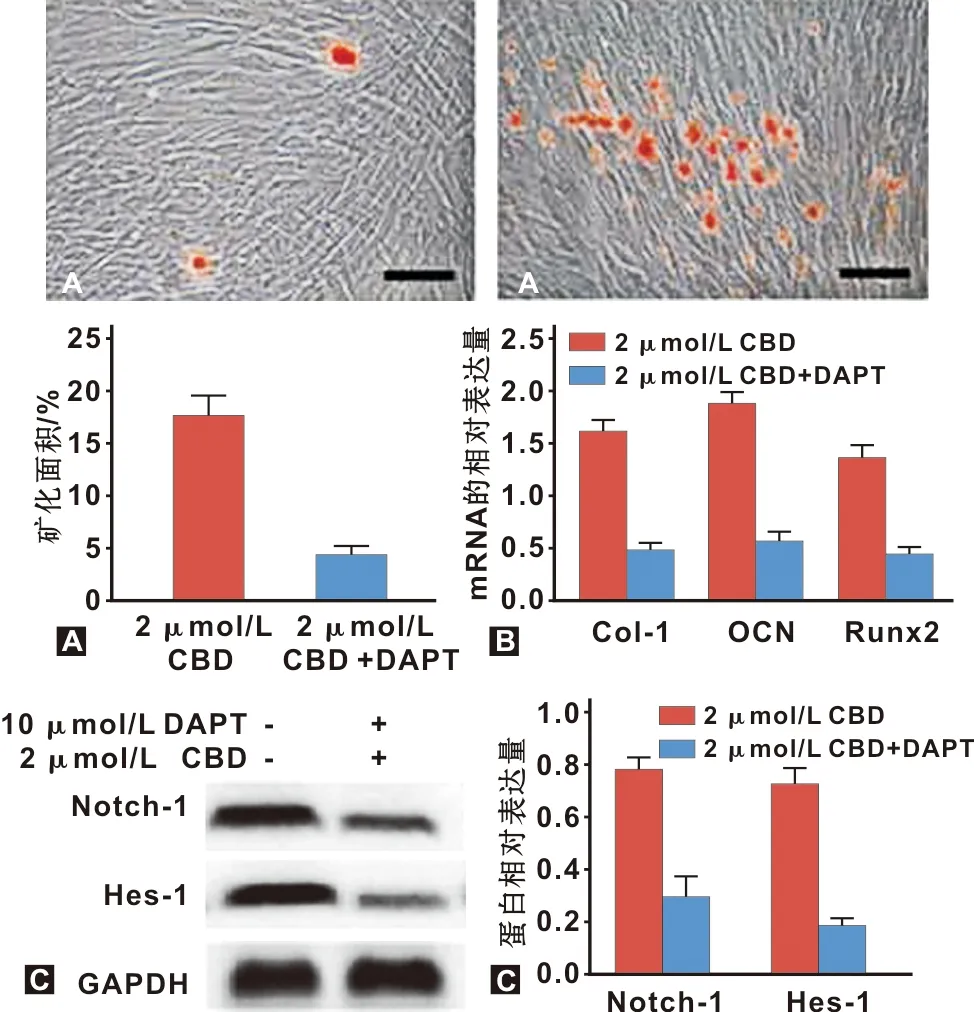
图7 Notch通路抑制剂对hGMSCs细胞成骨分化的影响
3 讨 论
hGMSCs因取材方便,体外培养简单以及多向分化(骨、肌肉、脂肪等)的潜能等优点,成为骨组织工程重要的细胞来源[6-7]。已有相关研究[8]将GMSCs应用于牙周炎的治疗中,研究发现系统移植的GMSCs可以归巢到牙周损伤部位,并促进牙周组织再生。CBD是从大麻化合物中分离的重要化学物质[9-10]。相关研究[11-12]显示,CBD作用于大麻素受体1(Cannabinoid 1 receptor)和大麻素受体2(Cannabinoid 2 receptor),具有抗呕吐、神经保护、保肝、抗炎、抗氧化和抗痉挛等多种作用,但CBD对hGMSCs成骨分化的影响,相关报道较少。本研究通过研究CBD对hGMSCs成骨分化及增殖的影响,旨在探讨CBD对hGMSCs在组织工程修复过程中的作用。
Schmuhl等[13]的研究显示,CBD通过激活p42/44 MAPK途径诱导间充质干细胞的骨向分化能力,并且加强间充质干细胞的矿化能力和碱性磷酸酶的活性,且此作用可被AM-630(CB受体拮抗剂)所抑制。那么对于同样具有多向分化潜能的hGMSCs,CBD是否依然具有诱导其骨向分化和增殖活性的作用?本研究发现,高浓度(16 μmol/L)CBD可以促进hGMSCs增殖。为了探讨CBD对成骨分化的促进作用是否不依赖于增殖,因此选择对细胞增殖无明显影响的浓度进行实验。结果显示,各组细胞均可形成矿化结节,未经CBD作用的hGMSCs矿化面积小,矿化结节颜色较浅,而予以不同浓度CBD作用下实验组hGMSCs的矿化面积均显著大于未经CBD作用的hGMSCs,颜色更深,且随着加入CBD浓度的增高,hGMSCs的矿化面积越来越大,矿化结节颜色越来越深。因此,CBD有促进hGMSCs成骨分化的能力,且随着浓度的升高,CBD对hGMSCs成骨分化的促进能力越强。
ALP是一种金属水解酶是具有成骨细胞活性的重要标记物,存在于细胞核中的ALP与细胞的增殖能力显著相关[14]。ALP活性提升,可促进骨钙素的合成,并抑制糖类降解,诱导糖异生,可促进具有成骨活性的细胞的增殖和分化,并通过抑制胰岛素样生长因子1(insulin-like growth factor 1)抑制破骨因子的生成。本研究发现,予以不同CBD浓度作用下hGMSCs ALP活性均显著大于未经CBD作用hGMSCs的ALP活性,且随着加入CBD浓度的增高,hGMSCs的ALP活性逐渐增高。
Col-1是具有高度有序的自我组装序列的胶原纤维,在骨组织中含量较高[15]。OCN是一种由49个氨基酸组成的维生素K依赖性钙结合蛋白,它主要由成骨细胞合成,在调节骨钙代谢中起重要作用,是研究骨代谢的一项新的生化标志物[16]。Runx2是一种成骨相关转录因子,是骨组织中骨含量的标志物[17]。予以高浓度CBD作用下,hGMSCs 骨向分化基因(Col-1、OCN、Runx2)mRNA表达水平均显著大于未经CBD作用的hGMSCs。因此,CBD可促进hGMSCs骨向分化基因(Col-1、OCN、Runx2)mRNA的上调。
Notch信号通路是一种较为保守的信号通路,通过纤维素合酶(CesA like,CSL)依赖途径参与到细胞增殖与分化、肿瘤血管生成、炎症反应等多个生理病理过程[18-19]。本研究发现,CBD可提高Notch信号通路相关蛋白(Notch1、Hes-1)的表达水平,且较高CBD的浓度有助于Notch信号通路相关蛋白(Notch1、Hes-1)表达水平的提高。Notch信号通路近年来被证实广泛参与体内骨骼系统的成骨过程,是干细胞成骨分化调控的重要机制。通过对hGMSCs进行Notch通路抑制,结果发现,与未添加Notch通路抑制剂的hGMSCs相比,Notch通路抑制剂可以降低hGMSCs成骨相关基因(Col-1、OCN、Runx2 )mRNA表达水平,抑制成骨分化。因此,CBD对于hGMSCs骨向分化作用有可能是通过激活Notch信号通路实现的。
综上所述,大麻二酚可诱导人牙龈间充质干细胞成骨分化并促进其增殖,且随着大麻二酚浓度的升高,其诱导人牙龈间充质干细胞成骨分化作用越强,这种促进作用有可能是通过激活Notch信号通路实现的。

