苯乙基异硫氰酸酯对良性前列腺上皮细胞增殖凋亡的影响及相关机制研究
刘志斌 靳 松 牛亦农
(1.无锡市第二人民医院泌尿外科,江苏无锡 214001; 2.清华大学附属北京清华长庚医院泌尿外科,北京 102200; 3. 首都医科大学附属北京世纪坛医院泌尿外科, 北京 100038)
良性前列腺增生(benign prostatic hyperplasia, BPH)是引起中老年男性排尿功能障碍原因中最常见的一种良性疾病。其主要表现为尿急、尿频、排尿不畅、终末滴沥及夜尿增多等下尿路症状,后期可逐渐加重为排尿困难、尿潴留等。BPH发病率随年龄的增长而增加,60岁男性发病率为50%,70岁男性发病率达80%,85岁以上发病率达90%[1-4]。随着人口老龄化的增加,良性前列腺增生已经成为泌尿外科最常见的疾病之一,严重影响着患者的生活质量。
目前针对前列腺增生的治疗包括药物治疗(5α-还原酶抑制剂、α-肾上腺素能受体拮抗剂、中药制剂以及植物制剂等)和手术治疗(经尿道或开放式手术)。对于大多数有症状的BPH男性,药物治疗是首选的初始治疗方法。
苯乙基异硫氰酸酯(phenethyl isothiocyanate, PEITC)是植物制剂异硫氰酸酯的一种,广泛存在于橄榄、花菜等十字花科蔬菜中[5]。现已发现其在多种肿瘤治疗中具有抑制细胞增殖、促进细胞凋亡的作用[5-6]。现有研究[7]表明,针对良性前列腺增生的治疗中,PEITC可以通过下调雄激素受体转录因子sp1的表达而下调雄激素受体的表达,从而抑制大鼠前列腺上皮细胞的增殖。但对体外培养的良性前列腺上皮细胞的作用还未见相关报道。X染色体连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis, XIAP)是凋亡抑制蛋白家族中的典型成员,可通过抑制启动Caspase-9,从而抑制其效应蛋白Caspase-3和Caspase-7,最终抑制细胞凋亡[8]。
PEITC作为潜在的治疗前列腺增生的植物制剂,能否对前列腺上皮细胞的存活产生影响,能否成为有效的治疗药物尚需进一步研究。本研究采用PEITC作用于前列腺上皮细胞(benign prostatic hyperplasia cell line,BPH-1),观察PEITC对BPH-1细胞增殖、凋亡与自噬的影响;检测XIAP mRNA及其蛋白表达,以及自噬相关蛋白的表达情况,初步探讨PEITC对前列腺上皮细胞增殖凋亡的影响及相关机制。
1 材料与方法
1.1 实验材料
人永生化良性前列腺上皮细胞(BPH-1)购于中国医学科学院细胞中心。PEITC(纯度≥98%)由无锡杰西医药科技有限公司赠送。 二甲基亚砜(dimethyl sulfoxide,DMSO)购买于美国Invitrogen 公司。PEITC使用前用DMSO稀释,同时将等体积的DMSO(最终质量浓度<0.1%)添加到对照组中。细胞培养试剂包括RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS)和青霉素/链霉素抗生素混合物,均购自澳洲Gibco公司。CCK-8细胞增殖毒性检测试剂盒购自日本株式会社同仁化学研究所。Annexin V-FITC/PI细胞凋亡检测试剂盒购自中国南京凯基生物科技公司。XIAP-Atg 5-12和β-actin抗体购自美国Cell Signaling Technology公司。Fast Quant RT试剂盒和Talent qPCR PreMix(SYBR Green)购自北京天根生物科技公司。
1.2 细胞培养及活性检测
BPH-1细胞用含有10%(体积分数)FBS的RPMI-1640培养基于37 ℃,5%(体积分数) CO2条件下培养。取对数期生长的细胞接种于96孔培养板中,每孔1 000个细胞,加入培养基200 μL。37 ℃,5%(体积分数)CO2条件下培养24 h,使细胞贴壁。更换细胞培养基,分别向96孔板中加入终浓度为6、12、24 μmol/L的PEITC作为实验组,对照组加入等体积的DMSO,分别作用6、12、24、36 h。孵育结束后,每孔分别加入10 μL CCK-8溶液,充分混匀,继续孵育2 h。用酶标仪测定各孔450 nm处吸光度,并计算细胞活性。细胞存活率=(实验孔-空白孔)/(对照孔-空白孔)。
1.3 流式细胞技术检测细胞凋亡率
取对数期生长的BPH-1细胞接种于6孔培养板中,每孔5×106个细胞,加入培养基2 mL。37 ℃,5%(体积分数)CO2条件下培养24 h,使细胞贴壁。分别向6孔板中加入终浓度为6、12、24 μmol/L的PEITC作为实验组,对照组加入等体积的DMSO,继续孵育24 h。磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2次,用不含乙二胺四乙酸的胰酶消化后1 200 r/min 离心,弃上清,制备单细胞悬浊液。细胞计数板进行细胞密度计算,计数并调整细胞密度至106个/mL。取1 mL悬浊液,1 200 r/min离心5 min,弃上清。加入400 μL Binding Buffer 及5 μL Annexin-V/FITC 轻混匀,避光冰上放置15 min。加入10 μL PI后轻混匀,避光冰上放置5 min。流式上机检测细胞凋亡率。
1.4 Western blotting法检测细胞蛋白表达水平
取对数期生长的BPH-1细胞接种于6孔培养板中,方法同上,附壁过夜培养24 h。分别向6孔板中加入终浓度为6、12、24 μmol/L的PEITC作为实验组,对照组加入等体积的DMSO,继续孵育24 h。预冷的PBS 3 μL清洗细胞3次,加入含有苯甲基磺酰氟的RIPA细胞裂解液400 μL后置于冰上30 min,充分裂解,取样本置于1.5 mL离心管中。涡旋震荡充分混匀,于4 ℃预冷的离心机内,12 000 r/min离心5 min。取上清液即细胞全蛋白。BCA法制作标准曲线,测定蛋白浓度。制备10%(质量分数)的SDS-PAGE分离胶及聚集胶。配平后,分别加样Loading Buffer及蛋白共10 μL,80 V恒压电泳。400 mA恒流电转90 min,将蛋白转移至PVDF膜上。脱脂牛奶封闭抗原30 min,TBST清洗3次,每次10 min。XIAP抗体,Atg5-12 抗体1∶1 000稀释,β-actin 抗体1∶1 500稀释。4 ℃孵育抗体过夜,TBST洗脱3次,孵育二抗2 h。Odyssey双色红外激光成像系统曝光,软件Image J V 4.0计算蛋白表达。
1.5 Real-time PCR 检测BPH-1细胞XIAP mRNA表达
按照如上方式培养BPH-1细胞24 h,采用TRIzol-异丙醇-氯仿-乙醇三步法进行细胞总RNA提取。测定RNA浓度,用QuantScript Kit将1mg总RNA反转录为cDNA。 然后按照Talent荧光定量检测试剂盒(SYBR Green),25 μL反应体系配比各试剂。RT-PCR反应引物及体系如下:XIAP反应引物为:Forward:5′-TACCGTGCGGTGCTTTAGTT-3′;Reverse:5′-TTTGTAGACTGCGTGGCACT-3′;GAPDH反应引物为:Forward:5′-GAAGGTGAAGGTCGGATGC-3′;Reverse:5′-GAAGATGGTGATGGGATTTC-3′;反应体系:预变性:95 ℃,15 min;变性:95 ℃、10 s;退火:57 ℃、30 s;延伸:72 ℃、30 s,40个循环。所得数据与内参GAPDH之比作为相对值,通过公式2-ΔΔCt计算得到目的基因的相对表达量。
1.6 统计学方法
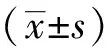
2 结果
2.1 PEITC对BPH-1细胞增殖的影响
BPH-1细胞经过6、12、24 μmol/L PEITC 处理6 h后,细胞相对活性分别为71.22%、48.90%、13.57%;处理12 h后细胞相对活性分别为52.57%、42.37%、10.11%;处理24 h后细胞相对活性分别为36.73%、25.88%、8.39%;处理36 h后,细胞相对活性分别为33.57%、25.83%、13.06%(图1)。细胞相对活性呈现时间和浓度依赖性。
2.2 流式细胞技术检测PEITC对于BPH-1细胞凋亡的影响
Annexin-V/PI 染色结果如下图所示(图2A)。BPH-1细胞经过6、12、24 μmol/L PEITC处理24 h后,细胞总凋亡率分别为19.5%、30.4%、40.1% (图2B),与对照组相比,12、24 μmol/L处理组差异具有统计学意义(P<0.05)。
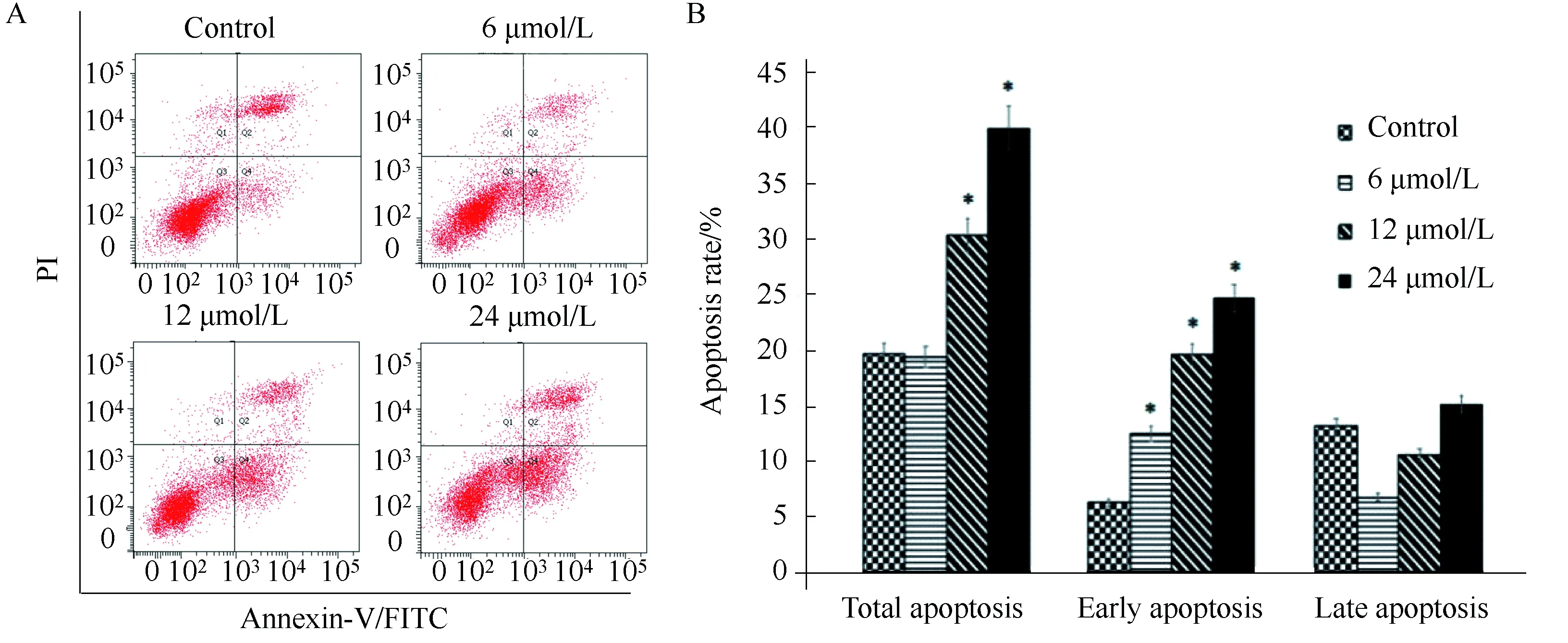
图2 PEITC处理的BPH-1细胞的细胞凋亡率Fig.2 Apoptosis of BPH-1 cells treated with PEITCA: PEITC promoted apoptosis of BPH-1 cells; B: PEITC promoted early apoptosis of BPH-1 cells in a concentration-dependent; *P<0.05 vs control. Early apoptosis: Annexin V+/PI-; Late apoptosis: Annexin V+/PI+; PEITC: phenethyl isothiocyanate; BPH-1: benign prostatic hyperplasia cell line.
2.3 PEITC下调XIAP蛋白表达
Western blotting结果显示,BPH-1细胞经过6、12、24 μmol/L PEITC 处理24 h后,细胞内XIAP蛋白表达量较对照组下降(图3)。
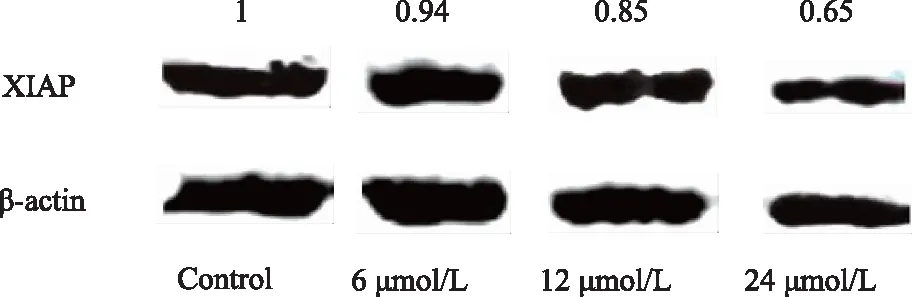
图3 PEITC对BPH-1细胞中XIAP表达的影响Fig.3 The effects of PEITC on the expression of XIAP in BPH-1 cells PEITC suppressed the expression of XIAP in BPH-1 cells in a concentration-dependent way. β-Actin was used as a loading control; PEITC: phenethyl isothiocyanate; BPH-1: benign prostatic hyperplasia cell line; XIAP: X-linked inhibitor of apoptosis.
2.4 PEITC下调XIAP mRNA的表达
Real-time PCR结果显示,BPH-1细胞经过6、12、24 μmol/L PEITC处理24 h后,XIAP mRNA相对表达量较对照组分别下调了1.212倍、1.37倍、2.918倍。与对照组相比,12、24 μmol/L处理组差异具有统计学意义(P<0.05)(图4)。
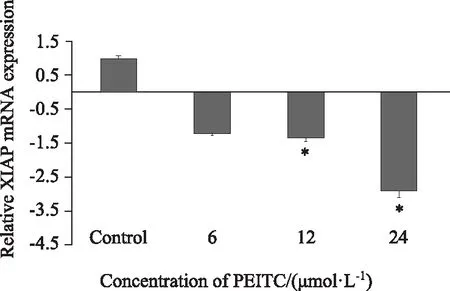
图4 PEITC对BPH-1细胞中XIAP mRNA表达的影响Fig.4 The effects of PEITC on the expression of XIAP mRNA in BPH-1 Cells Suppressed transcription of XIAP mRNA was detected with real-time PCR in BPH-1 cells treated with PEITC. The level of mRNA was normalized to the value of the β-actin housekeeping gene mRNA.*P<0.05 vs control; PEITC: phenethyl isothiocyanate;BPH-1: benign prostatic hyperplasia cell line; XIAP: X-linked inhibitor of apoptosis.
2.5 PEITC下调Atg5-12 蛋白的表达
Western blotting结果显示,BPH-1细胞经过6、12、24 μmol/L PEITC 处理24 h后,细胞内XIAP蛋白表达量较对照组下降(图5)。
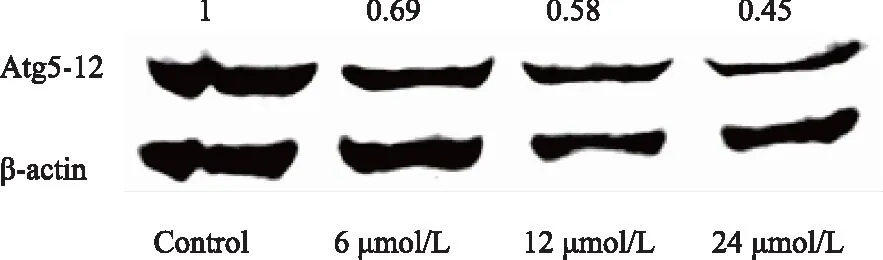
图5 PEITC对BPH-1细胞中Atg5-12表达的影响Fig.5 The effects of PEITC on the expression of Atg 5-12 in BPH-1 cells PEITC suppressed the expression of Atg5-12 protein in a concentration-dependent way in BPH-1 cells.β-Actin was used as a loading control. PEITC: phenethyl isothiocyanate; BPH-1: benign prostatic hyperplasia cell line.
3 讨论
前列腺的正常大小有赖于腺体内细胞增殖与程序性死亡的平衡,细胞的过度增殖和程序性死亡的减少均可导致前列腺体积的增大[9]。细胞程序性死亡是多细胞有机体为了调控机体发育,维护内环境稳定,由基因控制的细胞主动死亡过程。在正常组织中,细胞增殖速率和细胞死亡速率间保持平衡状态。一旦平衡失调,无论是细胞复制速率增加还是细胞程序性死亡速率减少,都将导致前列腺增生[10]。
本研究前期实验显示,不同浓度的PEITC处理细胞时,在相同的处理时间内,随着药物浓度的增加,BPH-1细胞相对存活率下降。在同等浓度作用下,随着药物作用时间的增加,细胞的相对存活率也逐渐下降,并在作用24 h后,细胞的相对活性下降至50%以下。同时本研究显示,作用36 h后细胞的相对活性相比于作用24 h后不再下降,说明PEITC在作用24 h后可以达到最大的抑制效果。因此在后续实验中,笔者选择不同浓度的PEITC作用BPH-1细胞24 h观察实验结果。
本研究显示,随着PEITC浓度的增加,细胞总凋亡率及早期凋亡率也逐渐增加。说明PEITC可诱导BPH-1细胞产生凋亡,并呈现出剂量依赖性。
细胞程序性死亡包括细胞凋亡及细胞自噬。细胞凋亡是细胞的特殊程序性死亡之一,目前研究[11-12]表明,细胞凋亡主要有死亡受体途径和线粒体途径。无论哪种途径,细胞凋亡信号最终需要Caspase酶的激活而执行。目前已发现的Caspase有11种,分为两类,一部分是以Caspase-2、Caspase-8、Caspase-9和Caspase-10为代表的凋亡起始相关蛋白,一部分是以Caspase-3、Caspase-6和Caspase-7为代表的凋亡执行蛋白。其中Caspase-9作为重要的启动因子,发挥重要的作用[11, 13]。Caspase-9与Apaf-1(apoptotic protease activating factor-1)结合为复合物而激活,然后激活下游的效应分子Caspase-3产生凋亡级联反应而引起凋亡的发生[14]。XIAP可竞争性与Apaf-1结合,通过抑制Caspase-9-Apaf-1复合体的产生而抑制细胞凋亡[15]。Sakao等[16]报道,在前列腺癌细胞中,PEITC可以通过下调XIAP蛋白的表达而诱导细胞凋亡。本研究结果表明,PEITC作用于BPH-1细胞24 h后,随着PEITC浓度的增加,XIAP的表达量逐渐下降。同样地,Real-time PCR结果表明,随着PEITC作用浓度的增加,XIAP mRNA表达量逐渐下调。说明PEITC通过下调BPH-1中XIAP mRNA的表达来降低XIAP蛋白表达,并呈现出剂量依赖性,从而促进了BPH-1细胞的凋亡。
细胞的程序性死亡除了凋亡还包括自噬。自噬是面对外界环境刺激而自发程序性出现的细胞分解代谢过程,其通过自噬溶酶体途径来维持内环境的稳定[17-18]。自噬过程受到一系列自噬相关蛋白的调控,研究[19-20]显示,自噬相关蛋白Atg5在自噬形成过程中必不可少。Atg5泛素化修饰Atg12后,与其形成Atg5-12复合体,促进自噬囊泡的形成,后者是自噬发生的关键效应。研究[21]结果表明,诱导Atg 5的表达可以促进自噬的发生。Bommareddy等[22]报道了在前列腺癌细胞中,PEITC可以通过上调Atg5蛋白表达从而诱导细胞自噬及凋亡。随后笔者检测了BPH-1细胞在不同浓度PEITC作用下Atg5蛋白的表达变化。结果显示,随着PEITC浓度的增加,Atg5蛋白表达量逐渐下降。结果恰恰与在前列腺癌细胞中的作用相反,PEITC处理后BPH-1细胞自噬的过程受到了抑制。目前对于细胞凋亡及自噬相关性还没有统一的观点。有学者[23-24]提出,细胞凋亡和自噬是相互抑制的。例如在淋巴细胞模型中发现,通过抑制细胞自噬过程可提高细胞凋亡的比例[23]。也有研究[24]结果表明,在肝癌细胞中,用Atg5 siRNA干扰后,细胞自噬作用受到显著抑制,同时细胞凋亡比例显著增加。本研究结果与此相一致,PEITC通过下调Atg 5 蛋白的表达而抑制BPH-1细胞自噬的发生,可能由此促进了细胞的凋亡。
综上所述,PEITC 抑制前列腺上皮细胞增殖,通过下调 BPH-1中XIAP mRNA降低XIAP蛋白表达,促进前列腺上皮细胞的凋亡并呈现出剂量依赖性;同时PEITC下调了自噬相关蛋白Atg-5;PEITC对凋亡与自噬的调节可能存在相关性。

