肺表面活性物质联合机械通气治疗新生儿呼吸窘迫的疗效及CRP水平分析
王宁
淄博市桓台县妇幼保健院儿科,山东淄博256400
新生儿呼吸窘迫综合征(NRDS)具有病情进展快、起病急骤、病死率高等特点,其主要发病基础为肺泡表面缺乏活性物质,肺部发育不成熟,导致肺顺应性降低,肺泡进行性萎缩,毛细血管气体弥散功能障碍,进而影响患儿氧合功能、肺泡功能[1-3]。目前,临床针对NRDS的治疗多以机械通气为主,虽可有效预防机体二氧化碳蓄积、缺氧现象,维持气道通畅,但仍有部分患儿效果不佳[4]。欧洲新生儿呼吸窘迫综合征防治指南[5]于2013年提出,NRDS患儿需尽早接受肺表面活性物质治疗,以减少并发症,改善肺部氧合功能,降低肺泡表面张力。为进一步探讨肺表面活性物质联合机械通气治疗NRDS的可行性与安全性,该研究选择2019年11月—2021年3月收治的116例NRDS患儿,分析该联合方案对NRDS疗效、呼吸力学、炎症反应的影响。现报道如下。
1 资料与方法
1.1 一般资料
该研究符合医院医学伦理委员会批准,将就诊于该院的116例NRDS患儿纳入研究,按随机数表法分组。对照组58例,男32例,女26例;胎龄28~41周,平均胎龄(34.26±3.46)周;平均出生体质量(3.01±0.49)kg,平均Apgar评分(8.56±0.57)分;足月儿14例,早产儿44例。研究组58例,男30例,女28例;胎龄28~40周,平均胎龄(35.06±2.97)周;平均出生体质量(3.12±0.58)kg,平均Apgar评分(8.69±0.48)分;足月儿12例,早产儿46例。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
纳入标准:①符合《欧洲新生儿呼吸窘迫综合征防治指南》中NRDS诊断标准并经影像学明确诊断者;②胸片X线提示Ⅲ、Ⅵ级达到辅助通气标准;③患儿家属自愿签署知情同意书。排除标准:①伴有新生儿重症肺炎、Ⅱ型呼吸衰竭、重度窒息、气胸、肺气肿、肺出血等疾病患者;②合并先天性呼吸系统畸形、先天性心脏病等严重复杂先天性疾病者;③胎粪、羊水吸入,胎膜早破时间超过24 h者;④无自主呼吸或出现持续性肺动脉高压者;⑤合并多器官功能衰竭、休克者;⑥伴有严重遗传疾病者;⑦病死者。
1.3 方法
所有患儿均接受抗感染、消炎、改善微循环等基础治疗,对照组接受机械通气治疗:仪器选用型号为ResPlus型机械通气呼吸机,模式采用S/T模式,初始呼气正压为0.388~0.588 kPa,吸气正压为0.784~0.976 kPa,氧流量为6~8 L/min,呼吸频率为2~38次/min,治疗48 h。待患儿病情稳定后停机观察。研究组实施机械通气(治疗方法与对照组相同)+肺表面活性物质治疗:将猪肺磷脂注射液(国药准字HJ20181202;规格:3 mL:0.24 g)摇匀稀释,加热至36~37℃,患儿取仰卧位,清理呼吸道,气管插管,经气管导管将200 mg/kg猪肺磷脂注射液分2次(间隔时间为5 min)注入。
1.4 观察指标
①疗效。治疗12 h内,X线显示双肺纹理清晰,动脉血氧饱和度>85%,临床症状完全缓解视为显效;治疗12 h内,X线显示双肺阴影面积降低,临床症状明显好转,动脉血氧饱和度在70%~85%视为有效;不符合上述标准视为无效。②记录两组机械通气时间、呼吸暂停次数、给氧时间、住院时间。③呼吸力学。采用呼气末屏气法测定患儿治疗前、治疗48 h后的气道阻力、内源性呼气末正压、静态顺应性。④炎症因子。采集所有患儿治疗前、治疗48 h后的3 mL空腹肘静脉血,离心取上清液,通过放射比浊法测定CRP,通过酶联免疫吸附法测定HMGB-1、MIF-1、TGF-β1。
1.5 统计方法
采用SPSS 24.0统计学软件进行数据分析,计量资料的表达方式为(±s),组间差异比较采用t检验;计数资料的表达方式为[n(%)],组间差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组疗效对比
研究组治疗总有效率(94.83%)比对照组(81.03%)高,差异有统计学意义(P<0.05)。见表1。
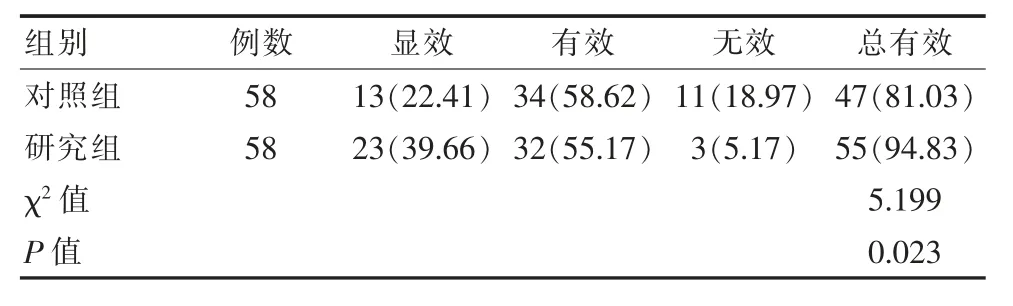
表1 两组患儿疗效对比[n(%)]Table 1 Comparison of curative effect between the two groups of children[n(%)]
2.2 两组机械通气相关指标对比
研究组机械通气时间、给氧时间、住院时间和呼吸暂停次数优于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患儿机械通气相关指标对比(±s)Table 2 Comparison of related indexes of mechanical ventilation between the two groups of patients(±s)
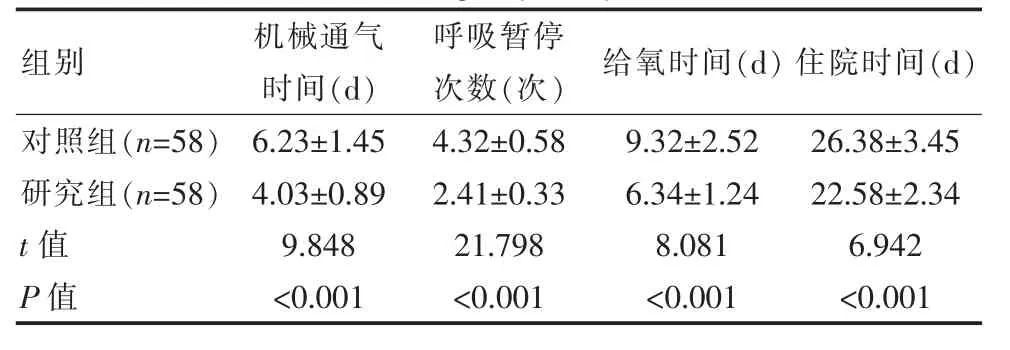
表2 两组患儿机械通气相关指标对比(±s)Table 2 Comparison of related indexes of mechanical ventilation between the two groups of patients(±s)
?
2.3 两组呼吸力学对比
研究组治疗后气道阻力、内源性呼气末正压比对照组低,静态顺应性比对照组高,差异有统计学意义(P<0.05)。见表3。
表3 两组患儿呼吸力学对比(±s)Table 3 Comparison of respiratory mechanics between the two groups of patients(±s)

表3 两组患儿呼吸力学对比(±s)Table 3 Comparison of respiratory mechanics between the two groups of patients(±s)
注:相比该组治疗前,aP<0.05
?
2.4 两组血清炎症指标
研究组治疗后CRP、HMGB-1、MIF-1、TGF-β1水平比对照组低,差异有统计学意义(P<0.05)。见表4。
表4 两组患儿血清炎症指标对比(±s)Table 4 Comparison of serum inflammation indexes between the two groups of children(±s)

表4 两组患儿血清炎症指标对比(±s)Table 4 Comparison of serum inflammation indexes between the two groups of children(±s)
注:相比该组治疗前,aP<0.05
?
3 讨论
肺表面活性物质缺乏可造成肺泡壁表面张力增高、肺泡广泛萎缩、顺应性降低,出现二氧化碳潴留、低氧血症等生理变化,进而增加肺毛细血管通透性,导致肺泡表面上纤维蛋白沉积[6-7]。因此,肺表面活性物质替代疗法得到国内外研究的高度重视。
该研究中,研究组治疗总有效率(94.83%)比对照组(81.03%)高,机械通气时间、给氧时间、住院时间较短,呼吸暂停次数较少,且呼吸力学指标改善程度较大。李慧娟等[8]研究发现,肺表面活性物质联合双相正压通气组治疗总有效率(93.3%)比双相正压通气组(80.0%)高,氧疗时间(239.75±112.42)d、住院时间(25.25±4.86)d均比双相正压通气组短(278.53±115.37)d、(32.16±6.49)d,与该研究结果相近。黄方等[9]研究报道,在双水平正压通气基础上加用肺表面活性物质可快速减轻患儿临床症状,改善肺氧合功能参数,与该研究结论相似。分析原因在于机械通气可通过模拟患儿正常呼吸状态,增加每分通气量及呼吸潮气量,纠正通气/血流比值,降低自主呼吸频率,减少呼吸肌做功,预防呼吸肌疲劳,可达到改善血气分析及肺泡氧合功能、提升肺顺应性、预防肺泡萎陷等目标[10-11]。肺表面活性物质主要成分为表面活性物质结合蛋白及二棕榈酰卵磷脂,可与肺泡表面活性物质相结合,利于维持肺泡容量稳定,保持人体功能残气量,预防肺泡毛细血管内物质经肺泡滤出;同时其具有良好的抗炎、抗菌作用,可阻滞细胞因子分泌,进而降低炎症反应;肺表面活性物质可清除肺液,维持肺泡毛细血管间液体平衡[12-13]。因此,肺表面活性物质在机械通气的作用下,可迅速均匀、充分分布于肺泡内,维持肺泡大小稳定,降低肺部液气界张力,改善肺泡氧合指数、换气功能,预防肺泡-毛细血管受损,避免肺泡内液体渗出[14]。
研究发现,机体炎症-抗炎症反应平衡失调是诱发NRDS形成的原因之一,故调节炎症因子表达在治愈NRDS中尤为关键[15]。CRP是一种急性时相蛋白,参与机体应激反应及炎症反应中。HMGB-1属于一类新型炎性介质,可加剧炎性级联反应,诱发局部炎症,促使炎症反应向其他部分迁移。MIF-1可阻止单核巨噬细胞游走,促使诸多炎性细胞持续浸润于肺泡中,并大量分泌炎性因子,加剧肺泡损伤及炎症反应[16-17]。TGF-β1可导致细胞炎症因子向肺泡上皮组织浸润,造成细胞因子失衡。研究组治疗后CRP、HMGB-1、MIF-1、TGF-β1水平比对照组低,证实肺表面活性物质联合机械通气治疗可缓解NRDS患儿肺部炎症反应,抑制细胞炎症因子。分析原因可能与二者联合可减轻肺泡上皮间质炎症反应,预防巨噬细胞、单核细胞对肺泡组织浸润,抑制下游信号通路活化,进而缓解炎症反应有关[18]。
综上所述,NRDS患儿接受肺表面活性物质联合机械通气治疗的效果明显,可缩短机械通气时间,改善呼吸力学,抑制细胞炎症因子浸润肺泡上皮组织,减轻肺功能损伤。

